I.第四周期中的18种元素具有重要的用途,在现代工业中备受青睐。
(1)基态Cr原子中,电子占据最高能层的符号为
(2)元素Zn与Ga中,第一电离能较大的是
(3)
 (氟酸锑)是一种超强酸,存在
(氟酸锑)是一种超强酸,存在 ,该离子的空间构型为
,该离子的空间构型为 具有相同空间构型和键合形式的分子是
具有相同空间构型和键合形式的分子是(4)已知
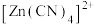 与甲醛在水溶液中发生反应可生成一种新物质
与甲醛在水溶液中发生反应可生成一种新物质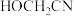 ,试判断新物质中碳原子的杂化方式
,试判断新物质中碳原子的杂化方式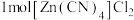 中的
中的 键数为
键数为Ⅱ.配合物 能够通过插入或部分插入的模式与
能够通过插入或部分插入的模式与 作用,它可由
作用,它可由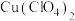 、
、 (结构简式如题图-1所示)
(结构简式如题图-1所示) 等为原料制备。
等为原料制备。
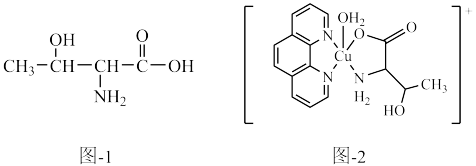
(5)与
 互为等电体子的一种分子的化学式为
互为等电体子的一种分子的化学式为(6)配合物X中配离子的结构如题图-2所示,则配位原子为
更新时间:2024-04-01 09:03:18
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】已知尿素的结构式为 : 尿素可用于制有机铁肥,主要代表物有三硝酸六尿素合铁(Ⅲ),化学式为[Fe(H2NCONH2)6](NO3)3。
: 尿素可用于制有机铁肥,主要代表物有三硝酸六尿素合铁(Ⅲ),化学式为[Fe(H2NCONH2)6](NO3)3。
(1)基态Fe3+的核外电子排布式为______ ;C、N、O三种元素的第一电离能由大到小的顺序是______ 。
(2)尿素分子中N原子的杂化方式是______ 。
(3)NH+4中H—N—H键角比NH3中H—N—H键角大,原因为______ 。
(4)CO2和NH3是工业上制备尿素的重要原料,固态CO2(干冰)的晶胞结构如图所示。
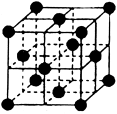
①1个CO2分子周围等距离且距离最近的CO2分子有______ 个。
②NaCl晶胞也为面心立方结构,已知NaCl晶体密度为 g·cm-3,NA表示阿伏加德罗常数,则NaCl晶胞体积为
g·cm-3,NA表示阿伏加德罗常数,则NaCl晶胞体积为______ cm3
 : 尿素可用于制有机铁肥,主要代表物有三硝酸六尿素合铁(Ⅲ),化学式为[Fe(H2NCONH2)6](NO3)3。
: 尿素可用于制有机铁肥,主要代表物有三硝酸六尿素合铁(Ⅲ),化学式为[Fe(H2NCONH2)6](NO3)3。(1)基态Fe3+的核外电子排布式为
(2)尿素分子中N原子的杂化方式是
(3)NH+4中H—N—H键角比NH3中H—N—H键角大,原因为
(4)CO2和NH3是工业上制备尿素的重要原料,固态CO2(干冰)的晶胞结构如图所示。

①1个CO2分子周围等距离且距离最近的CO2分子有
②NaCl晶胞也为面心立方结构,已知NaCl晶体密度为
 g·cm-3,NA表示阿伏加德罗常数,则NaCl晶胞体积为
g·cm-3,NA表示阿伏加德罗常数,则NaCl晶胞体积为
您最近半年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐2】钛、铁、铜、钐等过渡金属有着广泛的用途。请回答下列问题:
(1)铁在元素周期表中的位置_______ ,基态铜原子的核外电子排布式为_______ 。
(2)配合物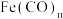 常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断
常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断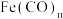 晶体属于
晶体属于_______ (填晶体类型)。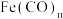 的中心原子价电子数与配体提供电子数之和为18,则n=
的中心原子价电子数与配体提供电子数之和为18,则n=_______ 。
(3) ]溶液可用于检验
]溶液可用于检验_______ (填离子符号)。 的四卤化物熔点如下表所示,
的四卤化物熔点如下表所示, 熔点高于其他三种卤化物,自
熔点高于其他三种卤化物,自 至
至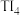 熔点依次升高,原因是
熔点依次升高,原因是_______ 。
(4)一种四方结构的超导化合物的晶胞结构如图1所示,晶胞中Sm和As原子的投影位置如图2所示。
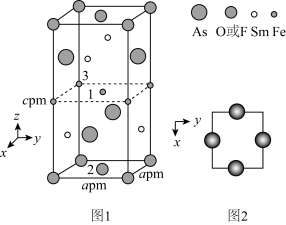
图中 和
和 共同占据晶胞的上下底面位置,若两者的比例依次用x和1-x代表,则该化合物的化学式表示为
共同占据晶胞的上下底面位置,若两者的比例依次用x和1-x代表,则该化合物的化学式表示为_____ ,通过测定密度 和晶胞参数,可以计算该物质的x值,完成它们关系表达式:
和晶胞参数,可以计算该物质的x值,完成它们关系表达式:
_______  。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图1中原子1的坐标为(
。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图1中原子1的坐标为( ,
, ,
, ),则原子2和3的坐标分别为
),则原子2和3的坐标分别为______ 、_____ 。
(1)铁在元素周期表中的位置
(2)配合物
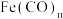 常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断
常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断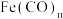 晶体属于
晶体属于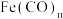 的中心原子价电子数与配体提供电子数之和为18,则n=
的中心原子价电子数与配体提供电子数之和为18,则n=(3)
 ]溶液可用于检验
]溶液可用于检验 的四卤化物熔点如下表所示,
的四卤化物熔点如下表所示, 熔点高于其他三种卤化物,自
熔点高于其他三种卤化物,自 至
至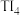 熔点依次升高,原因是
熔点依次升高,原因是| 化合物 |  |  |  |  |
| 熔点/C | 377 | -24.12 | 38.3 | 155 |
(4)一种四方结构的超导化合物的晶胞结构如图1所示,晶胞中Sm和As原子的投影位置如图2所示。

图中
 和
和 共同占据晶胞的上下底面位置,若两者的比例依次用x和1-x代表,则该化合物的化学式表示为
共同占据晶胞的上下底面位置,若两者的比例依次用x和1-x代表,则该化合物的化学式表示为 和晶胞参数,可以计算该物质的x值,完成它们关系表达式:
和晶胞参数,可以计算该物质的x值,完成它们关系表达式:
 。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图1中原子1的坐标为(
。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图1中原子1的坐标为( ,
, ,
, ),则原子2和3的坐标分别为
),则原子2和3的坐标分别为
您最近半年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】氢能的存储是氢能应用的主要瓶颈,配位氢化物、富氢载体化合韧是目前所采用的主要储氢材料。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。在基态Ti中,价电子排布式为____ ,价电子排布图为____
(2)液氨是富氢物质,是氢能的理想载体,利用N2+3H2 2NH3,实现储氢和输氢。下列说法正确的是
2NH3,实现储氢和输氢。下列说法正确的是_____ ;
a.NH3分子中氮原子的轨道杂化方式为sp2杂化
b.NH+4与PH+4、CH4、BH-4、ClO—4互为等电子体
c.相同压强时,NH3的沸点比PH3的沸点高
d.[Cu(NH3)4]2+离子中,N原子是配位原子
(3)用价层电子对互斥理论推断SnBr2分子中,Sn原子的轨道杂化方式为__________ ,
SnBr2分子中 Sn-Br的键角______ 120°(填“>”“<”或“=”)。
(4) NiO 的晶体结构与氯化钠相同, 在晶胞中镍离子的配位数是_______ 。
已知晶胞的边长为 a nm, NiO 的摩尔质量为 b g·mol-1, NA为阿伏伽德罗常数的值, 则NiO 晶体的密度为_________ g·cm-3。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。在基态Ti中,价电子排布式为
(2)液氨是富氢物质,是氢能的理想载体,利用N2+3H2
 2NH3,实现储氢和输氢。下列说法正确的是
2NH3,实现储氢和输氢。下列说法正确的是a.NH3分子中氮原子的轨道杂化方式为sp2杂化
b.NH+4与PH+4、CH4、BH-4、ClO—4互为等电子体
c.相同压强时,NH3的沸点比PH3的沸点高
d.[Cu(NH3)4]2+离子中,N原子是配位原子
(3)用价层电子对互斥理论推断SnBr2分子中,Sn原子的轨道杂化方式为
SnBr2分子中 Sn-Br的键角
(4) NiO 的晶体结构与氯化钠相同, 在晶胞中镍离子的配位数是
已知晶胞的边长为 a nm, NiO 的摩尔质量为 b g·mol-1, NA为阿伏伽德罗常数的值, 则NiO 晶体的密度为

您最近半年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
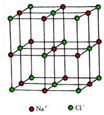
【推荐1】A、B、C、D、E是元素周期表中原子序数依次增大的前四周期元素。A、B、C同周期,且A元素原子核外s能级有1个未成对电子;C元素的原子序数比B多1,且C元素的原子核外p电子比s电子少1;D元素的原子价电子有6个未成对电子,它的一种化合物常用于检验酒驾;E元素的原子序数为27。请回答下列问题:
(1)第一电离能介于A和C之间的同周期元素有________________ (填元素符号)。
(2)C元素的最高价氧化物所对应的水化物在水溶液中能完全电离,电离所得阴离子的空间构型为____________ ,写出任意一种与该阴离子互为等电子体的微粒的化学式___________ 。
(3)与B元素同主族的元素硅,其四卤化物的沸点和铅的二卤化物熔点如图所示:
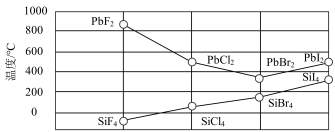
①SiX4的沸点依F、Cl、Br、I次序升高的原因是_________________________ 。
②结合PbX2的熔点的变化规律,推断如下物质的熔点高低:NaCl_______ MgO(填“<”、“>”或“=”)。
(4)元素D可以形成如图所示的配合物,该配合物中所含化学键的类型不包括________ (填字母)。

a、极性共价键 b、非极性共价键 c、配位键 d、离子键
e、金属键 f、σ键 g、π键
(5)已知E3+可形成配位数为6的配合物。现有橙黄色和紫红色两种E的配合物,其组成均可表示为ECl3·nNH3。为测定这两种配合物晶体的化学式,设计了如下实验:
a.分别取等质量的两种晶体的样品配成溶液;
b.向两种溶液中分别滴入AgNO3溶液,均产生白色沉淀;
c.沉淀完全后分别过滤,经洗涤干燥后称量,发现紫红色晶体产生沉淀的质量与橙黄色晶体产生沉淀的质量之比为2∶3 。则紫红色晶体的化学式为______________ (用配合物的形式写出化学式,且E用元素符号表示,n用具体数字表示)。
(1)第一电离能介于A和C之间的同周期元素有
(2)C元素的最高价氧化物所对应的水化物在水溶液中能完全电离,电离所得阴离子的空间构型为
(3)与B元素同主族的元素硅,其四卤化物的沸点和铅的二卤化物熔点如图所示:

①SiX4的沸点依F、Cl、Br、I次序升高的原因是
②结合PbX2的熔点的变化规律,推断如下物质的熔点高低:NaCl
(4)元素D可以形成如图所示的配合物,该配合物中所含化学键的类型不包括

a、极性共价键 b、非极性共价键 c、配位键 d、离子键
e、金属键 f、σ键 g、π键
(5)已知E3+可形成配位数为6的配合物。现有橙黄色和紫红色两种E的配合物,其组成均可表示为ECl3·nNH3。为测定这两种配合物晶体的化学式,设计了如下实验:
a.分别取等质量的两种晶体的样品配成溶液;
b.向两种溶液中分别滴入AgNO3溶液,均产生白色沉淀;
c.沉淀完全后分别过滤,经洗涤干燥后称量,发现紫红色晶体产生沉淀的质量与橙黄色晶体产生沉淀的质量之比为2∶3 。则紫红色晶体的化学式为
您最近半年使用:0次
【推荐2】氮化硅(Si3N4)陶瓷可代替金属制造发动机的耐热部件。工业上用气相沉淀法制备氨化硅:3SiCl4(g)+2N2(g)+6H2(g) Si3N4(s) +12HCl(g)。请回答:
Si3N4(s) +12HCl(g)。请回答:
(1)基态N原子的价电子轨道式为____ 。
(2)Si原子与H原子结合时,Si呈正化合价,则电负性:Si____ H(选填“<”或“>”)。
(3)元素第一电离能:Si____ N(选填“<”或“>”)。
(4)基态Cl原子的核外电子运动状态有____ 种。
(5)Si4—与Cl—具有相同的电子构型,r(Si4—)大于r(Cl—),原因是____ 。
(6)锗(Ge与Si是同一主族的元素。Ge的最高价氯化物分子式是____ 。Ge元素可能的性质或应用有____ (填序号)。
A.是一种活泼的金属元素 B.其电负性大于硫
C.其单质可作为半导体材料 D.其气态氢化物的稳定性低于硅的气态氢化物
 Si3N4(s) +12HCl(g)。请回答:
Si3N4(s) +12HCl(g)。请回答:(1)基态N原子的价电子轨道式为
(2)Si原子与H原子结合时,Si呈正化合价,则电负性:Si
(3)元素第一电离能:Si
(4)基态Cl原子的核外电子运动状态有
(5)Si4—与Cl—具有相同的电子构型,r(Si4—)大于r(Cl—),原因是
(6)锗(Ge与Si是同一主族的元素。Ge的最高价氯化物分子式是
A.是一种活泼的金属元素 B.其电负性大于硫
C.其单质可作为半导体材料 D.其气态氢化物的稳定性低于硅的气态氢化物
您最近半年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐3】回答下列问题:
(1)元素周期表第二周期中元素原子的第一电离能介于硼和氮之间的元素有___________ 种。
(2)下列微粒中的键角由大到小的顺序为___________ (填序号)。
① ②
② ③
③ ④
④
(3)基态Ni原子核外电子排布式为___________ 。F、K和Ni三种元素组成的一种化合物的晶胞如下图所示,该物质的化学式为___________ 。

(4)CuF的熔点为1008℃,熔化呈液态时能导电。CuCl的熔点为326℃,能升华,熔化呈液态时不导电;
①CuF的熔点比CuCl的高,其原因是___________ 。
②比较Cu、Zn的第二电离能的大小: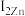
___________ 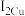 (填“>”或“<”)。
(填“>”或“<”)。
(5)在硫酸铜溶液中加入氨水至过量,先出现蓝色沉淀,最后溶解形成深蓝色的溶液,此蓝色沉淀溶解的离子方程式为:___________ 。
(6) 的晶胞如图所示,密度为
的晶胞如图所示,密度为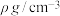 ,相邻的两个
,相邻的两个 的最近核间距为acm,则
的最近核间距为acm,则 的摩尔质量为
的摩尔质量为___________ g/mol(列出代数式,设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。

(1)元素周期表第二周期中元素原子的第一电离能介于硼和氮之间的元素有
(2)下列微粒中的键角由大到小的顺序为
①
 ②
② ③
③ ④
④
(3)基态Ni原子核外电子排布式为

(4)CuF的熔点为1008℃,熔化呈液态时能导电。CuCl的熔点为326℃,能升华,熔化呈液态时不导电;
①CuF的熔点比CuCl的高,其原因是
②比较Cu、Zn的第二电离能的大小:
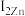
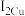 (填“>”或“<”)。
(填“>”或“<”)。(5)在硫酸铜溶液中加入氨水至过量,先出现蓝色沉淀,最后溶解形成深蓝色的溶液,此蓝色沉淀溶解的离子方程式为:
(6)
 的晶胞如图所示,密度为
的晶胞如图所示,密度为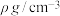 ,相邻的两个
,相邻的两个 的最近核间距为acm,则
的最近核间距为acm,则 的摩尔质量为
的摩尔质量为 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近半年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐1】氮化硼(BN)是一种重要的功能陶瓷材料以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示:
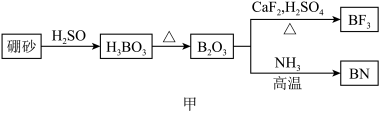
请回答下列问题:
(1)由B2O3制备BF3、BN的化学方程式依次是_________ 、__________ ;
(2)基态B原子的电子排布式为_________ ;B和N相比,电负性较大的是_________ ,BN中B元素的化合价为_________ ;
(3)在BF3分子中,F-B-F的建角是_______ ,B原子的杂化轨道类型为_______ ,BF3和过量NaF作用可生成NaBF,BF 的立体结构为
的立体结构为_______ ;
(4) 在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为________ ,层间作用力为________ ;
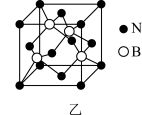
(5)六方氢化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm,立方氮化硼晶胞中含有______ 各氮原子、________ 各硼原子,立方氮化硼的密度是_______ g· (只要求列算式,不必计算出数值,阿伏加德罗常数为NA)。
(只要求列算式,不必计算出数值,阿伏加德罗常数为NA)。


请回答下列问题:
(1)由B2O3制备BF3、BN的化学方程式依次是
(2)基态B原子的电子排布式为
(3)在BF3分子中,F-B-F的建角是
 的立体结构为
的立体结构为(4) 在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为
(5)六方氢化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm,立方氮化硼晶胞中含有
 (只要求列算式,不必计算出数值,阿伏加德罗常数为NA)。
(只要求列算式,不必计算出数值,阿伏加德罗常数为NA)。
您最近半年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】已知 A、B、C、D、E 是原子序数依次增大前四周期元素,其元素性质或原子结构如表:
(1)A的最高价氧化物是___________ 分子。(填“极性”或“非极性”)该分子的杂化类型是___________
(2)B与其同周期相邻元素第一电离能由大到小的顺序为___________ (填元素符号)。B2O分子的空间构型是___________
(3)C气态氢化物稳定性是同族元素氢化物中最高的,其原因是___________ 。
(4)D 属于___________ 区的元素,该元素原子核外电子占据的最高能层符号是___________ 其基态原子的价层电子轨道表示式为___________ 。
(5)E 的基态原子的电子排布式为___________ 。E-e-=E+的过程中,失去的电子是基态E 中___________ 轨道上的电子。
| A | 原子核外电子分占 3 个不同能级, 且每个能级上排布的电子数相同 |
| B | 原子最高能级的不同轨道都有电子, 且自旋方向相同 |
| C | 在周期表所有元素中电负性最大 |
| D | 位于周期表中第 4 纵列 |
| E | 基态原子 M 层全充满, N 层只有一个电子 |
(2)B与其同周期相邻元素第一电离能由大到小的顺序为
(3)C气态氢化物稳定性是同族元素氢化物中最高的,其原因是
(4)D 属于
(5)E 的基态原子的电子排布式为
您最近半年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】A、B、C、D、E、F为前四周期元素,原子序数依次增大,A、D同主族,A2—和B+具有相同的电子层结构;C、E为同周期元素,C核外电子总数是最外层电子数的3倍;E元素最外层有一个未成对电子;F的最外层只有1个电子,但次外层有18个电子。
请回答下列问题:
(1)基态F原子的核外电子排布式为______ ,F元素在周期表中的位置______ ,F2+能与足量氨水反应得到深蓝色透明溶液,该深蓝色离子的结构式为______ 。
(2)六种元素中电负性最小的是______ ,其中C、D、E的第一电离能由大到小的顺序为______ (填元素符号)。
(3)A、D的简单氢化物中沸点较高的物质是______ (填化学式),原因是______ 。
(4)C和E的单质反应可生成组成比为1:3的化合物,该化合物的立体构型名称为______ ,中心原子的杂化轨道类型为______ 。
请回答下列问题:
(1)基态F原子的核外电子排布式为
(2)六种元素中电负性最小的是
(3)A、D的简单氢化物中沸点较高的物质是
(4)C和E的单质反应可生成组成比为1:3的化合物,该化合物的立体构型名称为
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】CuCl2是常见的化学试剂,某学习小组利用废铜屑“湿法”制备CuCl2·2H2O。

氯化铜在不同温度下结晶形成的结晶水合物
回答下列问题:
(1)仪器a的名称为_______ ,NaOH溶液的作用是_______ 。
(2)“湿法”制备CuCl2的离子方程式为_______ ,实验中,H2O2的实际用量要大于理论用量,原因是_______ 。
(3)为得到纯净的CuCl2·2H2O晶体,反应完全后要进行的操作是:除去其他可能的金属离子后,过滤,向滤液中持续通入HCl气体,加热蒸发浓缩,_______ ,过滤,洗涤,低温干燥,其中,持续通入HCl的作用是_______ 。
(4)查阅资料:[Cu(H2O)4]2+(蓝色)+4Cl- ⇌[CuCl4]2-(黄色)+4H2O,设计实验证明CuCl2溶液中存在上述平衡:取少量蓝色CuCl2稀溶液于试管中,_______ 。
(5)查阅资料:[CuCl4]2-比[Cu(H2O)4]2+更稳定:与Cu2+配位时,Cl-比H2O的配位能力更强,原因可能是_______ 。

氯化铜在不同温度下结晶形成的结晶水合物
| 温度 | 15℃以下 | 15~25.7℃ | 26~42℃ | 42℃以上 |
| 结晶水合物 | CuCl2·4H2O | CuCl2·3H2O | CuCl2·2H2O | CuCl2·H2O |
(1)仪器a的名称为
(2)“湿法”制备CuCl2的离子方程式为
(3)为得到纯净的CuCl2·2H2O晶体,反应完全后要进行的操作是:除去其他可能的金属离子后,过滤,向滤液中持续通入HCl气体,加热蒸发浓缩,
(4)查阅资料:[Cu(H2O)4]2+(蓝色)+4Cl- ⇌[CuCl4]2-(黄色)+4H2O,设计实验证明CuCl2溶液中存在上述平衡:取少量蓝色CuCl2稀溶液于试管中,
(5)查阅资料:[CuCl4]2-比[Cu(H2O)4]2+更稳定:与Cu2+配位时,Cl-比H2O的配位能力更强,原因可能是
您最近半年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】铁的化合物种类繁多,应用广泛。回答下列问题:
(1)某含Fe2+的结晶水合物的结构片段如图所示(球与球之间的短线代表单键或双键)。
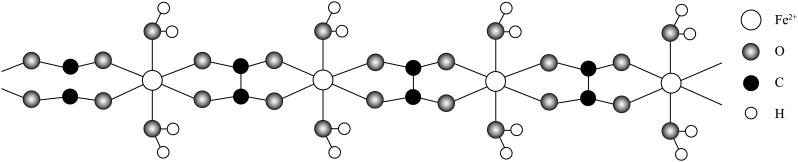
该结晶水合物的化学式为___________ ,其中Fe2+和H2O之间的作用力类型为___________ 。
(2)南开大学某课题组成功合成无机二茂铁的配离子[FeP8]2–,其中环状配体P 以π电子参与配位,结构如图。该配离子中与Fe2+形成配位键的电子共有
以π电子参与配位,结构如图。该配离子中与Fe2+形成配位键的电子共有___________ 个,P原子的价层孤电子对占据___________ (填标号)。
A.3s轨道 B.3p轨道 C.sp2杂化轨道 D.sp3杂化轨道

(3)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。由铁、钾、硒形成的一种超导材料的晶胞结构如下图所示,晶胞棱边夹角均为90°,晶胞中部分原子的分数坐标如下表所示。
晶胞中Fe的数目为___________ ,距离K(0.5,0.5,0.5)最近的Se的数目为___________ ,该晶体的密度ρ=___________ g·cm–3.(NA表示阿伏加德罗常数的值,用含a、c、NA的计算式表示),该晶胞在yz平面投影为___________ (填标号)。
A.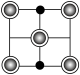 B.
B.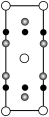 C.
C.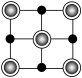 D.
D.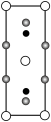
(1)某含Fe2+的结晶水合物的结构片段如图所示(球与球之间的短线代表单键或双键)。

该结晶水合物的化学式为
(2)南开大学某课题组成功合成无机二茂铁的配离子[FeP8]2–,其中环状配体P
 以π电子参与配位,结构如图。该配离子中与Fe2+形成配位键的电子共有
以π电子参与配位,结构如图。该配离子中与Fe2+形成配位键的电子共有A.3s轨道 B.3p轨道 C.sp2杂化轨道 D.sp3杂化轨道

(3)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。由铁、钾、硒形成的一种超导材料的晶胞结构如下图所示,晶胞棱边夹角均为90°,晶胞中部分原子的分数坐标如下表所示。
| 原子 坐标 | x | y | z | 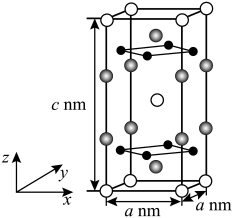 |
| K | 0.5 | 0.5 | 0.5 | |
| Fe | 0 | 0.5 | m | |
| Se | 0 | 0 | n | |
| 注:m、n均≠0 | ||||
A.
 B.
B. C.
C. D.
D.
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】氯化亚铜难溶于水,溶于浓盐酸和氨水,不溶于乙醇,在潮湿的空气中易被氧化。某兴趣小组模拟工业用SO2还原Na2[CuCl4]溶液制备CuCl的装置如图所示。回答下列问题:
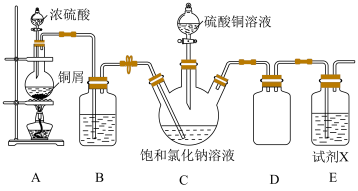
(1)装置A中盛放铜屑的仪器名称是___________ ;写出装置A中发生反应的化学反应方程式:___________ 。
(2)装置D的作用是___________ ;将硫酸铜溶液滴入饱和氯化钠溶液中会形成Na2[CuCl4],其中[CuCl4]2-的配位键中提供孤电子对的是___________ (填化学符号);装置C中SO2与[CuCl4]2-反应的离子方程式为___________ 。
(3)高温条件下,亚铜离子比铜离子稳定,原因是___________ ;CuSO4在高温条件下发生分解反应生成的砖红色固体为___________ (填化学式)。

(1)装置A中盛放铜屑的仪器名称是
(2)装置D的作用是
(3)高温条件下,亚铜离子比铜离子稳定,原因是
您最近半年使用:0次



