硼酸(H3BO3)在电子器件工业和医疗上有重要用途。它是一种白色片状晶体,具有类似于石墨的层状结构,有滑腻感。H3BO3的层内结构如下图所示。___________ (填“极性”或“非极性”)共价键。
(2)H3BO3层内结构中,虚线部分表示存在___________ (填序号)。
a.离子键 b.配位键 c.氢键
H3BO3在热水中溶解度增大,原因是___________ 。
(3)H3BO3可由BCl3水解得到。
①依据价电子对互斥理论(VSEPR)推测,BCl3的空间结构为___________ 。
②BCl3属于___________ (填“极性”或“非极性”)分子。
(4)H3BO3是一元酸,在水溶液中发生如下过程:H3BO3+H2O⇌ +H+。
+H+。
①[B(OH)4]-中硼原子的杂化方式为___________ 。
②用中和滴定法测定H3BO3纯度。
取agH3BO3样品(所含杂质不与NaOH反应),用0.5mol·L−1NaOH溶液滴定至终点,消耗NaOH溶液VmL,测得H3BO3的纯度为___________ (用质量分数表示)。
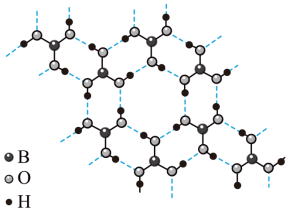
(2)H3BO3层内结构中,虚线部分表示存在
a.离子键 b.配位键 c.氢键
H3BO3在热水中溶解度增大,原因是
(3)H3BO3可由BCl3水解得到。
①依据价电子对互斥理论(VSEPR)推测,BCl3的空间结构为
②BCl3属于
(4)H3BO3是一元酸,在水溶液中发生如下过程:H3BO3+H2O⇌
 +H+。
+H+。①[B(OH)4]-中硼原子的杂化方式为
②用中和滴定法测定H3BO3纯度。
取agH3BO3样品(所含杂质不与NaOH反应),用0.5mol·L−1NaOH溶液滴定至终点,消耗NaOH溶液VmL,测得H3BO3的纯度为
更新时间:2024-05-10 16:57:24
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】回答下列问题
(1)“棕色环”现象是检验溶液中 的一种方法。向含有
的一种方法。向含有 溶液的试管中加入
溶液的试管中加入 ,随后沿管壁加入浓硫酸,在溶液界面上出现“棕色环”,研究发现棕色物质化学式为
,随后沿管壁加入浓硫酸,在溶液界面上出现“棕色环”,研究发现棕色物质化学式为 。
。
① 中N元素采取
中N元素采取________ 杂化,其立体构型为________ (填名称);
② 中一种配体实际上是
中一种配体实际上是 ,则其中Fe元素的化合价为
,则其中Fe元素的化合价为________ ;写出 的一种等电子体的化学式
的一种等电子体的化学式________ ;
③ 中微粒间不存在的作用力有
中微粒间不存在的作用力有________ ;
a.极性键 b.非极性键 c.σ键 d.π键 c.配位键 f.离子键
④ 与
与 等金属离子形成的配合物中配位原子一般是S而不是N,其原因是
等金属离子形成的配合物中配位原子一般是S而不是N,其原因是________ 。
(2)太阳能电池板主要材料为单晶硅或多晶硅。Si的价电子轨道表示式为________ ; 可发生水解反应,机理如下。含s、p、d轨道的杂化类型有A.
可发生水解反应,机理如下。含s、p、d轨道的杂化类型有A. 、B.
、B. 、C.
、C. ,中间体
,中间体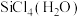 中Si采取的杂化类型为
中Si采取的杂化类型为________ (填字母)。________ ;
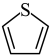
②分子中的大π键可以用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 )。请问噻吩中的大π键表示为
)。请问噻吩中的大π键表示为________ 。
(4)最简单的硼烷是 ,其分子结构如下左图,B原子的杂化方式为
,其分子结构如下左图,B原子的杂化方式为________ 。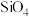 ]四面体(如右上图1所示)的方式形成链状、环状或网络状复杂阴离子,图2所示为一种环状硅酸根离子,其钠盐的化学式为
]四面体(如右上图1所示)的方式形成链状、环状或网络状复杂阴离子,图2所示为一种环状硅酸根离子,其钠盐的化学式为________ 。 熔融时形成一种能导电的液体,测得其中含有一种正四面体形阳离子和一种正八面体形阴离子。则
熔融时形成一种能导电的液体,测得其中含有一种正四面体形阳离子和一种正八面体形阴离子。则 熔融的电离方程式为
熔融的电离方程式为________ 。
(1)“棕色环”现象是检验溶液中
 的一种方法。向含有
的一种方法。向含有 溶液的试管中加入
溶液的试管中加入 ,随后沿管壁加入浓硫酸,在溶液界面上出现“棕色环”,研究发现棕色物质化学式为
,随后沿管壁加入浓硫酸,在溶液界面上出现“棕色环”,研究发现棕色物质化学式为 。
。①
 中N元素采取
中N元素采取②
 中一种配体实际上是
中一种配体实际上是 ,则其中Fe元素的化合价为
,则其中Fe元素的化合价为 的一种等电子体的化学式
的一种等电子体的化学式③
 中微粒间不存在的作用力有
中微粒间不存在的作用力有a.极性键 b.非极性键 c.σ键 d.π键 c.配位键 f.离子键
④
 与
与 等金属离子形成的配合物中配位原子一般是S而不是N,其原因是
等金属离子形成的配合物中配位原子一般是S而不是N,其原因是(2)太阳能电池板主要材料为单晶硅或多晶硅。Si的价电子轨道表示式为
 可发生水解反应,机理如下。含s、p、d轨道的杂化类型有A.
可发生水解反应,机理如下。含s、p、d轨道的杂化类型有A. 、B.
、B. 、C.
、C. ,中间体
,中间体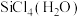 中Si采取的杂化类型为
中Si采取的杂化类型为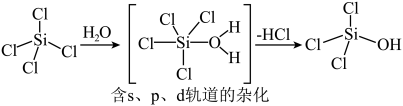
②分子中的大π键可以用符号
 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 )。请问噻吩中的大π键表示为
)。请问噻吩中的大π键表示为(4)最简单的硼烷是
 ,其分子结构如下左图,B原子的杂化方式为
,其分子结构如下左图,B原子的杂化方式为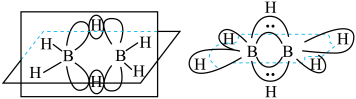
 ]四面体(如右上图1所示)的方式形成链状、环状或网络状复杂阴离子,图2所示为一种环状硅酸根离子,其钠盐的化学式为
]四面体(如右上图1所示)的方式形成链状、环状或网络状复杂阴离子,图2所示为一种环状硅酸根离子,其钠盐的化学式为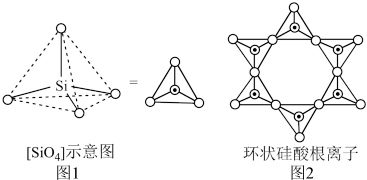
 熔融时形成一种能导电的液体,测得其中含有一种正四面体形阳离子和一种正八面体形阴离子。则
熔融时形成一种能导电的液体,测得其中含有一种正四面体形阳离子和一种正八面体形阴离子。则 熔融的电离方程式为
熔融的电离方程式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
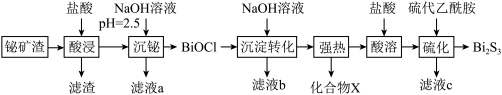
【推荐2】硫化铋(Bi2S3)广泛应用于太阳能电池、光电二极管及红外光谱学等。以铋矿渣(含Bi2O3、Fe2O3、CuO、Ag2O、Al2O3等)为原料制备Bi2S3的一种工艺流程如下。
②该工艺条件下,部分金属离子形成氢氧化物沉淀的pH如下表:
③常温下,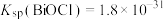 、
、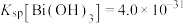 。
。
请回答下列问题:
(1)提高“酸浸”反应速率的措施是___________ (任答1条);“酸浸”中,形成“滤渣”的主要反应的离子方程式是___________ 。
(2)“滤液a”中主要的金属阳离有Fe3+、Cu2+___________ 。
(3)“沉铋”后所得BiOCl固体中含 杂质,设计实验去除BiOCl固体中含有的
杂质,设计实验去除BiOCl固体中含有的 杂质:
杂质:___________ 。
(4)“酸溶”时需加入过量的盐酸,盐酸过量的目的是___________ 、___________ 。
(5)已知常温时,BiOCl在水溶液中存在平衡: ,该反应的平衡常数为K,达到平衡时测得溶液pH=13,
,该反应的平衡常数为K,达到平衡时测得溶液pH=13,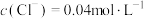 ,则K=
,则K=___________ 。
(6)化合物X的VSEPR模型是___________ 。
(7)已知 (硫代乙酰胺)
(硫代乙酰胺)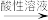
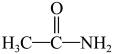 (乙酰胺)+H2S,则“硫化”的离子方程式为
(乙酰胺)+H2S,则“硫化”的离子方程式为___________ 。
②该工艺条件下,部分金属离子形成氢氧化物沉淀的pH如下表:
| 离子 | Fe3+ | Al3+ | Cu2+ |
| 开始沉淀时的pH | 1.5 | 3.6 | 4.5 |
| 沉淀完全时的pH | 3.2 | 4.7 | 6.7 |
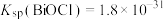 、
、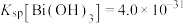 。
。请回答下列问题:
(1)提高“酸浸”反应速率的措施是
(2)“滤液a”中主要的金属阳离有Fe3+、Cu2+
(3)“沉铋”后所得BiOCl固体中含
 杂质,设计实验去除BiOCl固体中含有的
杂质,设计实验去除BiOCl固体中含有的 杂质:
杂质:(4)“酸溶”时需加入过量的盐酸,盐酸过量的目的是
(5)已知常温时,BiOCl在水溶液中存在平衡:
 ,该反应的平衡常数为K,达到平衡时测得溶液pH=13,
,该反应的平衡常数为K,达到平衡时测得溶液pH=13,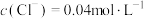 ,则K=
,则K=(6)化合物X的VSEPR模型是
(7)已知
 (硫代乙酰胺)
(硫代乙酰胺)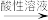
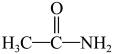 (乙酰胺)+H2S,则“硫化”的离子方程式为
(乙酰胺)+H2S,则“硫化”的离子方程式为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐3】有A,B,C,D,E五种元素,其中A,B,C,D为短周期元素,A元素的周期数、主族数、原子序数相同;B原子核外有3种能量不同的原子轨道且每种轨道中的电子数相同;C原子的价电子构型为csccpc+1,D元素的原子最外层电子数比次外层电子数少2个,D的阴离子与E的阳离子电子层结构相同,D和E可形成化合物E2D。
回答下列问题:
(1) C原子的价电子构型为csccpc+1,其中c为________ , C原子的名称为__________ ;
(2)上述元素中,第一电离能最小的元素的原子结构示意图为__________________ ;
D的价电子排布图为______________________ ;E2D的电子式为__________________ ;
(3) 下列分子结构图中的●和○表示上述元素的原子中除去最外层电子的剩余部分,小黑点表示没有形成共价键的最外层电子,短线表示共价键.
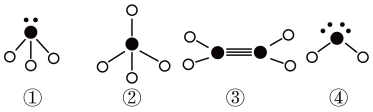
则在以上分子中,中心原子采用sp3杂化形成化学键的是___________ (填写分子的化学式);
②分子中的键角是_____________ ; 在③的分子中有_______ 个σ键和_______ 个π键。
回答下列问题:
(1) C原子的价电子构型为csccpc+1,其中c为
(2)上述元素中,第一电离能最小的元素的原子结构示意图为
D的价电子排布图为
(3) 下列分子结构图中的●和○表示上述元素的原子中除去最外层电子的剩余部分,小黑点表示没有形成共价键的最外层电子,短线表示共价键.

则在以上分子中,中心原子采用sp3杂化形成化学键的是
②分子中的键角是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】DF-31洲际弹道导弹是我国大国地位和国防实力的象征,其制作材料包含了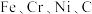 等多种元素。回答下列问题:
等多种元素。回答下列问题:
(1)基态铁原子的电子排布式为_______ , 具有较强的还原性,原因是
具有较强的还原性,原因是_______ 。
(2) 的第二电离能
的第二电离能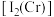 和
和 的第二电离能
的第二电离能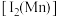 分别为
分别为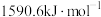 、
、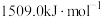 ,
, 的原因是
的原因是_______ ;过氧化铬 中
中 的化合价为
的化合价为 ,则分子中
,则分子中 键、π键的数目之比为
键、π键的数目之比为_______ 。
(3)下图中表示的碳原子能量最高的是_______(填字母)。
(4)超临界流体是物质介于气态和液态之间的新状态,目前应用最广泛的是超临界 。超临界
。超临界 流体是一种具有和水相似能阻燃、溶解能力强的溶剂,被誉为“绿色环保溶剂”。
流体是一种具有和水相似能阻燃、溶解能力强的溶剂,被誉为“绿色环保溶剂”。 中C原子的杂化方式为
中C原子的杂化方式为_______ ,分子中的化学键为_______ (填“极性键”或“非极性键”),分子属于_______ (填“极性”或“非极性”)分子。
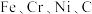 等多种元素。回答下列问题:
等多种元素。回答下列问题:(1)基态铁原子的电子排布式为
 具有较强的还原性,原因是
具有较强的还原性,原因是(2)
 的第二电离能
的第二电离能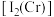 和
和 的第二电离能
的第二电离能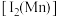 分别为
分别为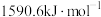 、
、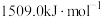 ,
, 的原因是
的原因是 中
中 的化合价为
的化合价为 ,则分子中
,则分子中 键、π键的数目之比为
键、π键的数目之比为(3)下图中表示的碳原子能量最高的是_______(填字母)。
A. | B.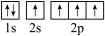 |
C.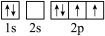 | D.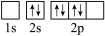 |
 。超临界
。超临界 流体是一种具有和水相似能阻燃、溶解能力强的溶剂,被誉为“绿色环保溶剂”。
流体是一种具有和水相似能阻燃、溶解能力强的溶剂,被誉为“绿色环保溶剂”。 中C原子的杂化方式为
中C原子的杂化方式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】某小组在实验室用NaClO溶液和NH3反应制备N2H4,并进行相关的性质探究实验。
(1)制备N2H4
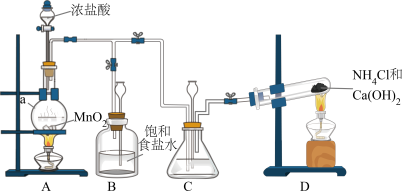
制备N2H4的离子方程式为___________ 。
Ⅱ.测定产品中水合肼(N2H4 · H2O)的含量
称取产品6.0 g,加入适量NaHCO3固体(滴定过程中,调节溶液的pH保持在6.5左右), 加水配成250 mL溶液,移取25.00 mL置于锥形瓶中,并滴加2 ~ 3滴淀粉溶液,用 0.3000 mol • L-1的碘标准溶液滴定(已知:N2H4·H2O+2I2 =N2↑ +4HI+H2O)。
(2)滴定到达终点的现象是___________ 。
(3)实验测得消耗碘标准溶液的平均值为20.00 mL,产品中水合肼的质量分数为___________ 。
Ⅲ.探究肼的性质。
(4)写出肼的电子式___________ ,肼为___________ 分子。(填“极性”或“非极性”)。
(5)预设肼可能具有___________ (a.氧化性 b.还原性 c.酸性 d.碱性)。
将制得的肼分离提纯后,进行如图实验探究。
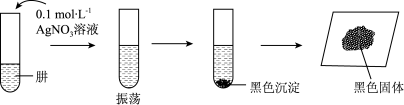
【查阅资料]AgOH在溶液中不稳定,易分解生成黑色的Ag2O,Ag2O可溶于氨水。
【提出假设】黑色固体可能是Ag、Ag2O中的一种或两种。
【实验验证】设计如下方案,进行实验。
(6)请完成表中的空白部分:①___________ ;②___________ 。
(7)实验表明,黑色固体主要成分是Ag,还有少量氧化银,请解释原因:___________ 。
(1)制备N2H4

制备N2H4的离子方程式为
Ⅱ.测定产品中水合肼(N2H4 · H2O)的含量
称取产品6.0 g,加入适量NaHCO3固体(滴定过程中,调节溶液的pH保持在6.5左右), 加水配成250 mL溶液,移取25.00 mL置于锥形瓶中,并滴加2 ~ 3滴淀粉溶液,用 0.3000 mol • L-1的碘标准溶液滴定(已知:N2H4·H2O+2I2 =N2↑ +4HI+H2O)。
(2)滴定到达终点的现象是
(3)实验测得消耗碘标准溶液的平均值为20.00 mL,产品中水合肼的质量分数为
Ⅲ.探究肼的性质。
(4)写出肼的电子式
(5)预设肼可能具有
将制得的肼分离提纯后,进行如图实验探究。

【查阅资料]AgOH在溶液中不稳定,易分解生成黑色的Ag2O,Ag2O可溶于氨水。
【提出假设】黑色固体可能是Ag、Ag2O中的一种或两种。
【实验验证】设计如下方案,进行实验。
| 操作 | 现象 | 实验结论 |
| i.取少量黑色固体于试管中,加入适量①___________ | 黑色固体部分溶解 | 黑色固体有Ag2O |
| ii.取少量黑色固体于试管中加入足量稀硝酸,振荡 | ②___________ | 黑色固体是Ag和Ag2O |
(7)实验表明,黑色固体主要成分是Ag,还有少量氧化银,请解释原因:
您最近一年使用:0次
【推荐3】氮化硅(Si3N4)耐高温、硬度大,可用石英与焦炭在1400~1450℃的氮气中合成:3SiO2(s)+6C(s)+2N2(g)=Si3N4(s)+6CO(g)-Q(Q>0),在一定条件下,向10L密闭容器中加入反应物,10min后达到平衡。完成下列问题:
(1)上述反应所涉及的属于第三周期的元素,其原子的最外层电子轨道表示式为______ 。其中一种元素的原子核外s电子数与p电子数相等,其原子的核外电子能量不同的有_____ 种。
(2)上述反应混合物中的极性分子是______ ,写出非极性分子的电子式________ 。分析用氮化硅制造轴承和发动机中耐热部件的原因是___________ 。
(3)该反应的平衡常数表达式为__________ 。可以提高二氧化硅转化率的措施是________ (任写一条),该措施对平衡常数的影响为__________ (填“增大”、“减小”或“保持不变”)。
(4)测得平衡时固体质量减少了5.6g,则用氮气表示的平均反应速率为__________ 。
(1)上述反应所涉及的属于第三周期的元素,其原子的最外层电子轨道表示式为
(2)上述反应混合物中的极性分子是
(3)该反应的平衡常数表达式为
(4)测得平衡时固体质量减少了5.6g,则用氮气表示的平均反应速率为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】非金属硼化物在现代工农业、医学和国防中有着重要的应用价值。回答下列问题:
(1)氨硼烷(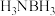 )是目前最具潜力的储氢材料之一、氨硼烷分子中与N相连的H呈正电性,与B原子相连的H呈负电性,它们之间存在静电相互吸引作用,称为双氢键,用“N—H…H—B”表示。以下物质之间可能形成双氢键的是___________(填序号)。
)是目前最具潜力的储氢材料之一、氨硼烷分子中与N相连的H呈正电性,与B原子相连的H呈负电性,它们之间存在静电相互吸引作用,称为双氢键,用“N—H…H—B”表示。以下物质之间可能形成双氢键的是___________(填序号)。
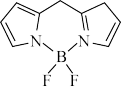
(2)氮杂氟硼二吡咯具有作为光动力学治疗(PDT)光敏剂的潜能,结构如图所示,分子内含有一个大Π键,大Π键可用符号 表示,其中m代表参与形成大Π键的原子数,n代表参与形成大Π键的电子数(如苯分子中的大Π键可表示为
表示,其中m代表参与形成大Π键的原子数,n代表参与形成大Π键的电子数(如苯分子中的大Π键可表示为 )、该大Π键的表示形式为
)、该大Π键的表示形式为___________ ,该分子中所有元素的电负性由大到小的顺序为___________ 。
(3)硼氢化钠( )是一种常用的还原剂,其晶胞结构如图所示:
)是一种常用的还原剂,其晶胞结构如图所示:
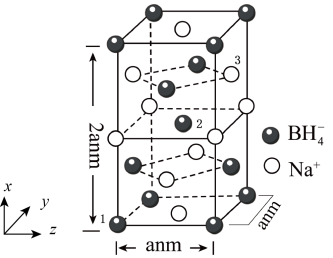
① 的配位数是
的配位数是___________ 。
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子坐标参数,其中原子坐标参数“1”为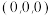 ;“2”为
;“2”为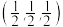 ;标注为“3”的
;标注为“3”的 坐标参数为
坐标参数为___________ 。
③已知硼氢化钠晶体的密度为 ,
, 代表阿伏加德罗常数的值,则
代表阿伏加德罗常数的值,则 与
与 之间的最近距离为
之间的最近距离为___________ nm(用含ρ、 的代数式表示)。
的代数式表示)。
④若硼氢化钠晶胞上、下底心处的 被
被 取代,得到晶体的化学式为
取代,得到晶体的化学式为___________ 。
(1)氨硼烷(
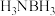 )是目前最具潜力的储氢材料之一、氨硼烷分子中与N相连的H呈正电性,与B原子相连的H呈负电性,它们之间存在静电相互吸引作用,称为双氢键,用“N—H…H—B”表示。以下物质之间可能形成双氢键的是___________(填序号)。
)是目前最具潜力的储氢材料之一、氨硼烷分子中与N相连的H呈正电性,与B原子相连的H呈负电性,它们之间存在静电相互吸引作用,称为双氢键,用“N—H…H—B”表示。以下物质之间可能形成双氢键的是___________(填序号)。A. 和 和 | B.LiH和HCN | C. 和 和 | D. 和 和 |
 表示,其中m代表参与形成大Π键的原子数,n代表参与形成大Π键的电子数(如苯分子中的大Π键可表示为
表示,其中m代表参与形成大Π键的原子数,n代表参与形成大Π键的电子数(如苯分子中的大Π键可表示为 )、该大Π键的表示形式为
)、该大Π键的表示形式为
(3)硼氢化钠(
 )是一种常用的还原剂,其晶胞结构如图所示:
)是一种常用的还原剂,其晶胞结构如图所示:
①
 的配位数是
的配位数是②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子坐标参数,其中原子坐标参数“1”为
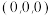 ;“2”为
;“2”为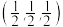 ;标注为“3”的
;标注为“3”的 坐标参数为
坐标参数为③已知硼氢化钠晶体的密度为
 ,
, 代表阿伏加德罗常数的值,则
代表阿伏加德罗常数的值,则 与
与 之间的最近距离为
之间的最近距离为 的代数式表示)。
的代数式表示)。④若硼氢化钠晶胞上、下底心处的
 被
被 取代,得到晶体的化学式为
取代,得到晶体的化学式为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】卟啉化合物在生命科学、太阳能储存等众多领域具有广阔的应用前景。回答下列问题:
I.四苯基金属锌卟啉配合物具有促进细胞组织呼吸、改善蛋白质和糖代谢等作用,其合成过程如下(ph-为苯基):

(1)配合物中基态Zn原子的价电子排布式为_______ ,C原子的杂化类型为_______ 。
(2)合成过程所用的试剂乙醇中所含元素的电负性由大到小的顺序为_______ 。
(3)乙醇的沸点高于二氯甲烷的沸点,主要原因是_______ 。
II.研究表明利用卟啉配合物对钙钛矿薄膜进行修饰调控,可大幅度提高钙钛矿太阳能电池器件的性能和稳定性。

(4)钙钛矿晶胞如图所示,Ti4+处于6个O2-组成的_______ 空隙中,若Ca2+与O2-的最短距离为anm,设NA为阿伏加德罗常数的值,则晶体的密度为_______ g∙cm-3(列出计算表达式)。
(5)在钙钛矿晶胞结构的另一种表示中,Ti4+处于各顶点位置,则O2-处于_______ 位置。
I.四苯基金属锌卟啉配合物具有促进细胞组织呼吸、改善蛋白质和糖代谢等作用,其合成过程如下(ph-为苯基):

(1)配合物中基态Zn原子的价电子排布式为
(2)合成过程所用的试剂乙醇中所含元素的电负性由大到小的顺序为
(3)乙醇的沸点高于二氯甲烷的沸点,主要原因是
II.研究表明利用卟啉配合物对钙钛矿薄膜进行修饰调控,可大幅度提高钙钛矿太阳能电池器件的性能和稳定性。

(4)钙钛矿晶胞如图所示,Ti4+处于6个O2-组成的
(5)在钙钛矿晶胞结构的另一种表示中,Ti4+处于各顶点位置,则O2-处于
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】20世纪初,哈伯和博施开发了以 和
和 为原料合成氨工艺,目前该工艺仍在广泛使用。
为原料合成氨工艺,目前该工艺仍在广泛使用。
(1)关于哈伯和博施法工业合成氨的说法正确的是___________。
(2)关于 说法正确的是___________。
说法正确的是___________。
(3)氮的氢化物 与
与 反应
反应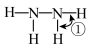

 ,比较键角①
,比较键角①___________ ②(填“>”、“<”或“=”),请说明理由___________ 。
 和
和 为原料合成氨工艺,目前该工艺仍在广泛使用。
为原料合成氨工艺,目前该工艺仍在广泛使用。(1)关于哈伯和博施法工业合成氨的说法正确的是___________。
| A.采用温度为500℃有利于反应正向进行 |
| B.尾气处理利用氨气极易溶于水的性质 |
| C.合成氨工业中利用了热交换器,实现绿色低碳化 |
D.理论上通过该反应 、 、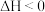 可以判断该反应常温下不能自发 可以判断该反应常温下不能自发 |
(2)关于
 说法正确的是___________。
说法正确的是___________。A. 遇到HCl产生白雾 遇到HCl产生白雾 | B.利用 受热分解可制得 受热分解可制得 |
C. 可用湿润的红色石蕊试纸检验 可用湿润的红色石蕊试纸检验 | D. 分子间易形成氢键,故 分子间易形成氢键,故 极易溶于水 极易溶于水 |
(3)氮的氢化物
 与
与 反应
反应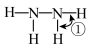

 ,比较键角①
,比较键角①
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】低毒农药中常含有氟、氯、硫、磷。这些元素的部分单质或化合物的相关信息如下表所示:
回答下列问题:
(1)基态 原子价层电子的电子排布图(轨道表达式)为
原子价层电子的电子排布图(轨道表达式)为__________ ,基态P原子的电子占据的最高能级的电子云轮廓图为__________ 形。
(2) 、S、P的第一电离能从小到大的顺序为
、S、P的第一电离能从小到大的顺序为___________ ;F、 、S、P的电负性从小到大的顺序为
、S、P的电负性从小到大的顺序为________ 。
(3)根据价层电子对互斥理论, 的分子中,中心原子的价层电子对数不同于其他分子的是
的分子中,中心原子的价层电子对数不同于其他分子的是_____________ ,其中 分子的空间构型为
分子的空间构型为_____________ 。
(4) (结构为
(结构为 )易溶于
)易溶于 ,主要原因是
,主要原因是___________ ; 分子中中心原子的杂化方式是
分子中中心原子的杂化方式是____________ 。
(5)已知 的结构是
的结构是 ,则
,则 中不存在的是
中不存在的是________ (填字母)。
A 离子键 B 键 C 氢键 D
键 C 氢键 D  键
键
(6) 均是离子化合物,具有闪锌矿结构,晶胞结构及晶胞参数如下图所示。
均是离子化合物,具有闪锌矿结构,晶胞结构及晶胞参数如下图所示。

①氟化亚铜比氯化亚铜熔点高,这是因为_________ 。
②氟化亚铜与氯化亚铜的密度之比为_________ (列出计算式)。
 |  |  |  |  |  |  | |
| 熔点/℃ | 44.1 |  |  |  | 160℃(分解) | 908 | 426 |
| 沸点/℃ | 280.5 | 76.1 | 46.5 | 59.6(分解) | / | / | / |
(1)基态
 原子价层电子的电子排布图(轨道表达式)为
原子价层电子的电子排布图(轨道表达式)为(2)
 、S、P的第一电离能从小到大的顺序为
、S、P的第一电离能从小到大的顺序为 、S、P的电负性从小到大的顺序为
、S、P的电负性从小到大的顺序为(3)根据价层电子对互斥理论,
 的分子中,中心原子的价层电子对数不同于其他分子的是
的分子中,中心原子的价层电子对数不同于其他分子的是 分子的空间构型为
分子的空间构型为(4)
 (结构为
(结构为 )易溶于
)易溶于 ,主要原因是
,主要原因是 分子中中心原子的杂化方式是
分子中中心原子的杂化方式是(5)已知
 的结构是
的结构是 ,则
,则 中不存在的是
中不存在的是A 离子键 B
 键 C 氢键 D
键 C 氢键 D  键
键(6)
 均是离子化合物,具有闪锌矿结构,晶胞结构及晶胞参数如下图所示。
均是离子化合物,具有闪锌矿结构,晶胞结构及晶胞参数如下图所示。
①氟化亚铜比氯化亚铜熔点高,这是因为
②氟化亚铜与氯化亚铜的密度之比为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐2】元素X、Y、Z为前四周期元素,X的基态原子核外电子有21种运动状态,元素Y的原子最外层电子数是其内层的3倍,Z与X、Y不在同一周期,且Z原子核外p电子比s电子多5个。
(1)X基态原子的核外电子排布式为______ 。
(2)X是石油化工中重要的催化剂之一,如催化异丙苯( )裂化生成苯和丙烯。
)裂化生成苯和丙烯。
①1 mol异丙苯分子中含有σ键的数目为________ mol。
②异丙苯分子中碳原子轨道的杂化类型为________ 。
(3)与Y3分子互为等电子体的阴离子为________ 。
(4)XZ3易溶于水,熔融状态下能够导电,据此可判断XZ3晶体属于________ (填晶体类型)。
(5)元素Ce与Y形成的化合物晶体的晶胞结构如下图,该化合物的化学式为________ 。

(1)X基态原子的核外电子排布式为
(2)X是石油化工中重要的催化剂之一,如催化异丙苯(
 )裂化生成苯和丙烯。
)裂化生成苯和丙烯。①1 mol异丙苯分子中含有σ键的数目为
②异丙苯分子中碳原子轨道的杂化类型为
(3)与Y3分子互为等电子体的阴离子为
(4)XZ3易溶于水,熔融状态下能够导电,据此可判断XZ3晶体属于
(5)元素Ce与Y形成的化合物晶体的晶胞结构如下图,该化合物的化学式为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】根据所学知识回答下列问题:
(1)基态氮原子的价电子排布图是______ ,第一电离能氮_____ 氧(填"大于”、“小于”或“等于”);
(2)Cu+和Cu2+中较稳定的是______________ ;
(3)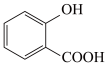 的熔点低于
的熔点低于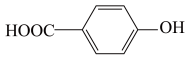 ,其原因是
,其原因是________ ;
(4)已知无机含氧酸非羟基氧越多,酸性越强:0个非羟基氧是弱酸,1个非羟基氧是中强酸,2个非羟基氧是强酸。H3PO2是一种中强酸,则H3PO2的结构式为__________ ;
(5)配合物Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂,固态Ni(CO)4属于____ 晶体,原子总数与价电子总数都相等的微粒互为等电子体,二者具有相似的化学键结构,如N2和CO。写出与CO互为等电子体的一种阴离子______ ,Ni(CO)4中σ键与π键数目之比为_____ 。
(6)立方氧化镍晶体的结构如图所示,其晶胞边长为apm。氧化镍的化学式为______ ,列式表示晶体的密度为______ g/cm3(不必计算出结果,阿伏加德罗常数的值为NA)。
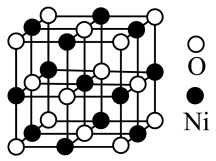
(1)基态氮原子的价电子排布图是
(2)Cu+和Cu2+中较稳定的是
(3)
 的熔点低于
的熔点低于 ,其原因是
,其原因是(4)已知无机含氧酸非羟基氧越多,酸性越强:0个非羟基氧是弱酸,1个非羟基氧是中强酸,2个非羟基氧是强酸。H3PO2是一种中强酸,则H3PO2的结构式为
(5)配合物Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂,固态Ni(CO)4属于
(6)立方氧化镍晶体的结构如图所示,其晶胞边长为apm。氧化镍的化学式为

您最近一年使用:0次



