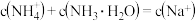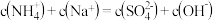常温下,向 溶液中滴加NaOH溶液,混合溶液中1gX(X表示
溶液中滴加NaOH溶液,混合溶液中1gX(X表示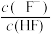 或
或 )随pH变化如图,已知
)随pH变化如图,已知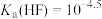 ,Ⅰ线和Ⅱ线交点横坐标为6.6,下列说法错误的是
,Ⅰ线和Ⅱ线交点横坐标为6.6,下列说法错误的是
 溶液中滴加NaOH溶液,混合溶液中1gX(X表示
溶液中滴加NaOH溶液,混合溶液中1gX(X表示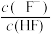 或
或 )随pH变化如图,已知
)随pH变化如图,已知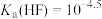 ,Ⅰ线和Ⅱ线交点横坐标为6.6,下列说法错误的是
,Ⅰ线和Ⅱ线交点横坐标为6.6,下列说法错误的是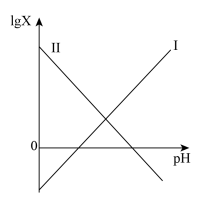
A.Ⅰ线代表 |
B.Ⅱ线和横轴交点坐标为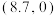 |
C. 溶液加水稀释过程中pH值逐渐减小 溶液加水稀释过程中pH值逐渐减小 |
D. 溶液中存在: 溶液中存在: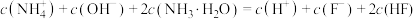 |
更新时间:2024-06-06 10:11:00
|
相似题推荐
单选题
|
较难
(0.4)
解题方法
【推荐1】常温下,下列有关叙述正确的是( )
A. 溶液和 溶液和  溶液等体积混合: 溶液等体积混合: |
B. 的 的 溶液与 溶液与 的NaOH溶液等体积混合: 的NaOH溶液等体积混合: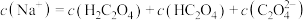 |
C.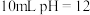 的氢氧化钠溶液中加入 的氢氧化钠溶液中加入 的HA溶液至pH刚好等于7,所得溶液体积 的HA溶液至pH刚好等于7,所得溶液体积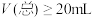 |
D.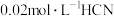 溶液与 溶液与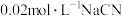 溶液等体积混合,已知混合溶液中 溶液等体积混合,已知混合溶液中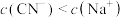 ,则 ,则 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐2】常温下将NaOH溶液滴加到亚硒酸(H2SeO3) 溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述正确的是


A.曲线N表示pH与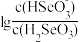 |
B.图中a点对应溶液中: c (Na+) > c ( ) + 2c ( ) + 2c ( ) ) |
| C.Ka1(H2SeO3)与Ka2(H2SeO3) 之比为103 |
D.NaHSeO3溶液中: c ( ) > c ( ) > c ( ) > c (H2SeO3) ) > c (H2SeO3) |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
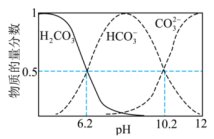
【推荐1】 时,下图表示起始浓度为
时,下图表示起始浓度为 的
的 溶液中各含碳粒子物质的量分数与
溶液中各含碳粒子物质的量分数与 的变化关系。已知:
的变化关系。已知: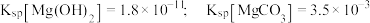 。下列说法错误的是
。下列说法错误的是
 时,下图表示起始浓度为
时,下图表示起始浓度为 的
的 溶液中各含碳粒子物质的量分数与
溶液中各含碳粒子物质的量分数与 的变化关系。已知:
的变化关系。已知: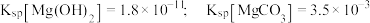 。下列说法错误的是
。下列说法错误的是
A.起始时,溶液中一定有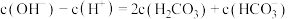 |
B.当 时,溶液中 时,溶液中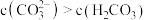 |
C.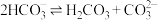 的平衡常数 的平衡常数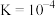 |
D.当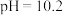 时,向溶液中加入足量 时,向溶液中加入足量 溶液,溶液中会产生两种沉淀 溶液,溶液中会产生两种沉淀 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐2】常温下,向20.00mL HA溶液中滴入
HA溶液中滴入 的NaOH溶液,溶液中
的NaOH溶液,溶液中 与NaOH溶液的体积关系如图所示。下列说法正确的是
与NaOH溶液的体积关系如图所示。下列说法正确的是

 HA溶液中滴入
HA溶液中滴入 的NaOH溶液,溶液中
的NaOH溶液,溶液中 与NaOH溶液的体积关系如图所示。下列说法正确的是
与NaOH溶液的体积关系如图所示。下列说法正确的是
A.常温下,HA电离常数的数量级为 |
B.a点对应的溶液中: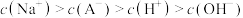 |
C.b点对应的溶液中水的电离程度最大,且溶液中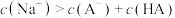 |
D.c点溶液中: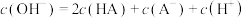 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐3】室温下,将NaOH溶液滴加到H2X溶液中,混合溶液中离子浓度的变化与pH的关系如图所示。下列说法错误的是


| A.H2X的Ka2数量级为10-8 |
| B.当混合溶液pH=3时,c(HX- )= 10c(H2X) |
| C.混合溶液呈中性时c(Na+)> 3c(HX- ) |
| D.NaHX溶液中存在c(H2X)<c(OH- )+c(X2-) |
您最近一年使用:0次

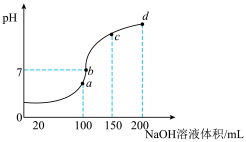
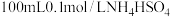 溶液中滴加
溶液中滴加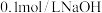 溶液,溶液pH与NaOH溶液体积的关系曲线如图所示:对图中a、b、c、d四个点分析中,正确的是
溶液,溶液pH与NaOH溶液体积的关系曲线如图所示:对图中a、b、c、d四个点分析中,正确的是