 资源化是实现“双碳”目标的重要途径。
资源化是实现“双碳”目标的重要途径。方法1:化学还原
 制备
制备 、
、 、
、 等。
等。(1)以
 和
和 为原料合成乙烯,其反应的过程分两步进行:
为原料合成乙烯,其反应的过程分两步进行:①

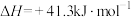
②
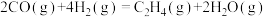
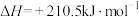
写出
 加氢合成乙烯的热化学方程式:
加氢合成乙烯的热化学方程式:(2)利用二氧化碳合成淀粉,首先是利用二氧化碳制备甲醇。已知
 和
和 在某种催化剂作用下可同时发生以下两个反应:
在某种催化剂作用下可同时发生以下两个反应:Ⅰ.
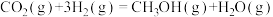
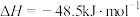
Ⅱ.

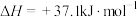
在压强为P,
 、
、 的起始投料为1:3的条件下,发生反应Ⅰ、Ⅱ。实验测得
的起始投料为1:3的条件下,发生反应Ⅰ、Ⅱ。实验测得 的平衡转化率和平衡时
的平衡转化率和平衡时 的选择性随温度的变化如图所示。
的选择性随温度的变化如图所示。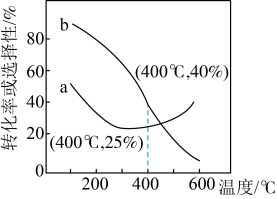
 的选择性
的选择性
①有利于提高
 的选择性的措施有
的选择性的措施有A.适当降温 B.适当升温 C.选择合适的催化剂
②温度高于350℃时,体系中发生的反应以
③其中表示平衡时
 的选择性的曲线是
的选择性的曲线是(3)
 合成乙醇。在一定温度下,向容积为1L的恒容密闭容器中,充入1mol
合成乙醇。在一定温度下,向容积为1L的恒容密闭容器中,充入1mol 、xmol
、xmol ,发生反应
,发生反应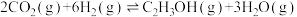 ,测得平衡体系中,
,测得平衡体系中, 的体积分数
的体积分数 与x的关系如图所示。
与x的关系如图所示。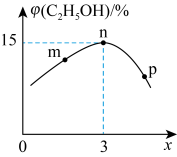
 的转化率最大的是
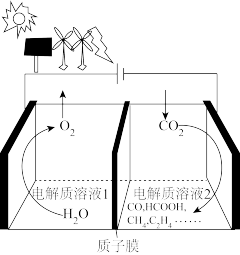
的转化率最大的是方法2:用电解法可将
 转化为多种原料。
转化为多种原料。(4)用如图装置电解二氧化碳制取甲烷,温度控制在10℃左右,持续通入二氧化碳,电解过程中
 ,物质的量基本不变。写出阴极的电极反应式
,物质的量基本不变。写出阴极的电极反应式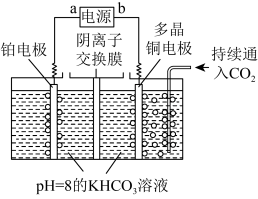
更新时间:2024-05-26 21:32:13
|
相似题推荐
【推荐1】二氧化碳催化加氢制甲醇,能助力“碳达峰”,涉及反应有:
反应①
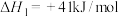
反应②
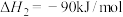
反应③

(1)反应②自发进行的条件是_______ (填“高温”、“低温”或“任意温度”),反应③
_______  。
。
(2)反应③在热力学上趋势大于反应①,其原因是_______ 。
(3)反应③有催化剂和无催化剂作用下的反应机理如图所示(其中标有*的为吸附在催化剂表面上的物种,TS为过渡态),催化剂可使反应历程中决速步骤的活化能降低_______ eV(eV为能量单位)。 下,
下, 和
和 按物质的量之比为
按物质的量之比为 进行投料,只发生反应①和反应③,平衡时CO和
进行投料,只发生反应①和反应③,平衡时CO和 在含碳产物中的物质的量分数及
在含碳产物中的物质的量分数及 转化率随温度的变化如图所示。
转化率随温度的变化如图所示。_______ 。
②q曲线在250℃之后随温度升高而增大的原因是_______ 。
③250℃时,反应①的平衡常数
_______ ( 为以分压表示的平衡常数,分压=总压×物质的量分数)。
为以分压表示的平衡常数,分压=总压×物质的量分数)。
(5)向一定浓度的 溶液通入
溶液通入 至饱和,在电极上反应生成
至饱和,在电极上反应生成 ,电解原理如图所示(阴、阳极区溶液均为
,电解原理如图所示(阴、阳极区溶液均为 溶液)。电解过程中生成尿素的电极反应式为
溶液)。电解过程中生成尿素的电极反应式为_______ 。
反应①

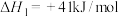
反应②

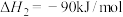
反应③


(1)反应②自发进行的条件是

 。
。(2)反应③在热力学上趋势大于反应①,其原因是
(3)反应③有催化剂和无催化剂作用下的反应机理如图所示(其中标有*的为吸附在催化剂表面上的物种,TS为过渡态),催化剂可使反应历程中决速步骤的活化能降低
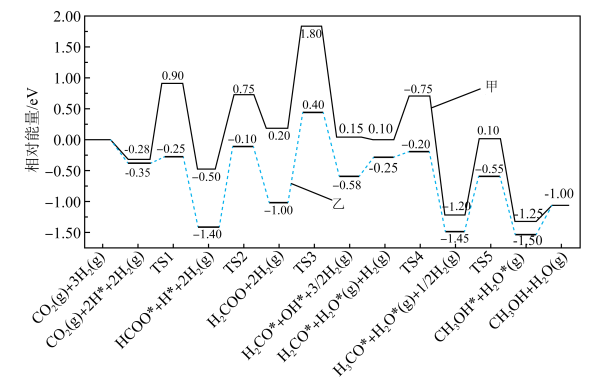
 下,
下, 和
和 按物质的量之比为
按物质的量之比为 进行投料,只发生反应①和反应③,平衡时CO和
进行投料,只发生反应①和反应③,平衡时CO和 在含碳产物中的物质的量分数及
在含碳产物中的物质的量分数及 转化率随温度的变化如图所示。
转化率随温度的变化如图所示。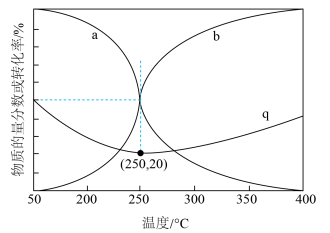
②q曲线在250℃之后随温度升高而增大的原因是
③250℃时,反应①的平衡常数

 为以分压表示的平衡常数,分压=总压×物质的量分数)。
为以分压表示的平衡常数,分压=总压×物质的量分数)。(5)向一定浓度的
 溶液通入
溶液通入 至饱和,在电极上反应生成
至饱和,在电极上反应生成 ,电解原理如图所示(阴、阳极区溶液均为
,电解原理如图所示(阴、阳极区溶液均为 溶液)。电解过程中生成尿素的电极反应式为
溶液)。电解过程中生成尿素的电极反应式为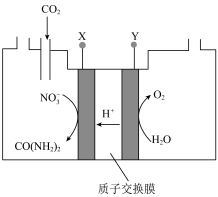
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】化学反应有物质变化,也有能量变化,化学能可与热能相互转化,也可与电能相互转化。
Ⅰ.工业合成氨中氢气的重要来源是水煤气,有关反应如下:①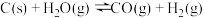 ;
; ,它们的能量变化如图所示。
,它们的能量变化如图所示。

(1)写出图1对应的热化学方程式:_______ 。
(2)结合图1、图2得出: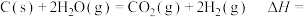
_______  。
。
Ⅱ.如下所示电解装置中,通电后石墨电极Ⅱ上有 生成,池中
生成,池中 逐渐溶解。(已知:交换膜仅阴离子能通过,质子交换膜仅能通过)
逐渐溶解。(已知:交换膜仅阴离子能通过,质子交换膜仅能通过)

(3)a是电源的_______ 极(填“正”“负”)。 穿过质子交换膜向
穿过质子交换膜向_______ (填“左”“右”)移动。
(4)石墨电极Ⅰ的电极反应式为_______ ,电解时,该极溶液中 浓度将
浓度将_______ 。(填“变大”“变小”或“不变”)
(5)当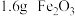 完全溶解时,至少产生
完全溶解时,至少产生
_______ L(换算成标准状况)。
Ⅰ.工业合成氨中氢气的重要来源是水煤气,有关反应如下:①
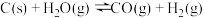 ;
; ,它们的能量变化如图所示。
,它们的能量变化如图所示。
(1)写出图1对应的热化学方程式:
(2)结合图1、图2得出:
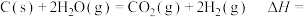
 。
。Ⅱ.如下所示电解装置中,通电后石墨电极Ⅱ上有
 生成,池中
生成,池中 逐渐溶解。(已知:交换膜仅阴离子能通过,质子交换膜仅能通过)
逐渐溶解。(已知:交换膜仅阴离子能通过,质子交换膜仅能通过)
(3)a是电源的
 穿过质子交换膜向
穿过质子交换膜向(4)石墨电极Ⅰ的电极反应式为
 浓度将
浓度将(5)当
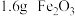 完全溶解时,至少产生
完全溶解时,至少产生
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】近年碳中和理念成为热门,通过“ →合成气→高附加值产品”的工艺路线,可有效实现
→合成气→高附加值产品”的工艺路线,可有效实现 的资源化利用。请回答下列问题:
的资源化利用。请回答下列问题:
(1) 加复制合成气(CO、
加复制合成气(CO、 )时发生下列反应:
)时发生下列反应:
已知:①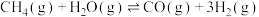

②

则

___________ 
(2) 经催化加氢可合成烯烃:
经催化加氢可合成烯烃: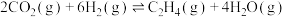
 。在0.1MPa时,按
。在0.1MPa时,按 投料,如下图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系。
投料,如下图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系。
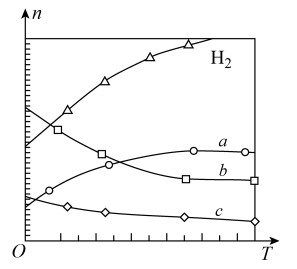
①在一个恒温恒容的密闭容器中,该可逆反应达到平衡的标志是___________ (填字母)
A.容器内各物质的浓度不随时间变化 B.
C.容器内压强不随时间变化 D.混合气体的密度不再改变
②该反应的
___________ 0(填“>”或“<”)。
③曲线b表示的物质为___________ (用化学式表示)。
(3)由 与
与 反应合成甲醇:
反应合成甲醇: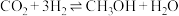
 。某温度下,将1mol
。某温度下,将1mol 和3mol
和3mol 充入体积不变的2L密闭容器中,初始总压为8MPa,发生上述反应,测得不同时刻反应后与反应前的压强关系如下表:
充入体积不变的2L密闭容器中,初始总压为8MPa,发生上述反应,测得不同时刻反应后与反应前的压强关系如下表:
该条件下的分压平衡常数为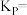
___________  (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)电催化 制备燃料可实现资源综合利用。如图所示装置工作时,阳极的电极反应式为
制备燃料可实现资源综合利用。如图所示装置工作时,阳极的电极反应式为___________ 。
 →合成气→高附加值产品”的工艺路线,可有效实现
→合成气→高附加值产品”的工艺路线,可有效实现 的资源化利用。请回答下列问题:
的资源化利用。请回答下列问题:(1)
 加复制合成气(CO、
加复制合成气(CO、 )时发生下列反应:
)时发生下列反应:已知:①
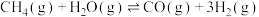

②


则



(2)
 经催化加氢可合成烯烃:
经催化加氢可合成烯烃: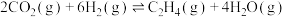
 。在0.1MPa时,按
。在0.1MPa时,按 投料,如下图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系。
投料,如下图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系。
①在一个恒温恒容的密闭容器中,该可逆反应达到平衡的标志是
A.容器内各物质的浓度不随时间变化 B.

C.容器内压强不随时间变化 D.混合气体的密度不再改变
②该反应的

③曲线b表示的物质为
(3)由
 与
与 反应合成甲醇:
反应合成甲醇: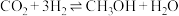
 。某温度下,将1mol
。某温度下,将1mol 和3mol
和3mol 充入体积不变的2L密闭容器中,初始总压为8MPa,发生上述反应,测得不同时刻反应后与反应前的压强关系如下表:
充入体积不变的2L密闭容器中,初始总压为8MPa,发生上述反应,测得不同时刻反应后与反应前的压强关系如下表:| 时间/h | 1 | 2 | 3 | 4 | 5 |
 | 0.92 | 0.85 | 0.79 | 0.75 | 0.75 |
该条件下的分压平衡常数为
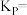
 (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。(4)电催化
 制备燃料可实现资源综合利用。如图所示装置工作时,阳极的电极反应式为
制备燃料可实现资源综合利用。如图所示装置工作时,阳极的电极反应式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】回答下列问题:
(1)研究 之间的转化具有重要意义,下图能表示
之间的转化具有重要意义,下图能表示 之间转化历程。
之间转化历程。

①写出图中所表示的总反应的热化学方程式_______ 。
②上述总反应的决速步骤的活化能是_______ (填写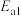 或
或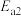 )。
)。
(2) 与
与 在高温下发生反应:
在高温下发生反应: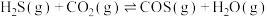
 。在610K时,将0.1mol
。在610K时,将0.1mol  与0.3mol
与0.3mol  充入2.5L的空钢瓶中(体积不变),经过10min,反应达到平衡,反应平衡时水蒸气的物质的量分数为0.125。
充入2.5L的空钢瓶中(体积不变),经过10min,反应达到平衡,反应平衡时水蒸气的物质的量分数为0.125。
①能判断该反应达到化学平衡状态的依据是_______ 。
A.容器中压强不变 B.容器中 的物质的量分数不变
的物质的量分数不变
C. D.容器中混合气体的密度不变
D.容器中混合气体的密度不变
②反应平衡常数K的表达式为_______ , 的平衡转化率α=
的平衡转化率α=_______ 。
③要增大该反应的平衡常数K,可采取的措施是_______ 。
(1)研究
 之间的转化具有重要意义,下图能表示
之间的转化具有重要意义,下图能表示 之间转化历程。
之间转化历程。
①写出图中所表示的总反应的热化学方程式
②上述总反应的决速步骤的活化能是
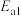 或
或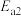 )。
)。(2)
 与
与 在高温下发生反应:
在高温下发生反应: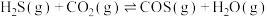
 。在610K时,将0.1mol
。在610K时,将0.1mol  与0.3mol
与0.3mol  充入2.5L的空钢瓶中(体积不变),经过10min,反应达到平衡,反应平衡时水蒸气的物质的量分数为0.125。
充入2.5L的空钢瓶中(体积不变),经过10min,反应达到平衡,反应平衡时水蒸气的物质的量分数为0.125。①能判断该反应达到化学平衡状态的依据是
A.容器中压强不变 B.容器中
 的物质的量分数不变
的物质的量分数不变C.
 D.容器中混合气体的密度不变
D.容器中混合气体的密度不变②反应平衡常数K的表达式为
 的平衡转化率α=
的平衡转化率α=③要增大该反应的平衡常数K,可采取的措施是
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐2】A、B、C、D、E、F是六种短周期主族元素,它们的原子序数依次增大,其中A、D及C、F分别是同一主族元素。A、C两元素可形成原子个数之比为2∶1、1∶1型化合物。B元素的最外层电子数是内层电子数的2倍,E元素的最外层电子数等于其电子层数。F元素的最外层电子数是次外层电子数的0.75倍。请回答:
(1)D与F形成D2F的电子式为______________ ;A、C、D三种元素组成的化合物含有化学键的类型是________________ ;
(2)由E、F两种元素组成的化合物1 mol跟由A、C、D三种元素组成的化合物的溶液发生反应,消耗后者物质的量最大值为___________ mol。
(3)A、C、F间形成的甲、乙两种微粒,甲有18个电子,乙有10个电子,它们均为负一价双原子阴离子,则甲与乙反应的离子方程式为_________________________________ 。
(4)工业上在高温的条件下,可以用A2C和BC反应制取单质A2。在等体积的Ⅰ、Ⅱ两个密闭容器中分别充入1 mol A2C和1 mol BC、2 mol A2C和2 mol BC。一定条件下,充分反应后分别达到平衡(两容器温度相同)。下列说法正确的是________________ 。
(1)D与F形成D2F的电子式为
(2)由E、F两种元素组成的化合物1 mol跟由A、C、D三种元素组成的化合物的溶液发生反应,消耗后者物质的量最大值为
(3)A、C、F间形成的甲、乙两种微粒,甲有18个电子,乙有10个电子,它们均为负一价双原子阴离子,则甲与乙反应的离子方程式为
(4)工业上在高温的条件下,可以用A2C和BC反应制取单质A2。在等体积的Ⅰ、Ⅱ两个密闭容器中分别充入1 mol A2C和1 mol BC、2 mol A2C和2 mol BC。一定条件下,充分反应后分别达到平衡(两容器温度相同)。下列说法正确的是________________ 。
| A.达到平衡所需要的时间:Ⅰ>Ⅱ | B.达到平衡后A2C的转化率:Ⅰ=Ⅱ |
| C.达到平衡后BC的物质的量:Ⅰ>Ⅱ | D.达到平衡后A2的体积分数:Ⅰ<Ⅱ |
| E.达到平衡后吸收或放出的热量:Ⅰ=Ⅱ | F.达到平衡后体系的平均相对分子质量:Ⅰ<Ⅱ |
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】2018年,美国退出了《巴黎协定》实行再工业化战略,而中国却加大了环保力度,生动诠释了我国负责任的大国形象。近年我国大力加强温室气体CO2催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。
(1)已知:CO2(g)+H2(g) H2O(g) +CO(g) ΔH1 =+41.1kJ/mol-1
H2O(g) +CO(g) ΔH1 =+41.1kJ/mol-1
CO(g)+2H2(g) CH3OH(g) ΔH2=-90.0kJ/mol-1
CH3OH(g) ΔH2=-90.0kJ/mol-1
写出CO2催化氢化合成甲醇的热化学方程式:__ 。
(2)为提高CH3OH转化率,理论上应采用的条件是__ (填字母)。
A.高温高压 B.低温低压 C.高温低压 D.低温高压
(3)250℃、在恒容密闭容器中由CO2(g)催化氢化合成CH3OH(g),如图为不同投料比[ ]时某反应物X平衡转化率变化曲线。
]时某反应物X平衡转化率变化曲线。
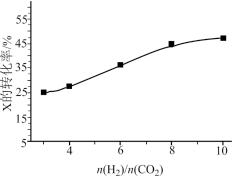
反应物X是__ (填“CO2”或“H2”),理由是___ 。
(4)250℃、在体积为2.0L的恒容密闭容器中加入6molH2、2molCO2和催化剂,10min时反应达到平衡,测得n(CH3OH)=1.5mol。
①前10min的平均反应速率v(H2)=__ mol·L-1·min -1。
②化学平衡常数K=__ 。
③催化剂和反应条件与反应物转化率和产物的选择性高度相关。控制相同投料比和相同反应时间,四组实验数据如下:
根据上表所给数据,用CO2生产甲醇的最优选项为__ (填字母)。
(1)已知:CO2(g)+H2(g)
 H2O(g) +CO(g) ΔH1 =+41.1kJ/mol-1
H2O(g) +CO(g) ΔH1 =+41.1kJ/mol-1CO(g)+2H2(g)
 CH3OH(g) ΔH2=-90.0kJ/mol-1
CH3OH(g) ΔH2=-90.0kJ/mol-1写出CO2催化氢化合成甲醇的热化学方程式:
(2)为提高CH3OH转化率,理论上应采用的条件是
A.高温高压 B.低温低压 C.高温低压 D.低温高压
(3)250℃、在恒容密闭容器中由CO2(g)催化氢化合成CH3OH(g),如图为不同投料比[
 ]时某反应物X平衡转化率变化曲线。
]时某反应物X平衡转化率变化曲线。
反应物X是
(4)250℃、在体积为2.0L的恒容密闭容器中加入6molH2、2molCO2和催化剂,10min时反应达到平衡,测得n(CH3OH)=1.5mol。
①前10min的平均反应速率v(H2)=
②化学平衡常数K=
③催化剂和反应条件与反应物转化率和产物的选择性高度相关。控制相同投料比和相同反应时间,四组实验数据如下:
| 实验编号 | 温度(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
| A | 543 | Cu/ZnO纳米棒 | 12.3 | 42.3 |
| B | 543 | Cu/ZnO纳米片 | 11.9 | 72.7 |
| C | 553 | Cu/ZnO纳米棒 | 15.3 | 39.1 |
| D | 553 | Cu/ZnO纳米片 | 12.0 | 70.6 |
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】碳、氮、硫的化合物在生产、生活中广泛存在。回答下列问题:
(l)甲烷不仅能用作燃料,还可用于生产合成气(CO+H2)。CH4与H2O(g)通入聚焦太阳能反应器,发生反应:CH4(g)+H2O(g)=CO(g)+3H2(g)△H。已知:CH4、H2、CO的燃烧热△H分别为-a kJ/mol、-b kJ/mol、-c kJ/mol,lmol H2O的气化热△H为+dkJ/mol(a、b、c、d均大于0),则反应CH4(g)+H2O(g)=CO(g)+3H2(g)的△H=___ kJ.mol-l.
(2)在某密闭容器中发生反应:2CO2(g)=2CO(g)+O2(g),0.995 mol CO2在不同温度下的平衡分解情况如图所示。

①图中a、b、c三点的平衡常数K(a)、K(b)、K(c)的大小关系为____ 。
②若1660℃时反应达到平衡状态,且容器体积为1L,则该温度下,该反应的逆反应2CO(g)+O2(g)=2CO2(g)的平衡常数K=___ L∙mol-l。
③恒温恒容条件下,能表示该可逆反应达到平衡状态的是___ (填标号)。
A CO的体积分数与O2的体积分数的比值保持不变
B容器内混合气体的密度保持不变
C容器内混合气体的平均摩尔质量保持不变
D容器内碳元素的质量分数保持不变
(3)烟道气中的SO2和CO2可用氢氧化钠溶液或氢氧化钡溶液来吸收。
①下列事实中,能比较碳酸与亚硫酸的酸性强弱的是_ (填标号)。
A 25℃下,饱和碳酸溶液的pH大于饱和亚硫酸溶液的pH
B 25℃下,等物质的量浓度的NaHCO3溶液的pH大于NaHSO3溶液的pH
C将SO2气体通入NaHCO3溶液,再将逸出的气体通入澄清石灰水中,石灰水变浑浊
D滴定等量的氢氧化钠溶液至中性时消耗的碳酸溶液的体积比亚硫酸溶液的体积多
②25℃时,Ksp(BaSO3)=5.46×10-7,Ksp(BaCO3)=2.6×10-9。该温度下,BaSO3和BaCO3沉淀共存的悬浊液中, =
=__ 。
(4)光化学烟雾中的NO2可以被NaOH溶液吸收生成两种钠盐,溶液呈碱性,反应的离子方程式为___ 。已知常温下,HNO2的电离平衡常数Ka=5.0×10-4,则0. 05 mol.L-1NaNO2溶液的pH为____
(l)甲烷不仅能用作燃料,还可用于生产合成气(CO+H2)。CH4与H2O(g)通入聚焦太阳能反应器,发生反应:CH4(g)+H2O(g)=CO(g)+3H2(g)△H。已知:CH4、H2、CO的燃烧热△H分别为-a kJ/mol、-b kJ/mol、-c kJ/mol,lmol H2O的气化热△H为+dkJ/mol(a、b、c、d均大于0),则反应CH4(g)+H2O(g)=CO(g)+3H2(g)的△H=
(2)在某密闭容器中发生反应:2CO2(g)=2CO(g)+O2(g),0.995 mol CO2在不同温度下的平衡分解情况如图所示。

①图中a、b、c三点的平衡常数K(a)、K(b)、K(c)的大小关系为
②若1660℃时反应达到平衡状态,且容器体积为1L,则该温度下,该反应的逆反应2CO(g)+O2(g)=2CO2(g)的平衡常数K=
③恒温恒容条件下,能表示该可逆反应达到平衡状态的是
A CO的体积分数与O2的体积分数的比值保持不变
B容器内混合气体的密度保持不变
C容器内混合气体的平均摩尔质量保持不变
D容器内碳元素的质量分数保持不变
(3)烟道气中的SO2和CO2可用氢氧化钠溶液或氢氧化钡溶液来吸收。
①下列事实中,能比较碳酸与亚硫酸的酸性强弱的是
A 25℃下,饱和碳酸溶液的pH大于饱和亚硫酸溶液的pH
B 25℃下,等物质的量浓度的NaHCO3溶液的pH大于NaHSO3溶液的pH
C将SO2气体通入NaHCO3溶液,再将逸出的气体通入澄清石灰水中,石灰水变浑浊
D滴定等量的氢氧化钠溶液至中性时消耗的碳酸溶液的体积比亚硫酸溶液的体积多
②25℃时,Ksp(BaSO3)=5.46×10-7,Ksp(BaCO3)=2.6×10-9。该温度下,BaSO3和BaCO3沉淀共存的悬浊液中,
 =
=(4)光化学烟雾中的NO2可以被NaOH溶液吸收生成两种钠盐,溶液呈碱性,反应的离子方程式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】碘及其化合物在人类活动中占有重要地位。回答下列问题:
(1)“大象牙膏”实验中,将 、KI和洗洁精混合后,短时间内产生大量的泡沫。其反应过程分为两步:
、KI和洗洁精混合后,短时间内产生大量的泡沫。其反应过程分为两步:
第一步:
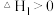 慢反应
慢反应
第二步:
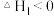 快反应
快反应
该反应的决速步骤为______ ,总反应方程式为______ ;
(2)已知:25℃下,
(ⅰ)
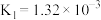
(ⅱ)

(ⅲ)

其中,反应(ⅱ)的 随温度的变化如图,若烧杯甲:将
随温度的变化如图,若烧杯甲:将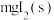 加入20mL水中(含
加入20mL水中(含 沉淀);烧杯乙:将
沉淀);烧杯乙:将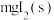 加入20mL KI溶液(含
加入20mL KI溶液(含 沉淀)。
沉淀)。
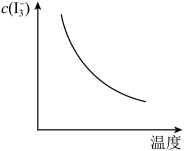
①甲中存在平衡(ⅰ),乙中存在平衡(ⅰ)和(ⅱ),不考虑碘与水的反应以及其它反应,下列正确的是______ 。
A.烧杯乙中剩余的 沉淀质量比甲的
沉淀质量比甲的 沉淀质量小
沉淀质量小
B.室温下,甲中加水稀释,溶液中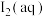 浓度一定减小
浓度一定减小
C.乙中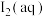 浓度与甲中
浓度与甲中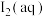 浓度相等
浓度相等
D.升高温度,反应ⅱ的平衡常数大于640
②为了探究乙中溶液含碘微粒的存在形式,进行实验:恒温25℃向10mL一定浓度的 溶液中加入
溶液中加入 溶液,反应结束后碘元素的微粒主要存在平衡(ⅱ),相关微粒浓度如下:
溶液,反应结束后碘元素的微粒主要存在平衡(ⅱ),相关微粒浓度如下:
其中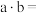
______ (用含c的代数式表示),若 ,说明平衡体系中
,说明平衡体系中______ 。
③计算25℃下 的平衡常数
的平衡常数
______  (写出计算过程)。
(写出计算过程)。
(1)“大象牙膏”实验中,将
 、KI和洗洁精混合后,短时间内产生大量的泡沫。其反应过程分为两步:
、KI和洗洁精混合后,短时间内产生大量的泡沫。其反应过程分为两步:第一步:

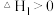 慢反应
慢反应第二步:

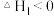 快反应
快反应该反应的决速步骤为
(2)已知:25℃下,
(ⅰ)

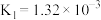
(ⅱ)


(ⅲ)


其中,反应(ⅱ)的
 随温度的变化如图,若烧杯甲:将
随温度的变化如图,若烧杯甲:将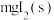 加入20mL水中(含
加入20mL水中(含 沉淀);烧杯乙:将
沉淀);烧杯乙:将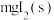 加入20mL KI溶液(含
加入20mL KI溶液(含 沉淀)。
沉淀)。
①甲中存在平衡(ⅰ),乙中存在平衡(ⅰ)和(ⅱ),不考虑碘与水的反应以及其它反应,下列正确的是
A.烧杯乙中剩余的
 沉淀质量比甲的
沉淀质量比甲的 沉淀质量小
沉淀质量小B.室温下,甲中加水稀释,溶液中
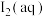 浓度一定减小
浓度一定减小C.乙中
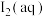 浓度与甲中
浓度与甲中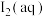 浓度相等
浓度相等D.升高温度,反应ⅱ的平衡常数大于640
②为了探究乙中溶液含碘微粒的存在形式,进行实验:恒温25℃向10mL一定浓度的
 溶液中加入
溶液中加入 溶液,反应结束后碘元素的微粒主要存在平衡(ⅱ),相关微粒浓度如下:
溶液,反应结束后碘元素的微粒主要存在平衡(ⅱ),相关微粒浓度如下:其中
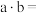
 ,说明平衡体系中
,说明平衡体系中微粒 |
|
|
|
| a | b | c |
 的平衡常数
的平衡常数
 (写出计算过程)。
(写出计算过程)。
您最近一年使用:0次
【推荐3】由 -羟基丁酸
-羟基丁酸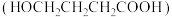 生成
生成 -丁内酯(
-丁内酯( )的反应为:HOCH2CH2CH2COOH
)的反应为:HOCH2CH2CH2COOH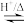
 +H2O
+H2O 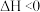 ,在
,在 时,溶液中
时,溶液中 -羟基丁酸的初始浓度为
-羟基丁酸的初始浓度为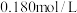 ,随着反应的进行,测得
,随着反应的进行,测得 丁内酯浓度随时间的变化如表所示。
丁内酯浓度随时间的变化如表所示。
(1)在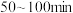 内,以
内,以 -丁内酯的浓度变化表示的反应速率为
-丁内酯的浓度变化表示的反应速率为___________ mol∙L-1∙min-1。
(2)在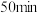 时,
时, -羟基丁酸的转化率为
-羟基丁酸的转化率为___________ (结果保留一位小数)。
(3)该反应达到平衡后,升高温度,平衡___________ 移动(填“正向”“不”或“逆向”)。
(4)保持其它条件不变,增大溶液中 -羟基丁酸的初始浓度,其平衡转化率将
-羟基丁酸的初始浓度,其平衡转化率将___________ (填“增大”“减小”或“不变”)。
(5)关于该反应的下列说法正确的是___________(填序号)。
(6) 时,该反应的平衡常数
时,该反应的平衡常数
___________ 。相同温度下,某溶液中发生上述反应,当 -丁内酯的浓度为
-丁内酯的浓度为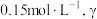 -羟基丁酸的浓度为
-羟基丁酸的浓度为 时,反应
时,反应___________ (填“正向进行”“逆向进行”或“已平衡”)。
 -羟基丁酸
-羟基丁酸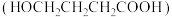 生成
生成 -丁内酯(
-丁内酯( )的反应为:HOCH2CH2CH2COOH
)的反应为:HOCH2CH2CH2COOH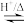
 +H2O
+H2O 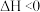 ,在
,在 时,溶液中
时,溶液中 -羟基丁酸的初始浓度为
-羟基丁酸的初始浓度为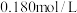 ,随着反应的进行,测得
,随着反应的进行,测得 丁内酯浓度随时间的变化如表所示。
丁内酯浓度随时间的变化如表所示。 | 21 | 50 | 80 | 100 | 120 | 160 | 220 |  |
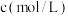 | 0.024 | 0.050 | 0.071 | 0.081 | 0.090 | 0.104 | 0.116 | 0.132 |
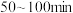 内,以
内,以 -丁内酯的浓度变化表示的反应速率为
-丁内酯的浓度变化表示的反应速率为(2)在
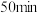 时,
时, -羟基丁酸的转化率为
-羟基丁酸的转化率为(3)该反应达到平衡后,升高温度,平衡
(4)保持其它条件不变,增大溶液中
 -羟基丁酸的初始浓度,其平衡转化率将
-羟基丁酸的初始浓度,其平衡转化率将(5)关于该反应的下列说法正确的是___________(填序号)。
| A.达到平衡后,升高温度正反应速率减小,逆反应速率增大 |
B.当 -羟基丁酸的正反应速率与 -羟基丁酸的正反应速率与 -丁内酯的逆反应速率相等时,说明达到了平衡 -丁内酯的逆反应速率相等时,说明达到了平衡 |
C.当 -羟基丁酸和 -羟基丁酸和 -丁内酯的浓度相等时,说明达到了平衡 -丁内酯的浓度相等时,说明达到了平衡 |
D.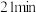 时的逆反应速率小于 时的逆反应速率小于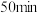 时的正反应速率 时的正反应速率 |
 时,该反应的平衡常数
时,该反应的平衡常数
 -丁内酯的浓度为
-丁内酯的浓度为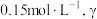 -羟基丁酸的浓度为
-羟基丁酸的浓度为 时,反应
时,反应
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】金属镓在工业和医学中有广泛应用。一种利用锌粉置换渣(主要成分为 、
、 、
、 、
、 、
、 、
、 )制备粗镓的工艺流程如图所示:
)制备粗镓的工艺流程如图所示:
回答下列问题。
(1)浸渣的主要成分是___________ ,“富氧浸出”中高压 的作用是
的作用是___________ 。
(2)用 代表P204,RH代表YW100,“协同萃取”过程中发生反应:
代表P204,RH代表YW100,“协同萃取”过程中发生反应: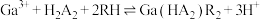 ,“协同萃取”后无机相含有的主要金属离子为
,“协同萃取”后无机相含有的主要金属离子为___________ ,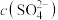 随
随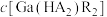 变化关系如图所示,“反萃取”加入稀硫酸的目的是
变化关系如图所示,“反萃取”加入稀硫酸的目的是___________ (用化学方程式表示)。 系中电势随pH变化的图像。“中和沉镓”时所调pH合理范围为4~
系中电势随pH变化的图像。“中和沉镓”时所调pH合理范围为4~___________ (填正整数),“碱溶造液”过程中发生反应的离子方程式为___________ 。___________ 。
(5)填隙方钴矿锑化物是一类新型热电材料,钴形成的六面体空隙中分别填充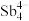 和As,该化合物的化学式为
和As,该化合物的化学式为___________ ;设阿伏加德罗常数的值为 ,已知该晶胞参数为a nm,则该晶体的密度是
,已知该晶胞参数为a nm,则该晶体的密度是___________  。
。
 、
、 、
、 、
、 、
、 、
、 )制备粗镓的工艺流程如图所示:
)制备粗镓的工艺流程如图所示:
回答下列问题。
(1)浸渣的主要成分是
 的作用是
的作用是(2)用
 代表P204,RH代表YW100,“协同萃取”过程中发生反应:
代表P204,RH代表YW100,“协同萃取”过程中发生反应: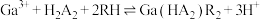 ,“协同萃取”后无机相含有的主要金属离子为
,“协同萃取”后无机相含有的主要金属离子为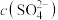 随
随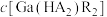 变化关系如图所示,“反萃取”加入稀硫酸的目的是
变化关系如图所示,“反萃取”加入稀硫酸的目的是
 系中电势随pH变化的图像。“中和沉镓”时所调pH合理范围为4~
系中电势随pH变化的图像。“中和沉镓”时所调pH合理范围为4~
(5)填隙方钴矿锑化物是一类新型热电材料,钴形成的六面体空隙中分别填充
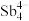 和As,该化合物的化学式为
和As,该化合物的化学式为 ,已知该晶胞参数为a nm,则该晶体的密度是
,已知该晶胞参数为a nm,则该晶体的密度是 。
。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】(1)以CO2为碳源制取低碳有机物一直是化学领域的研究热点,CO2加氢制取低碳醇的反应如下:
反应I:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H=-49.0kJ/mol
反应II:2CO2(g)+6H2(g)=CH3CH2OH(g)+3H2O(g) △H=-173.6kJ/mol
写出由CH3OH(g)合成CH3CH2OH(g)的反应的热化学方程式_______________________________
(2)高铁酸钾(K2FeO4)是铁的一种重要化合物,具有极强的氧化性
①电解法是工业上制备K2FeO4的一种方法。以铁为阳极电解氢氧化钠溶液,然后在阳极溶液中加入KOH。电解时阳极发生反应生成FeO42-,该电极反应式为______________________________
②与MnO2—Zn电池类似,K2FeO4—Zn也可以组成碱性电池,K2FeO4在电池中作正极材料,其电极反应式为FeO42-+3e-+4H2O=Fe(OH)3+5OH-,则该电池总反应的离子方程式为__________________
(3)可燃冰的主要成分是甲烷,甲烷既是清洁燃料,也是重要的化工原料。甲烷和二氧化碳重整制合成气对温室气体的治理具有重大意义。
已知:CH4(g)+CO2(g)==2CO(g)+2H2(g) ΔH=+247.3 kJ·mol-1
CH4(g)==C(s)+2H2(g) ΔH=+75 kJ·mol-1
则反应2CO(g)===C(s)+CO2(g)在________ (填“高温”或“低温”)下能自发进行。
(4)以甲烷为燃料的新型电池的成本大大低于以氢为燃料的传统燃料电池,下图是目前研究较多的一类固体氧化物燃料电池的工作原理示意图。
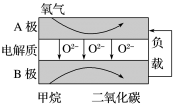
①B极为电池的________ 极,该电极的反应式为____________________________ 。
②若用该燃料电池作电源,用石墨作电极电解100 mL 1 mol·L-1的硫酸铜溶液,当两极收集到的气体体积相等时,理论上消耗甲烷的体积为___________ (标况下)。
反应I:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H=-49.0kJ/mol
反应II:2CO2(g)+6H2(g)=CH3CH2OH(g)+3H2O(g) △H=-173.6kJ/mol
写出由CH3OH(g)合成CH3CH2OH(g)的反应的热化学方程式
(2)高铁酸钾(K2FeO4)是铁的一种重要化合物,具有极强的氧化性
①电解法是工业上制备K2FeO4的一种方法。以铁为阳极电解氢氧化钠溶液,然后在阳极溶液中加入KOH。电解时阳极发生反应生成FeO42-,该电极反应式为
②与MnO2—Zn电池类似,K2FeO4—Zn也可以组成碱性电池,K2FeO4在电池中作正极材料,其电极反应式为FeO42-+3e-+4H2O=Fe(OH)3+5OH-,则该电池总反应的离子方程式为
(3)可燃冰的主要成分是甲烷,甲烷既是清洁燃料,也是重要的化工原料。甲烷和二氧化碳重整制合成气对温室气体的治理具有重大意义。
已知:CH4(g)+CO2(g)==2CO(g)+2H2(g) ΔH=+247.3 kJ·mol-1
CH4(g)==C(s)+2H2(g) ΔH=+75 kJ·mol-1
则反应2CO(g)===C(s)+CO2(g)在
(4)以甲烷为燃料的新型电池的成本大大低于以氢为燃料的传统燃料电池,下图是目前研究较多的一类固体氧化物燃料电池的工作原理示意图。

①B极为电池的
②若用该燃料电池作电源,用石墨作电极电解100 mL 1 mol·L-1的硫酸铜溶液,当两极收集到的气体体积相等时,理论上消耗甲烷的体积为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
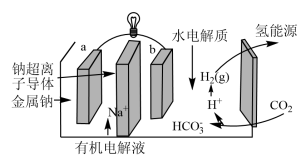
【推荐3】2023年全国政府工作报告指出,推动重点领域节能降碳减污。一种太空生命保障系统利用电解水供氧,生成的氢气与宇航员呼出的二氧化碳在催化剂作用下生成水和甲烷,水可循环使用。
(1)已知





写出 与
与 反应生成
反应生成 和
和 的热化学方程式
的热化学方程式___________ 。
(2)一定温度下,在恒容密闭容器中 与
与 反应生成
反应生成 和
和 。
。
①能说明该反应达到平衡状态的是___________ (填字母)。
A. B.容器内压强一定
B.容器内压强一定
C.气体平均相对分子质量一定 D.气体密度一定
E. 的体积分数一定
的体积分数一定
②已知容器的容积为 ,初始加入
,初始加入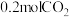 和
和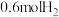 ,反应平衡后测得
,反应平衡后测得 的转化率为
的转化率为 ,则该反应的平衡常数为
,则该反应的平衡常数为___________  。
。
③温度不变,向上述②平衡后的体系中加入 和
和 ,再次平衡后
,再次平衡后 的转化率
的转化率___________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(3)工业上在一定条件下利用 与
与 可直接合成有机中间体二甲醚:
可直接合成有机中间体二甲醚: 。
。
当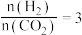 时,实验测得
时,实验测得 的平衡转化率随温度及压强变化如图。
的平衡转化率随温度及压强变化如图。

①该反应的
___________ 0(填“>”或“<”)。
②图中压强(p)由大到小的顺序是___________ 。
(4)科学家研发出一种新系统,通过“溶解”水中的二氧化碳,以触发电化学反应,有效减少碳的排放,其工作原理如图所示。系统工作时,a极为___________ 极,b极区的电极反应式为___________ 。
(1)已知






写出
 与
与 反应生成
反应生成 和
和 的热化学方程式
的热化学方程式(2)一定温度下,在恒容密闭容器中
 与
与 反应生成
反应生成 和
和 。
。①能说明该反应达到平衡状态的是
A.
 B.容器内压强一定
B.容器内压强一定C.气体平均相对分子质量一定 D.气体密度一定
E.
 的体积分数一定
的体积分数一定②已知容器的容积为
 ,初始加入
,初始加入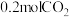 和
和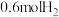 ,反应平衡后测得
,反应平衡后测得 的转化率为
的转化率为 ,则该反应的平衡常数为
,则该反应的平衡常数为 。
。③温度不变,向上述②平衡后的体系中加入
 和
和 ,再次平衡后
,再次平衡后 的转化率
的转化率 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(3)工业上在一定条件下利用
 与
与 可直接合成有机中间体二甲醚:
可直接合成有机中间体二甲醚: 。
。当
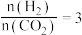 时,实验测得
时,实验测得 的平衡转化率随温度及压强变化如图。
的平衡转化率随温度及压强变化如图。
①该反应的

②图中压强(p)由大到小的顺序是
(4)科学家研发出一种新系统,通过“溶解”水中的二氧化碳,以触发电化学反应,有效减少碳的排放,其工作原理如图所示。系统工作时,a极为

您最近一年使用:0次






