氮族元素按原子序数增大,依次为:氮(N)、磷(P)、砷(As)、锑(Sb)、铋(Bi)。请回答:
(1)常温常压下,向100mL 1.6mol/L稀氨水中逐滴滴入10mL 4.0mol/L稀硫酸,得到的溶液能使酚酞显红色。请比较所得溶液中NH4+、 NH3﹒H2O、SO42-三种微粒的物质的量浓度大小关系:_______________ 。
(2)含有砒霜(As2O3)的试样和锌、盐酸混合反应,生成的砷化氢在热玻璃管中完全分解成氢气和1.50 mg单质砷。则在整个过程中,转移的电子总数为____________ 。
(3)铋酸钠(NaBiO3)溶液呈无色。向硫酸锰溶液中依次滴加下列溶液,对应的现象如表所示:
请比较实验中所有的氧化剂和氧化产物的氧化性强弱关系(反应过程中的涉及的气体均不参与比较):________________________________________ 。
(4)五氟化锑(SbF5)是无色黏稠液体,是很强的具有特殊酸性的酸,而且是超强酸氟锑酸HSbF6(目前酸性最强的酸,比纯硫酸强2×1019倍)的组分之一。SbF5可用于制备一般化学方法很难制备的氧化性极强的F2,其过程如下(均未配平):
①KMnO4+ KF + H2O2+ HF → K2MnF6+O2+ H2O
②SbCl5 + HF → SbF5+ HCl
③K2MnF6+ SbF5→ KSbF6 + MnF3+ F2↑
反应①中氧化剂和被氧化的元素的物质的量之比为_________ ;反应③中SbF5表现的性质为________ 性。
(5)能在一定程度上抵消、减轻外加强酸或强碱对溶液酸度的影响,从而保持溶液的pH值相对稳定。这种溶液称为缓冲溶液。例如:人体血液中HCO3-和H2CO3等微粒形成的平衡体系,使得血液pH能稳定在7.4±0.05。某同学取19mL0.2mol/L的NaH2PO4溶液,81mL0.2mol/L的Na2HPO4溶液混合,配制0.2mol/L pH=7.4的磷酸缓冲溶液。已知该缓冲溶液利用的平衡体系是:H2PO4- H++HPO42-,请根据该平衡体系分析其缓冲原理:
H++HPO42-,请根据该平衡体系分析其缓冲原理:________________________ 。
(1)常温常压下,向100mL 1.6mol/L稀氨水中逐滴滴入10mL 4.0mol/L稀硫酸,得到的溶液能使酚酞显红色。请比较所得溶液中NH4+、 NH3﹒H2O、SO42-三种微粒的物质的量浓度大小关系:
(2)含有砒霜(As2O3)的试样和锌、盐酸混合反应,生成的砷化氢在热玻璃管中完全分解成氢气和1.50 mg单质砷。则在整个过程中,转移的电子总数为
(3)铋酸钠(NaBiO3)溶液呈无色。向硫酸锰溶液中依次滴加下列溶液,对应的现象如表所示:
| 加入溶液 | ①适量铋酸钠溶液 | ②过量的双氧水 | ③适量KI淀粉溶液 |
| 实验现象 | 溶液呈紫红色 | 紫红色消失,产生气泡 | 溶液变成蓝色 |
(4)五氟化锑(SbF5)是无色黏稠液体,是很强的具有特殊酸性的酸,而且是超强酸氟锑酸HSbF6(目前酸性最强的酸,比纯硫酸强2×1019倍)的组分之一。SbF5可用于制备一般化学方法很难制备的氧化性极强的F2,其过程如下(均未配平):
①KMnO4+ KF + H2O2+ HF → K2MnF6+O2+ H2O
②SbCl5 + HF → SbF5+ HCl
③K2MnF6+ SbF5→ KSbF6 + MnF3+ F2↑
反应①中氧化剂和被氧化的元素的物质的量之比为
(5)能在一定程度上抵消、减轻外加强酸或强碱对溶液酸度的影响,从而保持溶液的pH值相对稳定。这种溶液称为缓冲溶液。例如:人体血液中HCO3-和H2CO3等微粒形成的平衡体系,使得血液pH能稳定在7.4±0.05。某同学取19mL0.2mol/L的NaH2PO4溶液,81mL0.2mol/L的Na2HPO4溶液混合,配制0.2mol/L pH=7.4的磷酸缓冲溶液。已知该缓冲溶液利用的平衡体系是:H2PO4-
 H++HPO42-,请根据该平衡体系分析其缓冲原理:
H++HPO42-,请根据该平衡体系分析其缓冲原理:
更新时间:2019-01-30 18:14:09
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】I.已知常温下,0.1mol·L−1HA溶液pH约为3,则:
(1)HA的电离平衡常数约为_______ ,0.1mol·L−1HA溶液中HA的电离度约为_______ 。
(2)向上述HA溶液中加入等浓度的NaOH溶液,
①若两者体积相等,溶液呈_____ 性,原因为(离子方程式)________ ,此时溶液中离子浓度由大到小的顺序为______ ,若所得溶液pH=a,则c(Na+)-c(A-)=______ mol·L−1。
②若混合溶液呈中性,则加入的NaOH溶液的体积________ 原HA溶液的体积。
③若两者以体积比2:1混合,溶液呈_____ 性,原因为(文字叙述)_____ ,此时溶液中各分子、离子浓度由大到小的顺序为_______ 。
④上述①②③所得混合液中水的电离程度最大的是_____ 。
(3)用0.1mol·L−1NaOH标准溶液滴定未知浓度的HA溶液,应选用_______ 作为指示剂,滴定终点的现象为_____ 。滴定时所用的锥形瓶中残留少量蒸馏水,则测定的HA浓度会____ ,若滴定前碱式滴定管中有气泡,滴定后消失,则测定的HA浓度会__________ 。
II.(4)某种难溶强电解质MA常温下的Ksp=1.4×10-9。MCl溶液与NaA溶液混合可形成MA沉淀,现将等体积的MCl溶液与NaA溶液混合,若MCl溶液的浓度为1×10-4mol/L,则生成沉淀所需NaA溶液的最小浓度为______ mol/L。
(5)工业中常将BaSO4转化为BaCO3后,再将其制成各种可溶性的钡盐(如:BaCl2)。具体做法是用浓Na2CO3溶液浸泡BaSO4粉末,并不断补充纯碱,最后BaSO4转化为BaCO3。若使0.05molBaSO4全部转化为BaCO3,至少要加入____ molNa2CO3。[已知:Ksp(BaSO4)=1.0×10-10,Ksp(BaCO3)=2.5×10-9。]
(1)HA的电离平衡常数约为
(2)向上述HA溶液中加入等浓度的NaOH溶液,
①若两者体积相等,溶液呈
②若混合溶液呈中性,则加入的NaOH溶液的体积
③若两者以体积比2:1混合,溶液呈
④上述①②③所得混合液中水的电离程度最大的是
(3)用0.1mol·L−1NaOH标准溶液滴定未知浓度的HA溶液,应选用
II.(4)某种难溶强电解质MA常温下的Ksp=1.4×10-9。MCl溶液与NaA溶液混合可形成MA沉淀,现将等体积的MCl溶液与NaA溶液混合,若MCl溶液的浓度为1×10-4mol/L,则生成沉淀所需NaA溶液的最小浓度为
(5)工业中常将BaSO4转化为BaCO3后,再将其制成各种可溶性的钡盐(如:BaCl2)。具体做法是用浓Na2CO3溶液浸泡BaSO4粉末,并不断补充纯碱,最后BaSO4转化为BaCO3。若使0.05molBaSO4全部转化为BaCO3,至少要加入
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】氮化镁(Mg3N2)是工业上应用广泛的离子化合物,通常条件下为黄绿色的粉末,极易与水反应,常用作接触媒。
I.氮化镁的制备
下面是甲、乙两位学生提出的制备氮化镁的两种实验方案示意框(实验前系统内的空气已排除, 图中箭头表示气体的流向)。
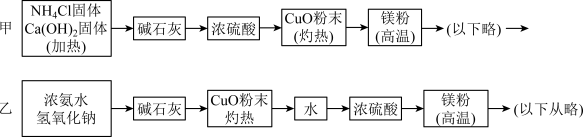
(1)Mg3N2的电子式为__________________ 。
(2)请结合化学方程式分析乙同学方案中氢氧化钠的作用:_____________________________ 。
(3)上述方案中,可制得氮化镁的方案为________________ 。
(4)丙同学利用空气中含有大量N2的事实,用以下装置设计了另外一种制备氮化镁的方案(夹持装置略去):

①按气流由左到右的方向,上述装置合理的连接顺序为____________________ (填装置字母)。
②装置D的作用为__________________ 。
Ⅱ.定性分析产物
Ⅲ.定量测定氮化镁纯度
i.称取4.0g反应后的固体,加入足量水,将生成的气体全部蒸出并通入100.00mL1.00mol/L盐酸中,充分反应后,将所得溶液稀释到200.00mL
ii.取20.00 mL稀释后的溶液,用0.2 mol/LNaOH标准溶液滴定过量的盐酸,到终点时消耗标准溶液25.00 mL
(7)所取固体中氮化镁的质量分数为____________________ 。
I.氮化镁的制备
下面是甲、乙两位学生提出的制备氮化镁的两种实验方案示意框(实验前系统内的空气已排除, 图中箭头表示气体的流向)。

(1)Mg3N2的电子式为
(2)请结合化学方程式分析乙同学方案中氢氧化钠的作用:
(3)上述方案中,可制得氮化镁的方案为
(4)丙同学利用空气中含有大量N2的事实,用以下装置设计了另外一种制备氮化镁的方案(夹持装置略去):

①按气流由左到右的方向,上述装置合理的连接顺序为
②装置D的作用为
Ⅱ.定性分析产物
| 操作步骤 | 实验现象 | 解释原因 |
| 取少量产品于试管中,加足量蒸馏水 | 试管底部有固体不溶物,有刺激性气味的气体产生 | (5)写出反应的化学方程式 |
| 弃去上层清液,加入足量稀盐酸 | 观察到固体全部溶解且冒气泡 | (6)冒气泡的原因 |
i.称取4.0g反应后的固体,加入足量水,将生成的气体全部蒸出并通入100.00mL1.00mol/L盐酸中,充分反应后,将所得溶液稀释到200.00mL
ii.取20.00 mL稀释后的溶液,用0.2 mol/LNaOH标准溶液滴定过量的盐酸,到终点时消耗标准溶液25.00 mL
(7)所取固体中氮化镁的质量分数为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】已知化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理。请回答下列问题:
(1)可逆反应:FeO(s)+CO(g) Fe(s)+CO2(g)是炼铁工业中的一个重要反应,其温度与平衡常数K的关系如下表:
Fe(s)+CO2(g)是炼铁工业中的一个重要反应,其温度与平衡常数K的关系如下表:
若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,若升高温度,混合气体的平均相对分子质量________ (填“增大”“减小”或“不变”,下同);充入氦气,混合气体的密度 ________ 。
(2)常温下,浓度均为0.1 mol·L-1的下列五种溶液的pH如下表:
①上述盐溶液中的阴离子,结合质子能力最强的是_________________ 。
②根据表中数据判断,浓度均为0.01 mol·L-1的下列四种物质的溶液中,酸性最强的是________ ;将各溶液分别稀释100倍,pH变化最小的是________ (填字母)。
A.HCN B.HClO C.H2CO3 D.CH3COOH
③要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸钠溶液,反应的离子方程式为:____________________________________________________________ 。
④含有Cr2O72-的废水毒性较大,某工厂废水中含5.0×10-3 mol·L-1的Cr2O72-。为了使废水的排放达标,进行如下处理:

若处理后的废水中残留的c(Fe3+)=4.0×10-13 mol·L-1,则残留的Cr3+的浓度为_____ mol·L-1(已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31)。
(1)可逆反应:FeO(s)+CO(g)
 Fe(s)+CO2(g)是炼铁工业中的一个重要反应,其温度与平衡常数K的关系如下表:
Fe(s)+CO2(g)是炼铁工业中的一个重要反应,其温度与平衡常数K的关系如下表:| T(K) | 938 | 1100 |
| K | 0.68 | 0.40 |
若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,若升高温度,混合气体的平均相对分子质量
(2)常温下,浓度均为0.1 mol·L-1的下列五种溶液的pH如下表:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
①上述盐溶液中的阴离子,结合质子能力最强的是
②根据表中数据判断,浓度均为0.01 mol·L-1的下列四种物质的溶液中,酸性最强的是
A.HCN B.HClO C.H2CO3 D.CH3COOH
③要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸钠溶液,反应的离子方程式为:
④含有Cr2O72-的废水毒性较大,某工厂废水中含5.0×10-3 mol·L-1的Cr2O72-。为了使废水的排放达标,进行如下处理:

若处理后的废水中残留的c(Fe3+)=4.0×10-13 mol·L-1,则残留的Cr3+的浓度为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】知乙二酸(HOOC—COOH)俗称草酸,广泛分布于植物、动物和真菌体中,在实验研究和化学工业中应用广泛。草酸易溶于水,为二元弱酸,酸性强于碳酸,其盐草酸钙和草酸氢钙均为白色不溶物。无色晶体H2C2O4•2H2O称为草酸晶体,其熔点为101.5℃。草酸晶体失去结晶水得无水草酸,它在157℃升华。草酸分解产生CO、CO2和H2O。根据上述信息,回答下列问题。
(1)写出草酸晶体受热分解的化学方程式______ 。
(2)可用下列装置验证草酸晶体的分解产物(草酸晶体分解装置、夹持装置及连接导管均略去)。
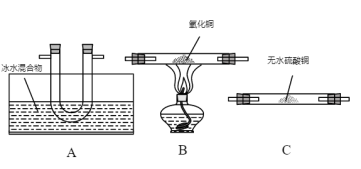
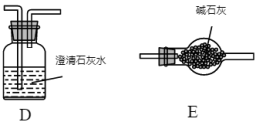
①装置的连接顺序为______ 、______ 、D、E、______ 、______ 。
②A装置的作用是______ 。
③写出整套装置存在的不合理之处______ 。
(3)下列叙述能说明草酸具有弱酸性的是______ 。
a.将草酸晶体溶于含酚酞的NaOH溶液中,溶液褪色
b.测定草酸钠(Na2C2O4)溶液的pH>7
c.等体积等浓度的草酸溶液和稀硫酸,稀硫酸消耗碱的能力强
d.PH=2的草酸溶液和稀硫酸,分别稀释100倍后前者pH小
e.将草酸晶体加入Na2CO3溶液中,有CO2放出
(4)可用0.10 mol/L酸性KMnO4标准溶液来滴定未知浓度的草酸溶液。
①确定反应达到终点的现象是滴入最后一滴溶液时______ 。
②若滴定终止时,俯视读数,所测H2C2O4浓度______ (填“偏高”“偏低”或“无影响”)。
(5)草酸溶液中微粒的物质的量分数随溶液pH变化如图所示:
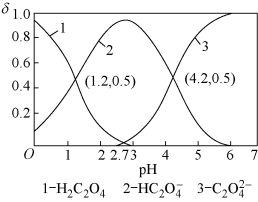
向10 mL 0.1 mol·L-1H2C2O4溶液中逐滴加入0.1 mol·L-1NaOH溶液,当溶液中c(Na+)=2c( )+c(
)+c( )时,加入V(NaOH)
)时,加入V(NaOH)______ 10 mL(填“>”“=”或“<”),若加入NaOH溶液体积为20 mL,此时溶液中阴离子浓度的大小顺序为______ ;当pH=2.7时,溶液中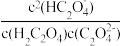 =
=______ 。
(1)写出草酸晶体受热分解的化学方程式
(2)可用下列装置验证草酸晶体的分解产物(草酸晶体分解装置、夹持装置及连接导管均略去)。


①装置的连接顺序为
②A装置的作用是
③写出整套装置存在的不合理之处
(3)下列叙述能说明草酸具有弱酸性的是
a.将草酸晶体溶于含酚酞的NaOH溶液中,溶液褪色
b.测定草酸钠(Na2C2O4)溶液的pH>7
c.等体积等浓度的草酸溶液和稀硫酸,稀硫酸消耗碱的能力强
d.PH=2的草酸溶液和稀硫酸,分别稀释100倍后前者pH小
e.将草酸晶体加入Na2CO3溶液中,有CO2放出
(4)可用0.10 mol/L酸性KMnO4标准溶液来滴定未知浓度的草酸溶液。
①确定反应达到终点的现象是滴入最后一滴溶液时
②若滴定终止时,俯视读数,所测H2C2O4浓度
(5)草酸溶液中微粒的物质的量分数随溶液pH变化如图所示:

向10 mL 0.1 mol·L-1H2C2O4溶液中逐滴加入0.1 mol·L-1NaOH溶液,当溶液中c(Na+)=2c(
 )+c(
)+c( )时,加入V(NaOH)
)时,加入V(NaOH)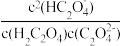 =
=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】氮氧化物(NOx)是严重的大气污染物,能引起雾霾、光化学烟雾、酸雨等环境问题。回答下列问题
(1)利用甲烷催化可还原NOx,相关反应如下
N2(g)+O2(g)=2NO(g)△H=+180.5kJ·mol-1
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l)△H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(l)△H=-1160kJ·mol-1
写出常温常压下,甲烷完全燃烧的热化学方程式:_______ 。
(2)在催化剂条件下,可发生反应2NO(g)+2CO(g)=N2(g)+2CO2(g)。分别在T1、T2两个温度下,向容积均为2L的甲、乙两个恒容密闭容器中分别充入0.20 mol NO(g)和0.20 mol CO(g)。反应过程中两容器中CO2的物质的量浓度随时间的变化关系如图所示。

①甲容器中,用NO表示5min内反应速率为_____ 。
②T1___ (填“>”或“<”)T2,该反应是_____ (填“吸热”或“放热”)反应。
③T2温度时,该反应的平衡常数是_____ L/mol(结果保留小数点后两位),与T2时相比,T1温度时的平衡常数更___ (填“大”或“小”)。
④乙容器达到平衡后,再充入0.10mlNO和0.10molCO2,此时υ(正)___ (填“>”或“<”)v(逆)。
(3)NO2和NO的混合物可被NaOH吸收生成NaNO2。已知HNO2是一元弱酸,写出NaNO2溶液中离子浓度的大小关系:___ 。常温下,pH=9的NaNO2溶液中,c(Na+)—c(NO2-)=_______ (列出数学计算式)。
(1)利用甲烷催化可还原NOx,相关反应如下
N2(g)+O2(g)=2NO(g)△H=+180.5kJ·mol-1
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l)△H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(l)△H=-1160kJ·mol-1
写出常温常压下,甲烷完全燃烧的热化学方程式:
(2)在催化剂条件下,可发生反应2NO(g)+2CO(g)=N2(g)+2CO2(g)。分别在T1、T2两个温度下,向容积均为2L的甲、乙两个恒容密闭容器中分别充入0.20 mol NO(g)和0.20 mol CO(g)。反应过程中两容器中CO2的物质的量浓度随时间的变化关系如图所示。

①甲容器中,用NO表示5min内反应速率为
②T1
③T2温度时,该反应的平衡常数是
④乙容器达到平衡后,再充入0.10mlNO和0.10molCO2,此时υ(正)
(3)NO2和NO的混合物可被NaOH吸收生成NaNO2。已知HNO2是一元弱酸,写出NaNO2溶液中离子浓度的大小关系:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】弱电解质的电离平衡与日常生活、工农业生产等息息相关。回答下列问题:
I.部分弱酸的电离平衡常数如下表:
(1)用离子方程式说明Na2C2O4溶液显碱性的原因___________ 。
(2)常温下,pH相同的HCOONa和NaClO溶液,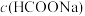
___________ (填“>”“=”或“<”,下同)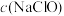 ,一定浓度的NaHS溶液pH
,一定浓度的NaHS溶液pH___________ 7。
(3)已知Ksp(CaC2O4)=a。将0.03 mol∙L−1的CaCl2溶液与0.02 mol∙L−1的Na2C2O4溶液等体积混合,混合溶液中 的浓度约为
的浓度约为_____ mol∙L−1(用含a的代数式表示,混合后溶液体积变化忽略不计)。
Ⅱ.现用浓度为0.0100 mol/L酸性KMnO4溶液滴定未知浓度的草酸(H2C2O4),请回答下列问题:
(4)KMnO4标准溶液应装在___________ (填“酸式”或“碱式”)滴定管中。滴定终点时的实验现象是___________ 。
(5)记录数据如下:
则测出的H2C2O4溶液的物质的量浓度为___________ 。
(6)下列操作会导致测定草酸浓度偏高的是___________。
I.部分弱酸的电离平衡常数如下表:
| 弱酸 | HCOOH | H2S | H2C2O4 | HClO |
| 电离平衡常数(25℃) | Ka=1.8×10−4 | Ka1=1.1×10−7 Ka2=1.3×10−13 | Ka1=5.6×10−2 Ka2=1.5×10−4 | Ka=4.0×10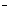 8 8 |
(1)用离子方程式说明Na2C2O4溶液显碱性的原因
(2)常温下,pH相同的HCOONa和NaClO溶液,
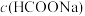
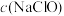 ,一定浓度的NaHS溶液pH
,一定浓度的NaHS溶液pH(3)已知Ksp(CaC2O4)=a。将0.03 mol∙L−1的CaCl2溶液与0.02 mol∙L−1的Na2C2O4溶液等体积混合,混合溶液中
 的浓度约为
的浓度约为Ⅱ.现用浓度为0.0100 mol/L酸性KMnO4溶液滴定未知浓度的草酸(H2C2O4),请回答下列问题:
(4)KMnO4标准溶液应装在
(5)记录数据如下:
| 滴定次数 | 待测溶液体积/mL | KMnO4溶液体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 1.50 | 23.70 |
| 2 | 25.00 | 1.02 | 26.03 |
| 3 | 25.00 | 0.00 | 24.99 |
(6)下列操作会导致测定草酸浓度偏高的是___________。
| A.装高锰酸钾溶液的滴定管滴定前尖嘴中有气泡,滴定后气泡消失 |
| B.配制标准溶液时俯视刻度线 |
| C.未用标准液润洗滴定管 |
| D.滴定前盛放草酸溶液的锥形瓶用蒸馏水洗净后没有干燥 |
您最近一年使用:0次



