已知25℃时部分弱电解质的电离平衡常数数据如表所示:
下列物质的量浓度均为0.1 mol·L-1的四种溶液中pH最大的是
| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
下列物质的量浓度均为0.1 mol·L-1的四种溶液中pH最大的是
| A.CH3COONa | B.Na2CO3 | C.NaClO | D.NaHCO3 |
更新时间:2016-03-25 05:30:09
|
相似题推荐
单选题
|
适中
(0.65)
【推荐1】25 ℃时,几种弱酸的电离平衡常数如下表所示,下列说法正确的是
| 化学式 | HCOOH | H2CO3 | HCN |
| 电离平衡常数 | K=1.8×10-4 | K1=4.3×10-7 K2=5.6×10-11 | K=4.9×10-10 |
| A.H2CO3 溶液和NaCN 溶液反应的离子方程式为H2CO3+CN-==HCO3-+HCN |
| B.HCOOH 的电离平衡常数表达式为K= c(HCOOH)/[c(HCOO-)·c(H+)] |
| C.Na2CO3 溶液显碱性,NaHCO3 溶液显酸性 |
| D.酸性强弱顺序是HCOOH>HCN>H2CO3 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】有关化学反应的下列说法正确的是
A.常温下,将 的盐酸和 的盐酸和 的醋酸溶液等体积混合后 的醋酸溶液等体积混合后 仍为3 仍为3 |
| B.放热反应的反应速率总是大于吸热反应的反应速率 |
C. 的盐酸与 的盐酸与 醋酸溶液中氢离子总数相等 醋酸溶液中氢离子总数相等 |
D.常温下, 的 的 溶液与 溶液与 的氨水等体积混合后溶液呈酸性 的氨水等体积混合后溶液呈酸性 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】明矾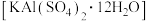 是重要化工原料,下列与明矾相关的实验设计中,结论错误的是
是重要化工原料,下列与明矾相关的实验设计中,结论错误的是
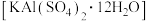 是重要化工原料,下列与明矾相关的实验设计中,结论错误的是
是重要化工原料,下列与明矾相关的实验设计中,结论错误的是实验方案 | 现象 | 结论 | |
A | 用铂丝蘸取明矾溶液置于无色火焰上灼烧,透过蓝色钴玻璃观察 | 火焰呈紫色 | 明矾中含有 |
B | 分别用明矾溶液、蒸馏水喷淋两张白纸,久置一段时间后,观察 | 明矾喷淋过的白纸老化明显 |  水解产生的H+可促进纸张中的纤维素的水解 水解产生的H+可促进纸张中的纤维素的水解 |
C | 明矾溶液中加入过量NaF后再加浓氨水 | 无白色沉淀生成 |  会与 会与 反应,且反应后溶液中的 反应,且反应后溶液中的 浓度很低 浓度很低 |
D | 取一烧杯比室温高3~5℃的明矾饱和溶液,把明矾小晶体悬挂在烧杯中央,静置 | 明矾小晶体变成了外形规则的大晶体 | 析出的明矾覆盖到小晶体表面,晶体变大,若急速冷却,可获得更大颗粒的晶体 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】一定条件下,在水溶液中1molCl−、ClO x − (x=1,2,3,4)的能量(kJ)相对大小如图所示。下列有关说法正确的是
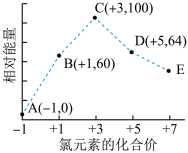

| A.这些离子中结合H+能力最强的是E |
| B.A、B、C、D、E五种微粒中C最稳定 |
| C.C→B+D的反应,反应物的总键能小于生成物的总键能 |
| D.B→A+D是吸热反应 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐3】下列实验操作能达到实验目的的是
| 选项 | 实验目的 | 实验操作 |
| A | 探究浓度对反应速率影响 | 向两支各盛有5mL0.1mol•L-1KMnO4溶液的试管中分别滴加2滴0.1mol•L-1H2C2O4和0.01mol•L-1H2C2O4,观察KMnO4溶液褪色所需时间 |
| B | 比较NaHSO3溶液中c( )和c(H2SO3)大小 )和c(H2SO3)大小 | 在pH试纸上滴2~3滴NaHSO3 溶液,测pH |
| C | 验证I-与Fe3+的反应有一定限度 | 向5mL0.1mol•L-1KI溶液中加入10mL0.1mol•L-1FeCl3溶液,充分反应后滴加KSCN 溶液 |
| D | 验证H2O2的氧化性比Fe3+强 | 将硫酸酸化的H2O2滴入Fe(NO3)2溶液,溶液变黄色 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次

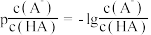 ]。下列叙述
]。下列叙述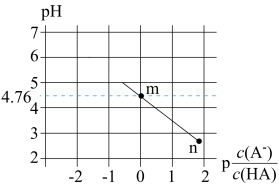
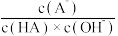 保持不变
保持不变

