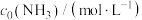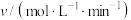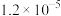金属单质及其化合物与工农业生产、日常生活有密切的联系。请回答下列问题:
(1)Fe2O3(s)+ C(s)=
C(s)= CO2(g)+2Fe(s) ΔH=+234KJ/mol
CO2(g)+2Fe(s) ΔH=+234KJ/mol
C(s)+O2(g)=CO2(g)ΔH=-393.5KJ/mol
则2Fe(s)+ O2(g)=Fe2O3(s)的ΔH是
O2(g)=Fe2O3(s)的ΔH是____________________
(2)一定温度下,氧化铁可以与一氧化碳发生如下反应:

①该温度时,在2 L盛有Fe2O3粉末的密闭容器中通入CO气体,5 min后,生成了单质铁11.2 g,则这段时间内CO的反应速率为_____________ ;
②达平衡后,若温度升高,CO的含量增大,则Q____ 0(填“>”、“=”、“<”)。
(3)工业常根据金属氢氧化物在酸中溶解度不同,通过控制溶液的pH,达到分离金属离子的目的。如是难溶金属的氢氧化物在不同pH下的溶解情况(s/mol·L-1)。若要除去CuCl2溶液的少量Fe3+,应控制溶液的pH为________(填序号)。

(4)某工业废水中含有Cu2+、Pb2+、Hg2+,若向工业废水中加入过量的FeS,当FeS、CuS、PbS和HgS共存时,溶液中c(Fe2+):c(Pb2+):c(Hg2+)=__________ :_________ :_________ 。
已知:Ksp(FeS)=6.3×10-18mol2·L-2,Ksp(PbS)=3.4×10-28mol2·L-2
Ksp(CuS)=1.3×10-36mol2·L-2,Ksp(HgS)=6.4×10-53mol2·L-2
(5)依据氧化还原反应:Cu2+(aq)+Fe(s)===Fe2+(aq)+Cu(s)设计成如图所示的原电池,则关于该电池装置的说法中不正确的是_______(填序号)。

(1)Fe2O3(s)+
 C(s)=
C(s)= CO2(g)+2Fe(s) ΔH=+234KJ/mol
CO2(g)+2Fe(s) ΔH=+234KJ/molC(s)+O2(g)=CO2(g)ΔH=-393.5KJ/mol
则2Fe(s)+
 O2(g)=Fe2O3(s)的ΔH是
O2(g)=Fe2O3(s)的ΔH是(2)一定温度下,氧化铁可以与一氧化碳发生如下反应:

①该温度时,在2 L盛有Fe2O3粉末的密闭容器中通入CO气体,5 min后,生成了单质铁11.2 g,则这段时间内CO的反应速率为
②达平衡后,若温度升高,CO的含量增大,则Q
(3)工业常根据金属氢氧化物在酸中溶解度不同,通过控制溶液的pH,达到分离金属离子的目的。如是难溶金属的氢氧化物在不同pH下的溶解情况(s/mol·L-1)。若要除去CuCl2溶液的少量Fe3+,应控制溶液的pH为________(填序号)。

| A.小于l | B.4左右 | C.大于6 | D.大于9 |
已知:Ksp(FeS)=6.3×10-18mol2·L-2,Ksp(PbS)=3.4×10-28mol2·L-2
Ksp(CuS)=1.3×10-36mol2·L-2,Ksp(HgS)=6.4×10-53mol2·L-2
(5)依据氧化还原反应:Cu2+(aq)+Fe(s)===Fe2+(aq)+Cu(s)设计成如图所示的原电池,则关于该电池装置的说法中不正确的是_______(填序号)。

| A.电极X的材料是Fe |
| B.电解质溶液Y是AgNO3溶液 |
| C.原电池工作时,盐桥中的阴离子不断移向左池的氯化钠溶液中 |
| D.原电池工作时,X电极反应为:O2+2H2O+4e-→4OH- |
2010·四川绵阳·一模 查看更多[1]
(已下线)2010年四川绵阳高考预测(综合题)化学卷
更新时间:2016-12-09 00:41:50
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】甲醇是一种可再生能源,具有开发和应用的广阔前景。
(1)①已知 、
、 的燃烧热分别为
的燃烧热分别为 ,
, 。
。
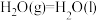

则 的
的
_______  。
。
② 与
与 合成甲醇过程中,会发生副反应:
合成甲醇过程中,会发生副反应:
 ,为减少副反应的发生,同时不降低
,为减少副反应的发生,同时不降低 生成
生成 的反应速率和平衡转化率,可采取的措施是
的反应速率和平衡转化率,可采取的措施是_______ 。
(2)科学家以 为催化剂,液相催化氧化甲烷生成硫酸单甲酯,再经水解得到甲醇,反应机理如图甲所示。图甲所示工艺总反应的化学方程式为
为催化剂,液相催化氧化甲烷生成硫酸单甲酯,再经水解得到甲醇,反应机理如图甲所示。图甲所示工艺总反应的化学方程式为_______ 。


(3)用如图乙所示的电解装置可制得甲醇等。
①阳极区发生的电极反应式为_______ 。
②请解释阴极区NaOH浓度增大的原因_______ 。
(1)①已知
 、
、 的燃烧热分别为
的燃烧热分别为 ,
, 。
。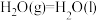

则
 的
的
 。
。②
 与
与 合成甲醇过程中,会发生副反应:
合成甲醇过程中,会发生副反应:
 ,为减少副反应的发生,同时不降低
,为减少副反应的发生,同时不降低 生成
生成 的反应速率和平衡转化率,可采取的措施是
的反应速率和平衡转化率,可采取的措施是(2)科学家以
 为催化剂,液相催化氧化甲烷生成硫酸单甲酯,再经水解得到甲醇,反应机理如图甲所示。图甲所示工艺总反应的化学方程式为
为催化剂,液相催化氧化甲烷生成硫酸单甲酯,再经水解得到甲醇,反应机理如图甲所示。图甲所示工艺总反应的化学方程式为

(3)用如图乙所示的电解装置可制得甲醇等。
①阳极区发生的电极反应式为
②请解释阴极区NaOH浓度增大的原因
您最近一年使用:0次
【推荐2】在催化剂作用下H2(g)可将烟气中的SO2(g)还原成S(s)。回答下列问题:
(1)已知:
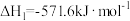

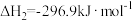
则H2(g)还原烟气中的SO2(g)的热化学方程式为___________ 。
(2)在容积为10L的容器中充入1mol SO2(g)与2mol H2(g)的混合气体,发生反应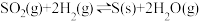
 。
。
①恒容时,反应经过4s后达到平衡,此时测得H2O(g)的物质的量为1.2mol。则0~4s内,v(H2)=___________ mol/(L·s),平衡时,c(SO2)=___________ mol/L;若平衡后升高温度,SO2的转化率将___________ (填“增 大”“减小”或“不变”)。
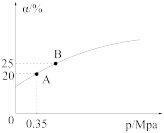
②恒温时,压强p与SO2的平衡转化率α如图所示,该温度下,该反应的平衡常数K=___________ L/mol;平衡状态由A变到B,平衡常数K(A) ___________ (填“>”“<”或“=”)K(B)。
③若在恒温恒容密闭容器中发生上述反应,下列可作为该反应达到平衡状态的标志是___________ (填标号)。
A.压强不再变化
B.密度不再变化
C.气体的平均相对分子质量不再变化
D.SO2的消耗速率与H2的消耗速率之比为1∶2
(1)已知:

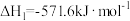

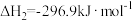
则H2(g)还原烟气中的SO2(g)的热化学方程式为
(2)在容积为10L的容器中充入1mol SO2(g)与2mol H2(g)的混合气体,发生反应
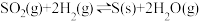
 。
。①恒容时,反应经过4s后达到平衡,此时测得H2O(g)的物质的量为1.2mol。则0~4s内,v(H2)=
②恒温时,压强p与SO2的平衡转化率α如图所示,该温度下,该反应的平衡常数K=

③若在恒温恒容密闭容器中发生上述反应,下列可作为该反应达到平衡状态的标志是
A.压强不再变化
B.密度不再变化
C.气体的平均相对分子质量不再变化
D.SO2的消耗速率与H2的消耗速率之比为1∶2
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
Ⅰ.脱硝:
已知:H2的燃烧热为285.8 kJ·mol-1
N2(g)+2O2(g)=2NO2(g) △H=+133kJ·mol-1
H2O(g)=H2O(l) △H=-44kJ·mol-1
催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质的热化学方程式为________ 。
Ⅱ.脱碳:向2 L密闭容器中加入2 mol CO2、6 mol H2,在适当的催化剂作用下,发生反应:CO2(g)+3H2(g)⇌ CH3OH(l)+H2O(l)
(1)该反应自发进行的条件是_________ (填“低温”、“高温”或“任意温度”)
(2)下列叙述能说明此反应达到平衡状态的是________ 。
a、混合气体的平均相对分子质量保持不变
b、CO2和 H2的体积分数保持不变
c、CO2和 H2的转化率相等
d、混合气体的密度保持不变
e、1 mol CO2生成的同时有 3 mol H—H 键断裂
(3)产物甲醇可以用作燃料电池,该电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解液中直接加入纯化后的甲醇,同时向一个电极通入空气。负极发生的电极反应式是________ 。
(4)资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品。在一定条件下,二氧化碳转化为甲烷的反应如下:CO2(g)+4H2(g)⇌CH4(g)+2H2O(g)。向一容积为2 L的恒容密闭容器中充入一定量的CO2和H2,300℃时发生上述反应,达到平衡时各物质的浓度分别为:CO2:0.2 mol·L-1,H2:0.8 mol·L-1,CH4:0.8 mol·L-1,H2O:1.6 mol·L-1。则:
①CO2的平衡转化率为________ 。300℃时上述反应的平衡常数 K=___________ 。
②200℃时该反应的平衡常数 K=64.8,则该反应的ΔH_____ 0(填“>”或“<”)。
Ⅰ.脱硝:
已知:H2的燃烧热为285.8 kJ·mol-1
N2(g)+2O2(g)=2NO2(g) △H=+133kJ·mol-1
H2O(g)=H2O(l) △H=-44kJ·mol-1
催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质的热化学方程式为
Ⅱ.脱碳:向2 L密闭容器中加入2 mol CO2、6 mol H2,在适当的催化剂作用下,发生反应:CO2(g)+3H2(g)⇌ CH3OH(l)+H2O(l)
(1)该反应自发进行的条件是
(2)下列叙述能说明此反应达到平衡状态的是
a、混合气体的平均相对分子质量保持不变
b、CO2和 H2的体积分数保持不变
c、CO2和 H2的转化率相等
d、混合气体的密度保持不变
e、1 mol CO2生成的同时有 3 mol H—H 键断裂
(3)产物甲醇可以用作燃料电池,该电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解液中直接加入纯化后的甲醇,同时向一个电极通入空气。负极发生的电极反应式是
(4)资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品。在一定条件下,二氧化碳转化为甲烷的反应如下:CO2(g)+4H2(g)⇌CH4(g)+2H2O(g)。向一容积为2 L的恒容密闭容器中充入一定量的CO2和H2,300℃时发生上述反应,达到平衡时各物质的浓度分别为:CO2:0.2 mol·L-1,H2:0.8 mol·L-1,CH4:0.8 mol·L-1,H2O:1.6 mol·L-1。则:
①CO2的平衡转化率为
②200℃时该反应的平衡常数 K=64.8,则该反应的ΔH
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】以CO、 为原料进行资源化利用,对于环境、能源均具有重要意义。已知存在如下反应:
为原料进行资源化利用,对于环境、能源均具有重要意义。已知存在如下反应:
Ⅰ.

Ⅱ.

Ⅲ.

Ⅳ.

回答下列问题:
(1)已知某反应的平衡常数表达式为 ,则该反应的热化学方程式为
,则该反应的热化学方程式为__________ 。
(2)向一容积为2L的恒容密闭容器中通入1mol 和3mol
和3mol ,一定温度下发生反应Ⅰ.起始总压为pPa,20min时达到化学平衡状态,测得
,一定温度下发生反应Ⅰ.起始总压为pPa,20min时达到化学平衡状态,测得 的物质的量分数为12.5%。
的物质的量分数为12.5%。
①平衡时总压为________ Pa。
②0~20min内,用 表示的平均反应速率
表示的平均反应速率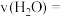
________  ,
, 的平衡浓度
的平衡浓度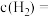
________ 
(3)在一定条件下发生反应Ⅰ、Ⅲ( 过量),若反应Ⅰ中
过量),若反应Ⅰ中 的转化率为90%,Ⅲ中
的转化率为90%,Ⅲ中 的转化率为40%,则
的转化率为40%,则 的产率为
的产率为________ .
(4)工业上,以一定比例混合的 与
与 的混合气体以一定流速分别通过填充有催化剂a、催化剂b的反应器,发生反应Ⅰ.
的混合气体以一定流速分别通过填充有催化剂a、催化剂b的反应器,发生反应Ⅰ. 转化率与温度的关系如图1所示.在催化剂b作用下,温度高于
转化率与温度的关系如图1所示.在催化剂b作用下,温度高于 时,
时, 转化率下降的原因可能是
转化率下降的原因可能是__________ 。 分别为1mol、2mol时,发生反应Ⅳ,平衡后混合物中
分别为1mol、2mol时,发生反应Ⅳ,平衡后混合物中 的体积分数(
的体积分数( )如图2所示。
)如图2所示。 、
、 和
和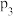 由大到小的顺序是
由大到小的顺序是________ 。
②若在250℃、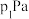 的条件下,反应达到平衡,则该反应的平衡常数
的条件下,反应达到平衡,则该反应的平衡常数
________ 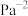 (分压
(分压 总压
总压 物质的量分数)。
物质的量分数)。
 为原料进行资源化利用,对于环境、能源均具有重要意义。已知存在如下反应:
为原料进行资源化利用,对于环境、能源均具有重要意义。已知存在如下反应:Ⅰ.


Ⅱ.


Ⅲ.


Ⅳ.


回答下列问题:
(1)已知某反应的平衡常数表达式为
 ,则该反应的热化学方程式为
,则该反应的热化学方程式为(2)向一容积为2L的恒容密闭容器中通入1mol
 和3mol
和3mol ,一定温度下发生反应Ⅰ.起始总压为pPa,20min时达到化学平衡状态,测得
,一定温度下发生反应Ⅰ.起始总压为pPa,20min时达到化学平衡状态,测得 的物质的量分数为12.5%。
的物质的量分数为12.5%。①平衡时总压为
②0~20min内,用
 表示的平均反应速率
表示的平均反应速率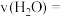
 ,
, 的平衡浓度
的平衡浓度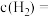

(3)在一定条件下发生反应Ⅰ、Ⅲ(
 过量),若反应Ⅰ中
过量),若反应Ⅰ中 的转化率为90%,Ⅲ中
的转化率为90%,Ⅲ中 的转化率为40%,则
的转化率为40%,则 的产率为
的产率为(4)工业上,以一定比例混合的
 与
与 的混合气体以一定流速分别通过填充有催化剂a、催化剂b的反应器,发生反应Ⅰ.
的混合气体以一定流速分别通过填充有催化剂a、催化剂b的反应器,发生反应Ⅰ. 转化率与温度的关系如图1所示.在催化剂b作用下,温度高于
转化率与温度的关系如图1所示.在催化剂b作用下,温度高于 时,
时, 转化率下降的原因可能是
转化率下降的原因可能是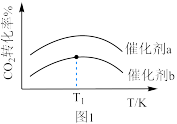
 分别为1mol、2mol时,发生反应Ⅳ,平衡后混合物中
分别为1mol、2mol时,发生反应Ⅳ,平衡后混合物中 的体积分数(
的体积分数( )如图2所示。
)如图2所示。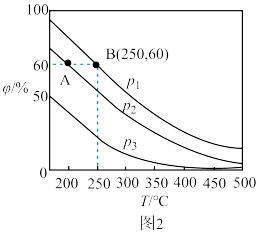
 、
、 和
和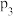 由大到小的顺序是
由大到小的顺序是②若在250℃、
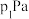 的条件下,反应达到平衡,则该反应的平衡常数
的条件下,反应达到平衡,则该反应的平衡常数
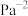 (分压
(分压 总压
总压 物质的量分数)。
物质的量分数)。
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐2】氨是化肥工业和基本有机化工的主要原料。回答下列问题,
(1)查阅资料可知,H—H、N≡N、N-H的键能分别为436 、946
、946 、389
、389 ,则
,则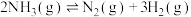 的焓变△H=
的焓变△H=______ ,该反应活化能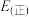
______ (填“>”或“<”)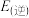 。
。
(2)已知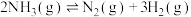 分解反应的速率方程为
分解反应的速率方程为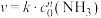 (k为速率常数,只与温度、催化剂有关)。某温度下的实验数据如表所示:
(k为速率常数,只与温度、催化剂有关)。某温度下的实验数据如表所示:
速率方程中n=______________ ;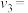
______________ 。
(3)恒压密闭容器中,充入一定量的 和
和 ,在不同催化剂(Ⅰ,Ⅱ,Ⅲ)作用下发生反应
,在不同催化剂(Ⅰ,Ⅱ,Ⅲ)作用下发生反应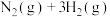
 ,测得相同反应时间内,
,测得相同反应时间内, 的体积分数随温度变化如图所示:
的体积分数随温度变化如图所示: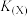
_________ (填“>”或“<”,下同)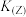 。
。
②240℃时,催化效果最好的催化剂为_______ (填“Ⅰ”“Ⅱ”或“Ⅲ”);T>300℃,曲线重合的原因是________________ 。
(4)恒温、恒容条件下, 和
和 按照物质的量之比1∶1充入容器,下列能说明密闭容器中反应已达平衡状态的是 (填字母)。
按照物质的量之比1∶1充入容器,下列能说明密闭容器中反应已达平衡状态的是 (填字母)。
(5)合成氨的常用催化剂是铁触媒,已知铁为面心立方晶体,其晶胞结构如图所示,若铁原子的半径为a pm,则铁晶体中最近的两个铁原子间的距离(核间距)为____ pm;铁晶体的密度为________  (
( 表示阿伏加德罗常数的值,写出计算表达式)。
表示阿伏加德罗常数的值,写出计算表达式)。
(1)查阅资料可知,H—H、N≡N、N-H的键能分别为436
 、946
、946 、389
、389 ,则
,则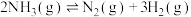 的焓变△H=
的焓变△H=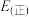
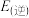 。
。(2)已知
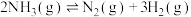 分解反应的速率方程为
分解反应的速率方程为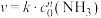 (k为速率常数,只与温度、催化剂有关)。某温度下的实验数据如表所示:
(k为速率常数,只与温度、催化剂有关)。某温度下的实验数据如表所示:组别 |
| 速率常数k |
|
1 | 0.04 | k |
|
2 | 0.16 | k |
|
3 | 0.36 | k |
|
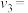
(3)恒压密闭容器中,充入一定量的
 和
和 ,在不同催化剂(Ⅰ,Ⅱ,Ⅲ)作用下发生反应
,在不同催化剂(Ⅰ,Ⅱ,Ⅲ)作用下发生反应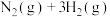
 ,测得相同反应时间内,
,测得相同反应时间内, 的体积分数随温度变化如图所示:
的体积分数随温度变化如图所示: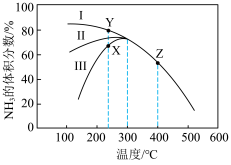
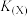
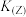 。
。②240℃时,催化效果最好的催化剂为
(4)恒温、恒容条件下,
 和
和 按照物质的量之比1∶1充入容器,下列能说明密闭容器中反应已达平衡状态的是 (填字母)。
按照物质的量之比1∶1充入容器,下列能说明密闭容器中反应已达平衡状态的是 (填字母)。| A.容器内压强不再发生改变 | B.容器内混合气体的平均摩尔质量不变 |
| C.容器内气体密度不再发生改变 | D. 的体积分数保持不变 的体积分数保持不变 |
(5)合成氨的常用催化剂是铁触媒,已知铁为面心立方晶体,其晶胞结构如图所示,若铁原子的半径为a pm,则铁晶体中最近的两个铁原子间的距离(核间距)为
 (
( 表示阿伏加德罗常数的值,写出计算表达式)。
表示阿伏加德罗常数的值,写出计算表达式)。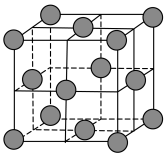
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】近年来甲醇用途日益广泛,越来越引起商家的关注,工业上甲醇的合成途径多种多样。现有实验室中模拟甲醇合成反应,在2L密闭容器内,400℃时反应:CO(g)+2H2(g) CH3OH(g) △H<0,体系中n(CO)随时间的变化如表:
CH3OH(g) △H<0,体系中n(CO)随时间的变化如表:
(1)图中表示CH3OH的变化的曲线是____ 。
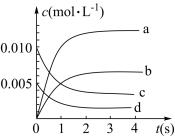
(2)用H2表示从0~2s内该反应的平均速率v(H2)=____ 。
(3)能说明该反应已达到平衡状态的是___ 。
a.反应中CO与CH3OH的物质的量之比为1:1
b.容器内压强保持不变
c.2v逆(CO)=v正(H2)
d.单位时间内每消耗1molCO,同时生成1molCH3OH
(4)CH3OH与O2的反应可将化学能转化为电能,工作原理如图所示,则CH3OH应从____ (填A或B)通入,K+移向____ (填a、b极),当电路中累计有2mol电子通过时,消耗的氧气体积为(在标准状况下)____ L。
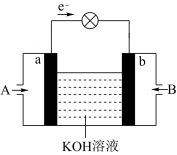
(5)通CH3OH的一极的电极反应式为____ 。
 CH3OH(g) △H<0,体系中n(CO)随时间的变化如表:
CH3OH(g) △H<0,体系中n(CO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 5 |
| n(CO)(mol) | 0.020 | 0.011 | 0.008 | 0.007 | 0.007 |
(1)图中表示CH3OH的变化的曲线是

(2)用H2表示从0~2s内该反应的平均速率v(H2)=
(3)能说明该反应已达到平衡状态的是
a.反应中CO与CH3OH的物质的量之比为1:1
b.容器内压强保持不变
c.2v逆(CO)=v正(H2)
d.单位时间内每消耗1molCO,同时生成1molCH3OH
(4)CH3OH与O2的反应可将化学能转化为电能,工作原理如图所示,则CH3OH应从

(5)通CH3OH的一极的电极反应式为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐1】从古至今,铁及其化合物在人类生产生活中的作用发生了巨大变化。
(1)古代中国四大发明之一的司南是由天然磁石制成的,其主要成分是______ (填字母序号)。
a. Fe b. FeO c. Fe3O4 d. Fe2O3
(2)现代利用铁的氧化物循环裂解水制氢气的过程如下图所示。 整个过程与温度密切相关, 当温度低于 570℃时,反应Fe3O4(s)+4 CO(g) 3Fe(s)+4CO2(g),阻碍循环反应的进行。
3Fe(s)+4CO2(g),阻碍循环反应的进行。
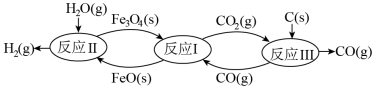
①已知:Fe3O4(s) + CO(g) 3FeO(s) +CO2(g) ΔH1 = +19.3 kJ·mol-1
3FeO(s) +CO2(g) ΔH1 = +19.3 kJ·mol-1
3FeO(s) + H2O(g) Fe3O4(s) + H2(g) ΔH2 =-57.2 kJ·mol-1
Fe3O4(s) + H2(g) ΔH2 =-57.2 kJ·mol-1
C(s)+CO2 2CO(g) ΔH3 =+172.4 kJ·mol-1 。
2CO(g) ΔH3 =+172.4 kJ·mol-1 。
铁氧化物循环裂解水制氢气总反应的热化学方程式是_________ 。
②下图表示其他条件一定时,Fe3O4(s)和CO(g)反应达平衡时 CO(g)的体积百分含量随温度的变化关系。
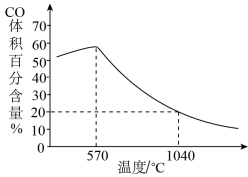
i. 当温度低于570℃时,温度降低CO的转化率____ (填“增大”、“减小”或“不变”),理由是______ 。
ii. 当温度高于570℃时,随温度升高,反应 Fe3O4(s) + CO(g) 3FeO(s) + CO2(g)平衡常数的变化趋势是
3FeO(s) + CO2(g)平衡常数的变化趋势是________ ;(填“增大”、“减小”或“不变”)1040℃时,该反应的化学平衡常数的数值是________ 。
(3)①古老而神奇的蓝色染料普鲁士蓝的合成方法如下:

复分解反应 ii 的离子方程式是_______________ 。
②如今基于普鲁士蓝合成原理可检测食品中 CN-,方案如下:
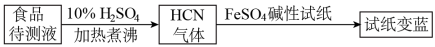
若试纸变蓝则证明食品中含有 CN-,请解释检测时试纸变蓝的原因_________ 。
(4)已知25℃时,Ksp[Fe(OH)3]=4.0×10-38,此温度下若在实验室中配置100mL 5mol/LFeCl3溶液,为使配置过程中不出现浑浊现象,则至少需要加入2mol/L的盐酸_________ mL(忽略加入盐酸体积)。
(1)古代中国四大发明之一的司南是由天然磁石制成的,其主要成分是
a. Fe b. FeO c. Fe3O4 d. Fe2O3
(2)现代利用铁的氧化物循环裂解水制氢气的过程如下图所示。 整个过程与温度密切相关, 当温度低于 570℃时,反应Fe3O4(s)+4 CO(g)
 3Fe(s)+4CO2(g),阻碍循环反应的进行。
3Fe(s)+4CO2(g),阻碍循环反应的进行。
①已知:Fe3O4(s) + CO(g)
 3FeO(s) +CO2(g) ΔH1 = +19.3 kJ·mol-1
3FeO(s) +CO2(g) ΔH1 = +19.3 kJ·mol-13FeO(s) + H2O(g)
 Fe3O4(s) + H2(g) ΔH2 =-57.2 kJ·mol-1
Fe3O4(s) + H2(g) ΔH2 =-57.2 kJ·mol-1C(s)+CO2
 2CO(g) ΔH3 =+172.4 kJ·mol-1 。
2CO(g) ΔH3 =+172.4 kJ·mol-1 。铁氧化物循环裂解水制氢气总反应的热化学方程式是
②下图表示其他条件一定时,Fe3O4(s)和CO(g)反应达平衡时 CO(g)的体积百分含量随温度的变化关系。

i. 当温度低于570℃时,温度降低CO的转化率
ii. 当温度高于570℃时,随温度升高,反应 Fe3O4(s) + CO(g)
 3FeO(s) + CO2(g)平衡常数的变化趋势是
3FeO(s) + CO2(g)平衡常数的变化趋势是(3)①古老而神奇的蓝色染料普鲁士蓝的合成方法如下:

复分解反应 ii 的离子方程式是
②如今基于普鲁士蓝合成原理可检测食品中 CN-,方案如下:

若试纸变蓝则证明食品中含有 CN-,请解释检测时试纸变蓝的原因
(4)已知25℃时,Ksp[Fe(OH)3]=4.0×10-38,此温度下若在实验室中配置100mL 5mol/LFeCl3溶液,为使配置过程中不出现浑浊现象,则至少需要加入2mol/L的盐酸
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
【推荐2】钼酸锂(Li2MoO4)的外观为白色结晶粉末,易溶于水,难溶于有机溶剂,用于电极材料、金属陶瓷的制作。工业上以某精选钼矿(主要含MoS2,还含有少量CuFeS2)为原料制备Li2MoO4,其工艺流程如图:

回答下列问题:
(1)“滤液1”含有的离子主要有Fe2+、Cu2+、SO 、C1-,“酸浸、氧化”过程中,CuFeS2与FeCl3溶液反应的离子方程式为
、C1-,“酸浸、氧化”过程中,CuFeS2与FeCl3溶液反应的离子方程式为_______ 。
(2)写出“氧化、灼烧”时反应的化学方程式:_______ 。
(3)MoO3属于_______ 氧化物(填“酸性”“碱性”“两性”)。
(4)“酸化沉钼”过程中,溶液pH和反应时间对钼酸的析出有很大影响,根据图中数据判断最佳的“酸化沉钼”条件:pH为_______ 、反应时间_______ ;滤液2中含有的主要溶质的用途是_______ .(填一种即可)。

(5)H2MoO4和Li2CO3在熔融状态下反应也可生成Li2MoO4,写出反应的化学方程式_______ 。在实验中该熔融操作可以在_______ (填标号)中进行。
A.陶瓷坩埚 B.石英坩埚 C.铁坩埚
(6)将“滤液1”用酸性H2O2氧化,得到含c(Fe3+)=0.01mol/L、c(Cu2+)=0.22mol/L的混合溶液。若调节pH使溶液中Fe3+浓度不超过5.0×10-6mol/L,而Cu2+全部留在母液中,则该溶液的pH范围为_______ {已知Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cu(OH)2]=2.2×10-20、1g2=0.3}。

回答下列问题:
(1)“滤液1”含有的离子主要有Fe2+、Cu2+、SO
 、C1-,“酸浸、氧化”过程中,CuFeS2与FeCl3溶液反应的离子方程式为
、C1-,“酸浸、氧化”过程中,CuFeS2与FeCl3溶液反应的离子方程式为(2)写出“氧化、灼烧”时反应的化学方程式:
(3)MoO3属于
(4)“酸化沉钼”过程中,溶液pH和反应时间对钼酸的析出有很大影响,根据图中数据判断最佳的“酸化沉钼”条件:pH为

(5)H2MoO4和Li2CO3在熔融状态下反应也可生成Li2MoO4,写出反应的化学方程式
A.陶瓷坩埚 B.石英坩埚 C.铁坩埚
(6)将“滤液1”用酸性H2O2氧化,得到含c(Fe3+)=0.01mol/L、c(Cu2+)=0.22mol/L的混合溶液。若调节pH使溶液中Fe3+浓度不超过5.0×10-6mol/L,而Cu2+全部留在母液中,则该溶液的pH范围为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐3】高纯六水氯化锶晶体(SrCl2·6H2O)可作有机合成的催化剂。工业上用难溶于水的碳酸锶(SrCO3)粉末为原料(含少量BaCO3、FeO、 SiO2等杂质)制备高纯六水氯化锶晶体(SrCl2·6H2O),其过程如图所示。

已知:
I.25℃,Ksp[Fe(OH)3]=1.0×10-38,Ksp[Fe(OH)2]=1.0×10-16
II.SrCl2·6H2O 晶体在61 ℃时开始失去结晶水。
请回答:
(1)天青石(主要成分SrSO4)经过多步反应后可制得工业碳酸锶。其中第一步是与过量焦炭隔绝空气微波加热还原为硫化锶,该过程的化学方程式为___________ 。
(2)步骤①中将工业碳酸锶粉碎制成浆液能加快反应速率的原因是___________ 。
(3)在“浆液”中加入工业盐酸,测得锶的浸出率与温度、时间的关系如图所示:

据此合适的工业生产条件为___________ 。
(4)步骤③所得滤渣的主要成分除Fe(OH)3外,还有___________ (填化学式); 25℃,为使Fe3+沉淀完全需调节溶液pH值最小为___________ (当离子浓度减小至1.0×10-5mol/L时,可认为沉淀完全)。
(5)关于上述流程中各步骤的说法,正确的是___________ (填标号)。
A.步骤④用60℃的热水浴加热蒸发至有晶膜出现
B.步骤④冷却结晶过程中应通入HCl气体
C.步骤⑤干燥SrCl2·6H2O晶体可以采用减压干燥
(6)若需进一步获得无水氯化锶,必须对SrCl2·6H2O(M=267g·mol-1)进行脱水。脱水过程采用烘干法在170℃下预脱水,失重达33.7%,此时获得的产物化学式为___________ 。

已知:
I.25℃,Ksp[Fe(OH)3]=1.0×10-38,Ksp[Fe(OH)2]=1.0×10-16
II.SrCl2·6H2O 晶体在61 ℃时开始失去结晶水。
请回答:
(1)天青石(主要成分SrSO4)经过多步反应后可制得工业碳酸锶。其中第一步是与过量焦炭隔绝空气微波加热还原为硫化锶,该过程的化学方程式为
(2)步骤①中将工业碳酸锶粉碎制成浆液能加快反应速率的原因是
(3)在“浆液”中加入工业盐酸,测得锶的浸出率与温度、时间的关系如图所示:

据此合适的工业生产条件为
(4)步骤③所得滤渣的主要成分除Fe(OH)3外,还有
(5)关于上述流程中各步骤的说法,正确的是
A.步骤④用60℃的热水浴加热蒸发至有晶膜出现
B.步骤④冷却结晶过程中应通入HCl气体
C.步骤⑤干燥SrCl2·6H2O晶体可以采用减压干燥
(6)若需进一步获得无水氯化锶,必须对SrCl2·6H2O(M=267g·mol-1)进行脱水。脱水过程采用烘干法在170℃下预脱水,失重达33.7%,此时获得的产物化学式为
您最近一年使用:0次
【推荐1】黄铁矿[主要成分为二硫化亚铁(FeS2)]、焦炭和适量空气混合加热发生如下反应:
i.3FeS2+2C+3O2=3S2+Fe3O4+2CO
(1)反应i生成1molS2时,转移电子的物质的量为___________ mol。
(2)反应i所得气体经冷凝回收S2后,尾气中还含有CO和SO2。将尾气通过催化剂进行处理,发生反应ii,同时发生副反应iii。
ii.2SO2(g)+4CO(g) S2(g)+4CO2(g) ΔH<0
S2(g)+4CO2(g) ΔH<0
iii.SO2(g)+3CO(g) COS(g)+2CO2(g) ΔH<0
COS(g)+2CO2(g) ΔH<0
理论分析及实验结果表明,600~1000K范围内,SO2平衡转化率接近100%。其他条件相同,不同温度下,S2、COS平衡产率和10min时S2实际产率如图。___________ 。
②随温度升高,S2平衡产率上升,推测其原因是___________ 。
③900K,在10min后继续反应足够长时间,推测S2实际产率的变化趋势可能为___________ 。
(3)处理后的尾气仍含少量SO2,经Na2CO3溶液洗脱处理后,所得洗脱液主要成分为Na2CO3、NaHCO3和Na2SO3.利用生物电池技术,可将洗脱液中的Na2SO3转化为单质硫(以S表示)回收。___________ 。
②一段时间后,若洗脱液中 的物质的量减小了1mol,则理论上
的物质的量减小了1mol,则理论上 减小了
减小了___________ mol。
(4)常温向 溶液中加入适量的NaOH,溶液中
溶液中加入适量的NaOH,溶液中 、
、 、
、 的分布系数
的分布系数 随pOH的变化如图。
随pOH的变化如图。___________ 。
A.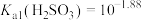
B.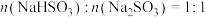 时,溶液显酸性
时,溶液显酸性
C.N点对应的溶液,对水的电离起到抑制作用
i.3FeS2+2C+3O2=3S2+Fe3O4+2CO
(1)反应i生成1molS2时,转移电子的物质的量为
(2)反应i所得气体经冷凝回收S2后,尾气中还含有CO和SO2。将尾气通过催化剂进行处理,发生反应ii,同时发生副反应iii。
ii.2SO2(g)+4CO(g)
 S2(g)+4CO2(g) ΔH<0
S2(g)+4CO2(g) ΔH<0iii.SO2(g)+3CO(g)
 COS(g)+2CO2(g) ΔH<0
COS(g)+2CO2(g) ΔH<0理论分析及实验结果表明,600~1000K范围内,SO2平衡转化率接近100%。其他条件相同,不同温度下,S2、COS平衡产率和10min时S2实际产率如图。

②随温度升高,S2平衡产率上升,推测其原因是
③900K,在10min后继续反应足够长时间,推测S2实际产率的变化趋势可能为
(3)处理后的尾气仍含少量SO2,经Na2CO3溶液洗脱处理后,所得洗脱液主要成分为Na2CO3、NaHCO3和Na2SO3.利用生物电池技术,可将洗脱液中的Na2SO3转化为单质硫(以S表示)回收。

②一段时间后,若洗脱液中
 的物质的量减小了1mol,则理论上
的物质的量减小了1mol,则理论上 减小了
减小了(4)常温向
 溶液中加入适量的NaOH,溶液中
溶液中加入适量的NaOH,溶液中 、
、 、
、 的分布系数
的分布系数 随pOH的变化如图。
随pOH的变化如图。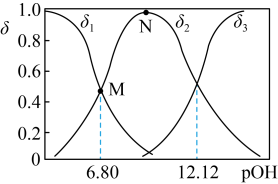
A.
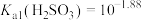
B.
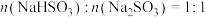 时,溶液显酸性
时,溶液显酸性C.N点对应的溶液,对水的电离起到抑制作用
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】 催化加氢制甲醇(
催化加氢制甲醇( )是实现碳达峰、碳中和的途径之一,其反应可表示为
)是实现碳达峰、碳中和的途径之一,其反应可表示为
 。
。
(1)该反应分两步进行,反应过程能量变化如图所示,所有物质均为气态。
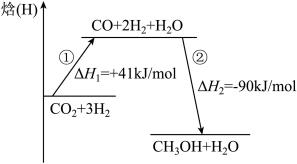
总反应
___________ 。第①步反应的热化学方程式为___________ 。
(2)用 和
和 合成甲醇有利于减少碳排放,其反应原理为
合成甲醇有利于减少碳排放,其反应原理为 。向甲、乙两个体积都为2.0L的恒容密闭容器中均充入
。向甲、乙两个体积都为2.0L的恒容密闭容器中均充入 和
和 的混合气体,分别在
的混合气体,分别在 、
、 温度下进行反应并达到平衡,反应过程中甲、乙两容器中
温度下进行反应并达到平衡,反应过程中甲、乙两容器中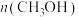 随时间的变化情况如下表:
随时间的变化情况如下表:
①两容器的温度
___________  。
。
②甲容器中,0~6min内用 表示的平均反应速率为
表示的平均反应速率为___________ 。
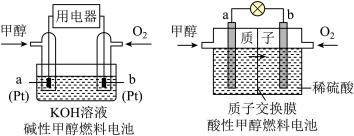
③甲容器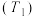 中反应达平衡时容器内气体压强与起始时容器内气体压强之比为
中反应达平衡时容器内气体压强与起始时容器内气体压强之比为___________ 。
④一定温度下,在一体积固定的密闭容器中投入一定量的 和
和 进行上述反应。下列叙述中能说明上述反应达到平衡状态的是
进行上述反应。下列叙述中能说明上述反应达到平衡状态的是___________ 。
A.反应中 与
与 的物质的量之比为
的物质的量之比为
B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗 ,同时生成
,同时生成
D. 的质量分数在混合气体中保持不变
的质量分数在混合气体中保持不变
E.混合气体的密度保持不变
(3)捕碳 技术在降低温室气体排放中具有重要的作用。目前
技术在降低温室气体排放中具有重要的作用。目前 和
和 已经被用作工业捕碳剂,它们与
已经被用作工业捕碳剂,它们与 可发生如下可逆反应:
可发生如下可逆反应:
反应Ⅰ:

反应Ⅱ:

反应Ⅲ:

则 与
与 、
、 之间的关系是:
之间的关系是:
___________ 。
(4)甲醇燃料电池具有很多优点。
①碱性甲醇燃料电池中,电极a上发生的电极反应式为___________ 。
②酸性甲醇燃料电池中,电极b上发生的电极反应式为___________ 。
 催化加氢制甲醇(
催化加氢制甲醇( )是实现碳达峰、碳中和的途径之一,其反应可表示为
)是实现碳达峰、碳中和的途径之一,其反应可表示为
 。
。(1)该反应分两步进行,反应过程能量变化如图所示,所有物质均为气态。

总反应

(2)用
 和
和 合成甲醇有利于减少碳排放,其反应原理为
合成甲醇有利于减少碳排放,其反应原理为 。向甲、乙两个体积都为2.0L的恒容密闭容器中均充入
。向甲、乙两个体积都为2.0L的恒容密闭容器中均充入 和
和 的混合气体,分别在
的混合气体,分别在 、
、 温度下进行反应并达到平衡,反应过程中甲、乙两容器中
温度下进行反应并达到平衡,反应过程中甲、乙两容器中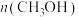 随时间的变化情况如下表:
随时间的变化情况如下表: | 0 | 3 | 6 | 12 | 24 | 36 |
甲容器 | 0 | 0.36 | 0.60 | 0.80 | 0.80 | 0.80 |
乙容器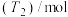 | 0 | 0.34 | 0.55 | 0.70 | 0.83 | 0.83 |

 。
。②甲容器中,0~6min内用
 表示的平均反应速率为
表示的平均反应速率为③甲容器
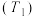 中反应达平衡时容器内气体压强与起始时容器内气体压强之比为
中反应达平衡时容器内气体压强与起始时容器内气体压强之比为④一定温度下,在一体积固定的密闭容器中投入一定量的
 和
和 进行上述反应。下列叙述中能说明上述反应达到平衡状态的是
进行上述反应。下列叙述中能说明上述反应达到平衡状态的是A.反应中
 与
与 的物质的量之比为
的物质的量之比为
B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗
 ,同时生成
,同时生成
D.
 的质量分数在混合气体中保持不变
的质量分数在混合气体中保持不变E.混合气体的密度保持不变
(3)捕碳
 技术在降低温室气体排放中具有重要的作用。目前
技术在降低温室气体排放中具有重要的作用。目前 和
和 已经被用作工业捕碳剂,它们与
已经被用作工业捕碳剂,它们与 可发生如下可逆反应:
可发生如下可逆反应:反应Ⅰ:


反应Ⅱ:


反应Ⅲ:


则
 与
与 、
、 之间的关系是:
之间的关系是:
(4)甲醇燃料电池具有很多优点。

①碱性甲醇燃料电池中,电极a上发生的电极反应式为
②酸性甲醇燃料电池中,电极b上发生的电极反应式为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐3】以菱铁矿(主要成分是碳酸亚铁 )为原料制取铁的流程如图:
)为原料制取铁的流程如图:
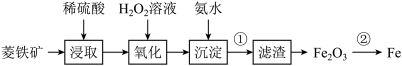
(1)“浸取”时通常将菱铁矿石进行粉碎,其目的_______ ;
(2)“氧化”时发生反应的离子方程式:_______ ;
(3)“沉淀”时发生反应的离子方程式:_______ ;
(4)现有如下两个反应:①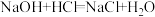 ②
②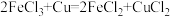 。根据两反应本质,判断能设计成原电池的反应是
。根据两反应本质,判断能设计成原电池的反应是_______ (填序号)。该电池的正极材料是_______ 。
(5)锌锰干电池是最早使用的化学电池,其基本构造如图1所示:电路中每通过 ,负极质量减少
,负极质量减少_______ g;工作时 在正极放电产生两种气体,其中一种气体分子是
在正极放电产生两种气体,其中一种气体分子是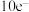 的微粒,正极的电极反应式是
的微粒,正极的电极反应式是_______ 。
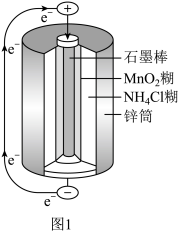
(6)图2为氢氧燃料电池原理示意图。该燃料电池正极的电极反应式_______ 。若导线中通过 个电子,负极消耗气体的体积为
个电子,负极消耗气体的体积为_______ (标况下)。
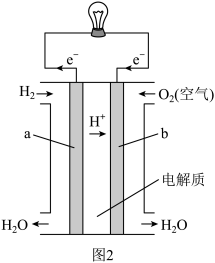
(7)直接乙醇燃料电池( )具有很多优点。现有以下三种乙醇燃料电池。
)具有很多优点。现有以下三种乙醇燃料电池。
①碱性乙醇燃料电池中,电极a上发生的电极反应式为_______ 。
②酸性乙醇燃料电池中,电极a上发生的电极反应式为_______ 。
③熔融碳酸盐乙醇燃料电池中,电极b上发生的电极反应式为_______ 。
 )为原料制取铁的流程如图:
)为原料制取铁的流程如图:
(1)“浸取”时通常将菱铁矿石进行粉碎,其目的
(2)“氧化”时发生反应的离子方程式:
(3)“沉淀”时发生反应的离子方程式:
(4)现有如下两个反应:①
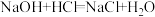 ②
②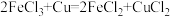 。根据两反应本质,判断能设计成原电池的反应是
。根据两反应本质,判断能设计成原电池的反应是(5)锌锰干电池是最早使用的化学电池,其基本构造如图1所示:电路中每通过
 ,负极质量减少
,负极质量减少 在正极放电产生两种气体,其中一种气体分子是
在正极放电产生两种气体,其中一种气体分子是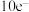 的微粒,正极的电极反应式是
的微粒,正极的电极反应式是
(6)图2为氢氧燃料电池原理示意图。该燃料电池正极的电极反应式
 个电子,负极消耗气体的体积为
个电子,负极消耗气体的体积为
(7)直接乙醇燃料电池(
 )具有很多优点。现有以下三种乙醇燃料电池。
)具有很多优点。现有以下三种乙醇燃料电池。
①碱性乙醇燃料电池中,电极a上发生的电极反应式为
②酸性乙醇燃料电池中,电极a上发生的电极反应式为
③熔融碳酸盐乙醇燃料电池中,电极b上发生的电极反应式为
您最近一年使用:0次