向一个体积可变的密闭器中充入4molA、1molB,发生如下反应:
4A(g)+B(s) 3C(s)+4D(g)。在高温下达到平衡,测得混合气体中D的浓度为0.3mol·L-1。
3C(s)+4D(g)。在高温下达到平衡,测得混合气体中D的浓度为0.3mol·L-1。
请填写下列空白:
(1)若容器体积为10L,反应经2min达平衡,则以A物质浓度变化表示的化学反应率为
。
(2)若压缩容器增大压强,则逆反应的速率 ,容器中D的体积分数 。(填“增大”“减小”“不变”)
(3)若相对分子质量M(B)>3M(C),温度升高时混合气体的平均相对分子质量减少,则正反应 。(填“吸热”或“放热”)
(4)在最初的容器改充1.5molC、4.4molD温度保持不变,要使反应达平衡时D的浓度为0.6mol·L-1,则容器的体积是 L。
4A(g)+B(s)
 3C(s)+4D(g)。在高温下达到平衡,测得混合气体中D的浓度为0.3mol·L-1。
3C(s)+4D(g)。在高温下达到平衡,测得混合气体中D的浓度为0.3mol·L-1。请填写下列空白:
(1)若容器体积为10L,反应经2min达平衡,则以A物质浓度变化表示的化学反应率为
。
(2)若压缩容器增大压强,则逆反应的速率 ,容器中D的体积分数 。(填“增大”“减小”“不变”)
(3)若相对分子质量M(B)>3M(C),温度升高时混合气体的平均相对分子质量减少,则正反应 。(填“吸热”或“放热”)
(4)在最初的容器改充1.5molC、4.4molD温度保持不变,要使反应达平衡时D的浓度为0.6mol·L-1,则容器的体积是 L。
9-10高二下·四川眉山·期末 查看更多[1]
(已下线)2010年四川省眉山中学高二下学期期末教学质量检测(理综)化学部分
更新时间:2016-12-09 00:43:16
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】甲醇是一种重要的化工原料,在生产中有着重要的应用。工业上用天然气为原料,分为两阶段制备甲醇:
(i)制备合成气:CH4(g)+H2O(g) CO(g)+3H2(g) △H1=+206.0kJ/mol
CO(g)+3H2(g) △H1=+206.0kJ/mol
(ii)合成甲醇:CO(g)+2H2(g) CH3OH(g) △H2
CH3OH(g) △H2
请回答下列问题:
(1)制备合成气:将1.0mol CH4和2.0mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应(i);CH4的平衡转化率与温度、压强的关系如图所示。
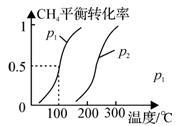
①已知100℃时达到平衡的时间为5min,则从反应开始到平衡,用氢气表示的平均反应速率为:v(H2) =___ 。
②图中p1___ p2(填“<”、”“>”或“=”)。
③为解决合成气中H2过量而CO不足的问题,原料气中需添加CO2,发生反应如下:
CO2(g)+H2(g) CO(g)+H2O(g),为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为
CO(g)+H2O(g),为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为___ 。
(2)合成甲醇:在Cu2O/ZnO作催化剂的条件下,向2L的密闭容器中通入1mol CO(g)和2mol H2(g),发生反应(ii),反应过程中,CH3OH的物质的量(n)与时间(t)及温度的关系如图所示。
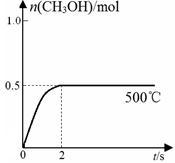
①应(ii)需在____ (填“高温”或“低温”)才能自发进行。
②据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量的CO2 有利于维持Cu2O的量不变,
原因是____ (用化学方程式表示)。
③在500℃恒压条件下,请在______ 上图中画出反应体系中n(CH3OH)随时间t变化的总趋势图。
(3)工业上可通过甲醇羰基化法制取甲酸甲酯,其反应的热化学方程式为:
CH3OH(g)+CO(g) HCOOCH3(g)
HCOOCH3(g)  ,科研人员对该反应进行了研究,部分研究结果如下:
,科研人员对该反应进行了研究,部分研究结果如下:
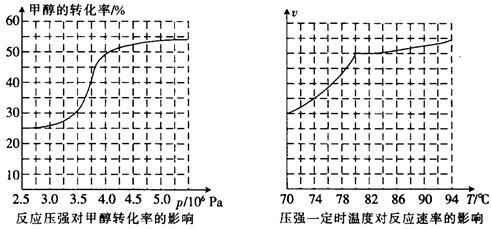
①从反应压强对甲醇转化率的影响“效率”看,工业制取甲酸甲酯应选择的压强是____ 。 (填“3.5×106Pa”、“4.0×106Pa”或“5.0×106Pa”)。
②实际工业生产中采用的温度是80℃,其理由是______ 。
(i)制备合成气:CH4(g)+H2O(g)
 CO(g)+3H2(g) △H1=+206.0kJ/mol
CO(g)+3H2(g) △H1=+206.0kJ/mol(ii)合成甲醇:CO(g)+2H2(g)
 CH3OH(g) △H2
CH3OH(g) △H2请回答下列问题:
(1)制备合成气:将1.0mol CH4和2.0mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应(i);CH4的平衡转化率与温度、压强的关系如图所示。

①已知100℃时达到平衡的时间为5min,则从反应开始到平衡,用氢气表示的平均反应速率为:v(H2) =
②图中p1
③为解决合成气中H2过量而CO不足的问题,原料气中需添加CO2,发生反应如下:
CO2(g)+H2(g)
 CO(g)+H2O(g),为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为
CO(g)+H2O(g),为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为(2)合成甲醇:在Cu2O/ZnO作催化剂的条件下,向2L的密闭容器中通入1mol CO(g)和2mol H2(g),发生反应(ii),反应过程中,CH3OH的物质的量(n)与时间(t)及温度的关系如图所示。

①应(ii)需在
②据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量的CO2 有利于维持Cu2O的量不变,
原因是
③在500℃恒压条件下,请在
(3)工业上可通过甲醇羰基化法制取甲酸甲酯,其反应的热化学方程式为:
CH3OH(g)+CO(g)
 HCOOCH3(g)
HCOOCH3(g)  ,科研人员对该反应进行了研究,部分研究结果如下:
,科研人员对该反应进行了研究,部分研究结果如下:
①从反应压强对甲醇转化率的影响“效率”看,工业制取甲酸甲酯应选择的压强是
②实际工业生产中采用的温度是80℃,其理由是
您最近一年使用:0次
【推荐2】当今世界各国相继规划了碳达峰、碳中和的时间节点。因此,研发CO2利用技术、降低CO2含量成为研究热点。某化学实验小组采用CO2催化加氢制甲醇来减少CO2对环境造成的影响。在容积为4L的恒容密闭容器中,充入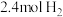 和
和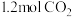 ,发生反应:CO2(g)+3H2(g)
,发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0 kJ/mol。回答下列问题:
CH3OH(g)+H2O(g) △H=-49.0 kJ/mol。回答下列问题:
(1)3min后,反应达到平衡状态,此时测得反应前后的总压强之比为5∶4。
①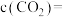
_______ mol/L, 的转化率为
的转化率为_______ %。
②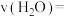
_______  。
。
③该反应达到平衡时的平衡常数K=_______ (列出计算式即可)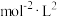 。
。
(2)在一定条件下,体系中的CO2的平衡转化率( )与温度(T)和压强(p)的关系如图所示。则T1
)与温度(T)和压强(p)的关系如图所示。则T1_______ (填“>”或“<”)T2,判断的理由是_______ 。

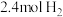 和
和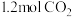 ,发生反应:CO2(g)+3H2(g)
,发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0 kJ/mol。回答下列问题:
CH3OH(g)+H2O(g) △H=-49.0 kJ/mol。回答下列问题:(1)3min后,反应达到平衡状态,此时测得反应前后的总压强之比为5∶4。
①
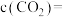
 的转化率为
的转化率为②
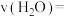
 。
。③该反应达到平衡时的平衡常数K=
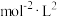 。
。(2)在一定条件下,体系中的CO2的平衡转化率(
 )与温度(T)和压强(p)的关系如图所示。则T1
)与温度(T)和压强(p)的关系如图所示。则T1
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】完成下列问题。
(1) 的排放主要来自于汽车尾气,包含
的排放主要来自于汽车尾气,包含 和
和 ,有人提出用活性炭对
,有人提出用活性炭对 进行吸附,发生反应如下:
进行吸附,发生反应如下: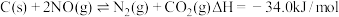 在
在 时,借助传感器测得反应在不同时间点上各物质的浓度如下:
时,借助传感器测得反应在不同时间点上各物质的浓度如下:
①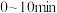 内,
内, 的平均反应速率
的平均反应速率
________ ,当升高反应温度,该反应的平衡常数K________ (选填“增大”、“减小”或“不变”)。
② 后,只改变某一条件,反应重新达到平衡:根据上表中的数据判断改变的条件可能是
后,只改变某一条件,反应重新达到平衡:根据上表中的数据判断改变的条件可能是________ (填字母)。
A.加入一定量的活性炭 B.通入一定量的
C.适当缩小容器的体积 D.加入合适的催化剂
(2)萨巴蒂尔 反应是将
反应是将 和
和 在一定温度和压强下发生反应:
在一定温度和压强下发生反应: ,研究标明,纳米铜线催化剂代替传统铜质催化剂可提高反应速率和
,研究标明,纳米铜线催化剂代替传统铜质催化剂可提高反应速率和 选择性。
选择性。
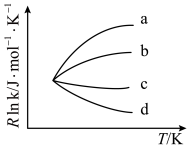
①该反应在________ (选填“高温”或“低温”)下能自发进行。
②速率与活化能关系可用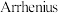 经验公式表示:
经验公式表示: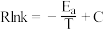 (
( 为活化能,k为速率常数,R和C为常数)。用纳米铜线时的变化曲线为图中曲线a,则传统铜质催化剂的变化曲线是
为活化能,k为速率常数,R和C为常数)。用纳米铜线时的变化曲线为图中曲线a,则传统铜质催化剂的变化曲线是___________ 。
③将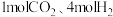 加入体积为
加入体积为 的恒温刚性容器中,达到平衡后,
的恒温刚性容器中,达到平衡后, 转化率为x,则萨巴蒂尔反应的平衡常数
转化率为x,则萨巴蒂尔反应的平衡常数
___________
(1)
 的排放主要来自于汽车尾气,包含
的排放主要来自于汽车尾气,包含 和
和 ,有人提出用活性炭对
,有人提出用活性炭对 进行吸附,发生反应如下:
进行吸附,发生反应如下: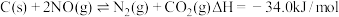 在
在 时,借助传感器测得反应在不同时间点上各物质的浓度如下:
时,借助传感器测得反应在不同时间点上各物质的浓度如下:时间(min) 浓度(mol•L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
 | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
 内,
内, 的平均反应速率
的平均反应速率
②
 后,只改变某一条件,反应重新达到平衡:根据上表中的数据判断改变的条件可能是
后,只改变某一条件,反应重新达到平衡:根据上表中的数据判断改变的条件可能是A.加入一定量的活性炭 B.通入一定量的

C.适当缩小容器的体积 D.加入合适的催化剂
(2)萨巴蒂尔
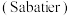 反应是将
反应是将 和
和 在一定温度和压强下发生反应:
在一定温度和压强下发生反应: ,研究标明,纳米铜线催化剂代替传统铜质催化剂可提高反应速率和
,研究标明,纳米铜线催化剂代替传统铜质催化剂可提高反应速率和 选择性。
选择性。
①该反应在
②速率与活化能关系可用
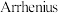 经验公式表示:
经验公式表示: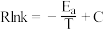 (
( 为活化能,k为速率常数,R和C为常数)。用纳米铜线时的变化曲线为图中曲线a,则传统铜质催化剂的变化曲线是
为活化能,k为速率常数,R和C为常数)。用纳米铜线时的变化曲线为图中曲线a,则传统铜质催化剂的变化曲线是③将
 加入体积为
加入体积为 的恒温刚性容器中,达到平衡后,
的恒温刚性容器中,达到平衡后, 转化率为x,则萨巴蒂尔反应的平衡常数
转化率为x,则萨巴蒂尔反应的平衡常数
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】在密闭容器里,通入x mol H2(g)和y mol I2(g),发生反应:H2(g)+I2(g)⇌2HI(g)△H<0.改变下列条件,反应速率将如何改变?(选填“增大”“减小”或“不变”)
①升高温度________
②加入催化剂________
③充入更多的H2________
④保持容器中压强不变,充入氖气________
⑤保持容器容积不变,通入氖气________
⑥保持压强不变,充入2x mol H2(g)和2y mol I2(g)________ .
①升高温度
②加入催化剂
③充入更多的H2
④保持容器中压强不变,充入氖气
⑤保持容器容积不变,通入氖气
⑥保持压强不变,充入2x mol H2(g)和2y mol I2(g)
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】在密闭容器中充入1molH2和1molI2,压强为P(Pa),并在一定温度下反应:H2(g)+I2(g) 2HI(g)△H<0.写出下列条件下反应速率的变化(填“增大”,“减小”或“不变”)
2HI(g)△H<0.写出下列条件下反应速率的变化(填“增大”,“减小”或“不变”)
(1)容积不变,加入1molH2,其正反应速率的变化是___ 。
(2)升高温度,其逆反应速率的变化是___ 。
(3)压强不变,加入1molHe,其正反应速率的变化是___ 。
 2HI(g)△H<0.写出下列条件下反应速率的变化(填“增大”,“减小”或“不变”)
2HI(g)△H<0.写出下列条件下反应速率的变化(填“增大”,“减小”或“不变”)(1)容积不变,加入1molH2,其正反应速率的变化是
(2)升高温度,其逆反应速率的变化是
(3)压强不变,加入1molHe,其正反应速率的变化是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】在一密闭容器中充入1mol H2(g)和1mol I2(g),压强为P(Pa),并在一定温度下使其反应:H2(g)+I2(g) 2HI(g) △H<0.
2HI(g) △H<0.
(1)保持容器的容积不变,向其中加入1mol H2,反应速率_____ (填“加快”“减慢”“无影响”), 理由是_______________________________________________________________ .
(2)保持容器的容积不变,向其中加入1molN2(不参与反应),反应速率______ .(填“加快”“减慢”“无影响”) 理由是________________________________________________ .
(3)保持容器内气体的压强不变,向其中加入1mol N2(不参与反应),反应速率____ .(填“加快”“减慢”“无影响”) 理由是_____________________________________________ .
(4)保持容器内气体的压强不变,向其中加入1mol H2和1mol I2(g),反应速率______ .(填“加快”“减慢”“无影响”) 理由是____________________________________________ .
(5)提高起始的反应温度,反应速率______ .(填“加快”“减慢”“无影响”) 理由是_________________________ .
 2HI(g) △H<0.
2HI(g) △H<0.(1)保持容器的容积不变,向其中加入1mol H2,反应速率
(2)保持容器的容积不变,向其中加入1molN2(不参与反应),反应速率
(3)保持容器内气体的压强不变,向其中加入1mol N2(不参与反应),反应速率
(4)保持容器内气体的压强不变,向其中加入1mol H2和1mol I2(g),反应速率
(5)提高起始的反应温度,反应速率
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】为了减轻汽车尾气造成的大气污染,人们开始探索利用 NO 和 CO 在一定条件下 转化为 两种无毒气体E和F的方法(已知该反应△H<0). 在2L密闭容器中加入一定量 NO和CO,当温度分别在 T1和 T2时,测得各物质平衡时物质的量如下表:
(1)请结合上表数据,写出 NO 与 CO 反应的化学方程式_________________________________ 。
(2)根据表中数据判断,温度T1和T2的关系是(填序号)__________ 。
A.T1>T2 B. T1<T2 C. T1=T2 D.无法比较
(3)已知:4NH3(g) + 3O2(g) = 2N2(g) + 6H2O(g) ΔH=- 1266.8 kJ/mol,N2(g) + O2(g) = 2NO(g) ΔH = + 180.5kJ/mol,则氨催化氧化的热化学方程式为:________________________ 。
(4)500℃下,在 A、B 两个容器中均发生合成氨的反应。隔板Ⅰ固定不动,活塞Ⅱ可自由移动。

当合成氨在容器 B 中达平衡时,测得其中含有 1.0molN2,0.4molH2,0.4molNH3,此时容积为2.0L。则此条件下的平衡常数为_______________ ;保持温度和体积不变,向此容器中通入0.36molN2,平衡将__________________ (填“正向”、“逆向”或“不”)移动。
| n(mol) | NO | CO | E | F |
| 初始 | 0.100 | 0.100 | 0 | 0 |
| T1 | 0.020 | 0.020 | 0.080 | 0.040 |
| T2 | 0.010 | 0.010 | 0.090 | 0.045 |
(1)请结合上表数据,写出 NO 与 CO 反应的化学方程式
(2)根据表中数据判断,温度T1和T2的关系是(填序号)
A.T1>T2 B. T1<T2 C. T1=T2 D.无法比较
(3)已知:4NH3(g) + 3O2(g) = 2N2(g) + 6H2O(g) ΔH=- 1266.8 kJ/mol,N2(g) + O2(g) = 2NO(g) ΔH = + 180.5kJ/mol,则氨催化氧化的热化学方程式为:
(4)500℃下,在 A、B 两个容器中均发生合成氨的反应。隔板Ⅰ固定不动,活塞Ⅱ可自由移动。

当合成氨在容器 B 中达平衡时,测得其中含有 1.0molN2,0.4molH2,0.4molNH3,此时容积为2.0L。则此条件下的平衡常数为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】在如图所示的三个容积相同的三个容器①、②、③中进行如下的反应:3A(g) + B(g)⇌2C(g);△H<0
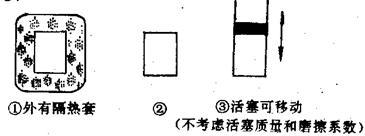
(1)若起始温度相同,分别向三个容器中充入3 mol A和1 mol B,则达到平衡时各容器中C物质的百分含量由大到小的顺序为(填容器编号)______ ;
(2)若维持温度不变,起始时②、③中均投入3 mol A、1 mol B,则达到平衡时,两容器中C物质的物质的量浓度②______ ③(填<、>、=);
(3)在②中投入3 mol A和1 mol B达平衡;若在相同条件下,起始时在②中投入a mol A和b mol B及c mol C,使两种情况达平衡时容器内C的百分含量相等,则a、b、c的关系为______ 。

(1)若起始温度相同,分别向三个容器中充入3 mol A和1 mol B,则达到平衡时各容器中C物质的百分含量由大到小的顺序为(填容器编号)
(2)若维持温度不变,起始时②、③中均投入3 mol A、1 mol B,则达到平衡时,两容器中C物质的物质的量浓度②
(3)在②中投入3 mol A和1 mol B达平衡;若在相同条件下,起始时在②中投入a mol A和b mol B及c mol C,使两种情况达平衡时容器内C的百分含量相等,则a、b、c的关系为

您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】工业上采用高温分解H2S制取氢气,其反应为2H2S(g) 2H2(g)+S2(g),在膜反应器中分离出H2。
2H2(g)+S2(g),在膜反应器中分离出H2。
(1)在密闭容器中,充入0.10molH2S(g),发生反应2H2S(g) 2H2(g)+S2(g),控制不同的温度和压强进行实验,结果如图。
2H2(g)+S2(g),控制不同的温度和压强进行实验,结果如图。

图中压强p1、p2、p3由大到小的顺序为___ 。
(2)若容器的容积为2.0L,则压强为p3,温度为950℃时,反应经3h达到平衡,化学反应速率v(S2)=___ 。
(3)若压强p2=7.2MPa、温度为975℃时,该反应的平衡常数Kp=__ (用平衡分压代替平衡浓度,分压=总压×物质的量分数,结果保留两位有效数字)。
 2H2(g)+S2(g),在膜反应器中分离出H2。
2H2(g)+S2(g),在膜反应器中分离出H2。(1)在密闭容器中,充入0.10molH2S(g),发生反应2H2S(g)
 2H2(g)+S2(g),控制不同的温度和压强进行实验,结果如图。
2H2(g)+S2(g),控制不同的温度和压强进行实验,结果如图。
图中压强p1、p2、p3由大到小的顺序为
(2)若容器的容积为2.0L,则压强为p3,温度为950℃时,反应经3h达到平衡,化学反应速率v(S2)=
(3)若压强p2=7.2MPa、温度为975℃时,该反应的平衡常数Kp=
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】可逆反应2SO2+ O2 2SO3进行的时间(t)和反应混合气中SO3的百分含量的关系如图所示。请回答下列问题:
2SO3进行的时间(t)和反应混合气中SO3的百分含量的关系如图所示。请回答下列问题:
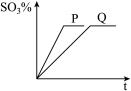
(1)如果两条曲线为其它条件相同,分别为使用和不使用催化剂,则曲线_____ 表示使用了催化剂,并且从图象可知,催化剂可以______________ 但不能________________
(2)请你再提出能增大该反应反应速率的两条措施_____________ 和_______________ 。
 2SO3进行的时间(t)和反应混合气中SO3的百分含量的关系如图所示。请回答下列问题:
2SO3进行的时间(t)和反应混合气中SO3的百分含量的关系如图所示。请回答下列问题:
(1)如果两条曲线为其它条件相同,分别为使用和不使用催化剂,则曲线
(2)请你再提出能增大该反应反应速率的两条措施
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】在容器可变的密闭容器中,反应N2(g)+3H2(g) 2NH3(g)在一定条件下达到平衡。完成下列填空:
2NH3(g)在一定条件下达到平衡。完成下列填空:
(1)在其他条件不变的情况下,缩小容器体积以增大反应体系的压强,v正______ (选填“增大”、“减小”,下同),v逆______ ,平衡向______ 方向移动(选填“正反应”、“逆反应”)。
(2)在其他条件不变的情况下,降低温度平衡向正反应方向移动,为______ 反应(选填“吸热”、“放热”)。
(3)如图为反应速率(ν)与时间(t)关系的示意图,由图判断,在t1时刻曲线发生变化的原因是______ (填写编号)。
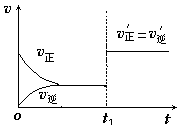
a.增大N2的浓度 b.扩大容器体积 c.加入催化剂 d.升高温度
改变条件后,平衡混合物中NH3的百分含量______ (选填“增大”、“减小”、“不变”)。
 2NH3(g)在一定条件下达到平衡。完成下列填空:
2NH3(g)在一定条件下达到平衡。完成下列填空:(1)在其他条件不变的情况下,缩小容器体积以增大反应体系的压强,v正
(2)在其他条件不变的情况下,降低温度平衡向正反应方向移动,为
(3)如图为反应速率(ν)与时间(t)关系的示意图,由图判断,在t1时刻曲线发生变化的原因是

a.增大N2的浓度 b.扩大容器体积 c.加入催化剂 d.升高温度
改变条件后,平衡混合物中NH3的百分含量
您最近一年使用:0次

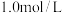 的
的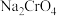 溶液中
溶液中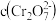 随
随 的变化如图所示,回答下列问题:
的变化如图所示,回答下列问题:
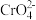 和
和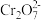 在溶液中相互转化的离子方程式
在溶液中相互转化的离子方程式 点数据,计算出该转化反应的平衡常数为
点数据,计算出该转化反应的平衡常数为

