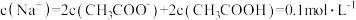已知:NaA的水溶液呈碱性。常温下将等体积的0.10 mol·L-1NaA溶液与0.05 mol·L-1 HCl溶液混合,所得溶液pH<7。据此判断以下说法不成立的是
| A.c(Cl-)+c(OH-)+c(A-)>c(Na+) | B.相同条件下HA的电离程度大于A-的水解程度 |
| C.c(A-)+ c(HA)= c(Na+) | D.c(A-)>c(Na+) >c(H+)>c(OH-) |
更新时间:2016-06-08 17:43:08
|
相似题推荐
单选题
|
适中
(0.65)
名校
【推荐1】下列比较中,正确的是:
| A.常温下,pH=11的Na2CO3溶液中,水电离出的c(OH-)=1.0×10-3mol•L-1 |
| B.同温度同物质的量浓度时,HF比HCN易电离,则NaF溶液的pH比NaCN溶液的大 |
| C.物质的量浓度相等的H2S和NaHS混合溶液中:c(Na+)+c(H+)=c(S2-)+c(HS-)+c(OH-) |
| D.加热蒸干AlCl3溶液可得到AlCl3固体 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】某温度时,向一定浓度的Na2S溶液中滴入盐酸,溶液的pH与离子浓度变化关系如图所示。
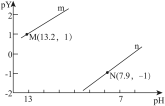
已知:Y表示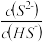 或
或 ,pY=-lgY。下列叙述不正确的是
,pY=-lgY。下列叙述不正确的是

已知:Y表示
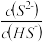 或
或 ,pY=-lgY。下列叙述不正确的是
,pY=-lgY。下列叙述不正确的是A.曲线n表示pH与p 的变化关系 的变化关系 |
| B.Ka2(H2S)=1.0×10-14.2 |
| C.滴入盐酸之前:c(S2-)>c(HS-)>c(OH-)>c(H+) |
| D.当溶液呈中性时,c(Cl-)=c(HS-)+2c(S2-) |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】常温下,下列溶液中各离子浓度关系正确的是
A. 的醋酸溶液与 的醋酸溶液与 的氢氧化钠溶液等体积混合后: 的氢氧化钠溶液等体积混合后: |
B.浓度为 的碳酸氢钠溶液: 的碳酸氢钠溶液: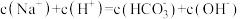 |
C.浓度为 的 的 溶液: 溶液: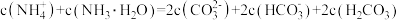 |
D.浓度均为 的醋酸溶液与 的醋酸溶液与 溶液等体积混合后: 溶液等体积混合后: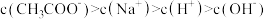 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】下列实验,不能说明乙酸是弱电解质的是
| A.常温时,测得乙酸钠溶液的pH>7 |
| B.常温时,测得0.1 mol·L-1乙酸溶液的pH约为3 |
| C.乙酸溶液与大理石反应产生气泡 |
| D.相同温度下,测得同物质的量浓度的乙酸溶液的导电性比盐酸溶液弱 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐1】一定量的(NH4)2SO4与NH3·H2O混合所得的碱性溶液中,下列说法错误的是
| A.c(OH–) > c(H+) | B.c(NH4+) + c(H+) = 2c(SO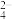 )+ c(OH–) )+ c(OH–) |
C.c(NH4+)<2c(SO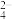 ) ) | D.c(NH4+)> 2c(SO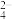 ) ) |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】下列各组溶液中每种溶质的物质的量浓度均为0.1 mol/L:①H2S ②NaHS ③Na2S ④H2S和NaHS混合液。下列说法不正确的是
| A.c(S2―)由大到小是:③>①>②>④ |
| B.溶液pH由大到小的是:③>②>④>① |
| C.在H2S 和NaHS混合液中:2c(Na+)=c(H2S)+c(HS―)+c(S2―) |
| D.在NaHS溶液中:c(H+)+c(Na+)=c(OH―)+c(HS―)+2c(S2―) |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐1】将浓度和体积均相同的一元酸HA与NaOH溶液混合,下列说法一定错误的是
| A.c(H+)=c(OH-) | B.c(A-)=c(Na+) |
| C.c(A-)>c(Na+) | D.c(H+)<c(OH-) |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】下列图示与对应的叙述相符的是( )
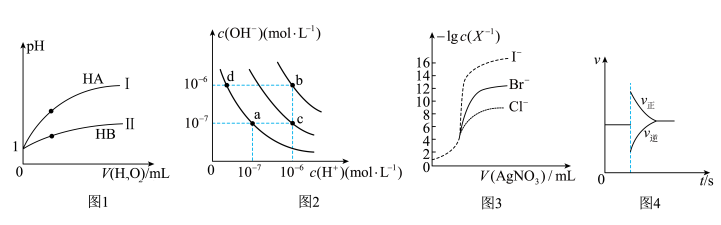

| A.图1表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则等物质的量浓度的NaA和NaB混合溶液中:c(Na+)>c(A-)>c(B-)>c(OH-)>c(H+) |
| B.图2中在b点对应温度下,将pH=2的H2SO4溶液与pH=12的NaOH溶液等体积混合后,溶液显中性 |
| C.用0.0100 mol/L硝酸银标准溶液,滴定浓度均为0.1000 mol/L Cl-、Br-及I-的混合溶液,由图3曲线,可确定首先沉淀的是Cl- |
D.图4表示在N2(g)+3H2(g)  2NH3(g)达到平衡后,减小NH3浓度时速率的变化 2NH3(g)达到平衡后,减小NH3浓度时速率的变化 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐3】常温下,向 氨水中滴加盐酸,溶液中水电离出的氢离子浓度随加入盐酸体积的变化如图所示.下列说法错误的是
氨水中滴加盐酸,溶液中水电离出的氢离子浓度随加入盐酸体积的变化如图所示.下列说法错误的是 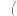

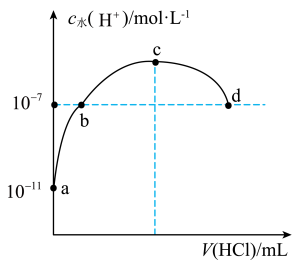
 氨水中滴加盐酸,溶液中水电离出的氢离子浓度随加入盐酸体积的变化如图所示.下列说法错误的是
氨水中滴加盐酸,溶液中水电离出的氢离子浓度随加入盐酸体积的变化如图所示.下列说法错误的是 


| A.c点表示氨水与盐酸恰好完全反应 |
| B.b点溶液呈中性,d点溶液呈酸性 |
C.常温下,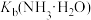 的数量级为 的数量级为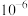 |
D.a、b之间的任意一点(不包括a、b点)溶液中: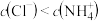 |
您最近一年使用:0次

 的氨水、
的氨水、 后者大
后者大 的
的 溶液与
溶液与 大于7
大于7 溶液中,
溶液中,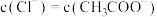
 的盐酸中分别加入
的盐酸中分别加入 代表阿伏加德罗常数的值。下列说法正确的是
代表阿伏加德罗常数的值。下列说法正确的是

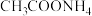 溶液中
溶液中 与
与 数目均为
数目均为 三氯甲烷中含有氯原子的数目为
三氯甲烷中含有氯原子的数目为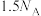

 溶于水,转移的电子数目为
溶于水,转移的电子数目为

 随加入
随加入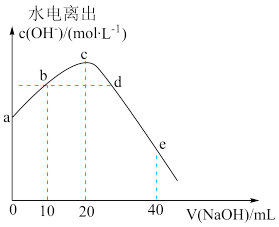
 c的过程中,溶液的导电能力逐渐增强
c的过程中,溶液的导电能力逐渐增强