下列说法正确的是( )
| A.PH=6的溶液一定显酸性 |
| B.25℃时,0.1mol/L的NaHB溶液呈酸性,说明H2B为强酸 |
| C.NH4Cl、CH3COONa、NaHCO3、NaHSO4溶于水,对水的电离都有促进作用 |
| D.0.1mol/LCH3COOH溶液与0.05mol/LNaOH溶液等体积混合,所得溶液中:2c(Na+)═c(CH3COO-)+c(CH3COOH) |
更新时间:2017-03-13 21:28:22
|
相似题推荐
单选题
|
较难
(0.4)
名校
解题方法
【推荐1】25℃时,下列有关电解质溶液的说法错误的是
A.向 溶液中加入少量 溶液中加入少量 固体,溶液中 固体,溶液中 的值增大 的值增大 |
B.加水稀释 溶液,溶液中 溶液,溶液中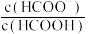 逐渐减小 逐渐减小 |
C. 的 的 溶液与 溶液与 的盐酸中, 的盐酸中, 溶液中水电离的 溶液中水电离的 大 大 |
D. 的 的 与 与 混合溶液中, 混合溶液中,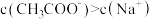 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐2】缓冲溶液在生产生活中有广泛应用,某缓冲溶液存在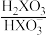 和
和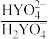 缓冲对。常温下,该水溶液中各缓冲对微粒浓度之比的对数值lgG[G表示
缓冲对。常温下,该水溶液中各缓冲对微粒浓度之比的对数值lgG[G表示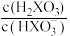 或
或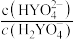 与溶液pH的变化关系如图所示(已知:常温下,H3YO4的电离平衡常数为
与溶液pH的变化关系如图所示(已知:常温下,H3YO4的电离平衡常数为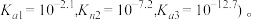
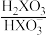 和
和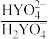 缓冲对。常温下,该水溶液中各缓冲对微粒浓度之比的对数值lgG[G表示
缓冲对。常温下,该水溶液中各缓冲对微粒浓度之比的对数值lgG[G表示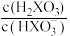 或
或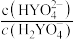 与溶液pH的变化关系如图所示(已知:常温下,H3YO4的电离平衡常数为
与溶液pH的变化关系如图所示(已知:常温下,H3YO4的电离平衡常数为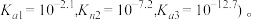
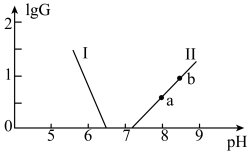
| A.H2XO3的Ka1的数量级为10-7 |
| B.a→b的过程中,水的电离程度逐渐增大 |
C.当溶液pH逐渐增大时,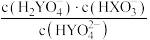 逐渐增大 逐渐增大 |
D.当 时, 时,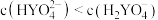 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐1】HA是一元弱酸,微溶性盐 的饱和溶液中
的饱和溶液中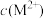 随
随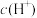 而变化,
而变化, 不发生水解。定义如下关系:
不发生水解。定义如下关系: ,
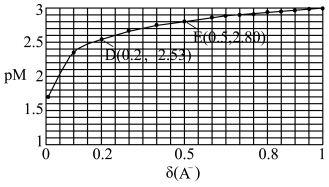
,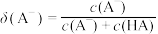 。25℃时,实验测得pM与
。25℃时,实验测得pM与 的关系如图所示,其中D点对应的
的关系如图所示,其中D点对应的 。已知
。已知 ,则下列说法不正确的是
,则下列说法不正确的是
 的饱和溶液中
的饱和溶液中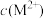 随
随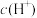 而变化,
而变化, 不发生水解。定义如下关系:
不发生水解。定义如下关系: ,
,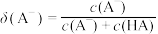 。25℃时,实验测得pM与
。25℃时,实验测得pM与 的关系如图所示,其中D点对应的
的关系如图所示,其中D点对应的 。已知
。已知 ,则下列说法不正确的是
,则下列说法不正确的是
A.25℃时,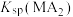 的数量级为 的数量级为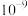 |
B.E点的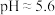 |
C.D点存在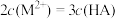 |
D.25℃时,HA的电离常数 为 为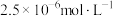 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐2】下列有关叙述正确的是
| A.某温度下,1 L pH = 6 的纯水中含 OH一为10-8mol |
B.25℃ 时,向0. 1 mo l•L-1 CH3COONa 溶液中加入少量水,溶液中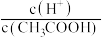 减小 减小 |
| C.25℃时,将 V1 L pH = 11的 NaOH溶液与V2 L pH = 3 的H A 溶液混合,溶液显中性,则V1 ≤V2 |
D.25℃时,将 a mol•L-1 氨水与0.01 mol•L- 1 盐酸等体积混合,反应完全时溶液中c(NH4+)=c(Cl-),用含a的代数式表示 NH3•H2O)的电离常数 Kb = 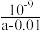 |
您最近一年使用:0次
单选题
|
较难
(0.4)
解题方法
【推荐3】下列说法正确的是
| A.加热1 mol/L NaAc溶液,溶液碱性增强,pH一定增大 |
| B.0.1 mol/L的H2B溶液中一定存在:c (H2B)+c (HB-)+c (B2-)=0.1 mol/L |
| C.常温下,pH=1的HAc溶液和pH=13的NaOH溶液中,c(Ac-)= c(Na+) |
| D.已知常温下CN-的Kh=1.61×10-3,则常温下HCN和NaCN的混合溶液呈碱性 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐1】砷及其化合物有着广泛的用途。砷有两种常见的弱酸,砷酸(H3AsO4)和亚砷酸(H3AsO3)。已知砷酸(H3AsO4)的pKa1、pKa2、pKa3依次为2.25、6.77、11.40(pKa=-lgKa)。亚砷酸(H3AsO3)水溶液中存在多种微粒形态,各种微粒分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与溶液的pH关系如图所示。下列说法正确的是


A.砷酸(H3AsO4)的电离方程式为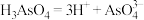 |
B.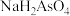 溶液呈碱性 溶液呈碱性 |
C.以酚酞为指示剂(变色范围pH8.2~10.0)将NaOH溶液逐滴加入到H3AsO3溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为 |
D.在H3AsO4溶液中有: |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】某化学兴趣小组对电解质溶液作如下的归纳总结(均在常温下)。其中正确的是( )
| A.pH=3的强酸溶液1mL,加水稀释至100mL后,溶液pH降低2个单位 |
| B.1L 0.50mol·L-1NH4Cl 溶液与2L 0.25mol·L-1NH4Cl 溶液含NH4+物质的量后者大 |
| C.pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
| D.pH=4、浓度均为0.1mol·L-1的CH3COOH、CH3COONa混合溶液中: c(CH3COO-)-c(CH3COOH)=2×(10-4-10-10) mol·L-1 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐3】现有一混合物的水溶液,可能含有以下离子中的几种:K+、NH4+、Cl-、Mg2+、Ba2+、 、
、 ,现取三份各100 mL溶液进行如下实验: 第一份加入AgNO3溶液有沉淀产生;第二份加足量NaOH溶液加热后,收集到0.08 mol气体;第三份加足量BaCl2溶液后,得到干燥沉淀12.54 g,经足量盐酸洗涤、干燥后,沉淀质量为4.66 g。以下结论正确的是( )
,现取三份各100 mL溶液进行如下实验: 第一份加入AgNO3溶液有沉淀产生;第二份加足量NaOH溶液加热后,收集到0.08 mol气体;第三份加足量BaCl2溶液后,得到干燥沉淀12.54 g,经足量盐酸洗涤、干燥后,沉淀质量为4.66 g。以下结论正确的是( )
 、
、 ,现取三份各100 mL溶液进行如下实验: 第一份加入AgNO3溶液有沉淀产生;第二份加足量NaOH溶液加热后,收集到0.08 mol气体;第三份加足量BaCl2溶液后,得到干燥沉淀12.54 g,经足量盐酸洗涤、干燥后,沉淀质量为4.66 g。以下结论正确的是( )
,现取三份各100 mL溶液进行如下实验: 第一份加入AgNO3溶液有沉淀产生;第二份加足量NaOH溶液加热后,收集到0.08 mol气体;第三份加足量BaCl2溶液后,得到干燥沉淀12.54 g,经足量盐酸洗涤、干燥后,沉淀质量为4.66 g。以下结论正确的是( )A.该混合液中一定含有:K+、 、 、 、 、 ,可能含Cl- ,可能含Cl- |
B.该混合液中一定含有: 、 、 、 、 ,可能含K+、Cl- ,可能含K+、Cl- |
C.该混合液中一定含有: 、 、 、 、 ,可能含Mg2+、K+、Cl- ,可能含Mg2+、K+、Cl- |
D.该混合液中一定含有: 、 、 ,可能含Mg2+、K+、Cl- ,可能含Mg2+、K+、Cl- |
您最近一年使用:0次

 溶液
溶液 的
的 溶液和
溶液和 溶液的
溶液的
 苯与
苯与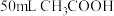 混合
混合
 分子间的氢键,且苯与
分子间的氢键,且苯与 溶液中滴加浓氨水至过量
溶液中滴加浓氨水至过量 是两性氢氧化物
是两性氢氧化物

