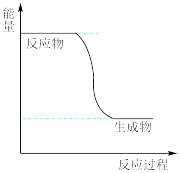
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。
CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。
(1)关于该反应的下列说法中,其△H____ 0。(填“大于”、“小于”或“等于”), 且在_______ (填“较高”或“较低”)温度下有利于该反应自发进行。
(2)该反应平衡常数K的表达式为______________________
(3)温度降低,平衡常数K_____________ (填“增大”、“不变”或“减小”)。
(4)若为两个容积相同的密闭容器,现向甲容器中充入1 mol CO2(g)和3 molH2(g),乙容器中充入1molCH3OH(g)和1molH2O(g),在相同的温度下进行反应,达到平衡时,甲容器内n(CH3OH )_________ (填“大于”“小于”或“等于”)乙容器内n(CH3OH )
(5)以甲醇和氧气为燃料,氢氧化钾溶液为电解质溶液构成电池。
①负极的电极反应式为_______________________
②若以石墨为电极,电解硫酸铜溶液,写出电解的化学反应方程式___________________
 CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。
CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。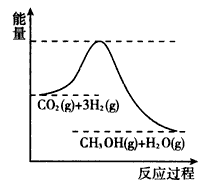
(1)关于该反应的下列说法中,其△H
(2)该反应平衡常数K的表达式为
(3)温度降低,平衡常数K
(4)若为两个容积相同的密闭容器,现向甲容器中充入1 mol CO2(g)和3 molH2(g),乙容器中充入1molCH3OH(g)和1molH2O(g),在相同的温度下进行反应,达到平衡时,甲容器内n(CH3OH )
(5)以甲醇和氧气为燃料,氢氧化钾溶液为电解质溶液构成电池。
①负极的电极反应式为
②若以石墨为电极,电解硫酸铜溶液,写出电解的化学反应方程式
更新时间:2017-05-02 14:13:06
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
【推荐1】连通装置是化学研究的重要装置。起始时,甲、乙体积均为1L,向甲、乙中均充入1.5 mol A、3.5 mol B,关闭阀门K。在相同温度和有催化剂存在的条件下,两容器中各自发生下列反应:3A(g)+ 2B(g)  C(g)+2D(g)+200kJ。5分钟时甲达平衡,此时乙容器的体积为0.86L。请回答以下问题:
C(g)+2D(g)+200kJ。5分钟时甲达平衡,此时乙容器的体积为0.86L。请回答以下问题:
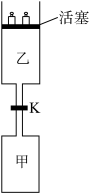
(1)甲中达到平衡时( )
A.甲中C物质不再产生 B.甲中气体密度保持不变
C.2v正(A)= 3v逆(D) D.甲中气体压强保持不变
(2)若5分钟时测得甲中A为amol,则该反应从起始到平衡时间内A的平均反应速率为_________________ (用含a的式子表示)
(3)甲容器改变某一条件,该反应的平衡常数K值变大,则该反应( )
A.一定向正反应方向移动 B.一定向逆反应方向应当
C.逆反应速率先增大后减小 D.逆反应速率先减小后增大
(4)5分钟时活塞向上拉,乙容器中平衡移动方向为_________________ ,再次平衡后甲中C和乙中A的物质的量比较:_______ (填“相等”、“前者大”、“后者大”、“无法确定”)。
 C(g)+2D(g)+200kJ。5分钟时甲达平衡,此时乙容器的体积为0.86L。请回答以下问题:
C(g)+2D(g)+200kJ。5分钟时甲达平衡,此时乙容器的体积为0.86L。请回答以下问题:
(1)甲中达到平衡时
A.甲中C物质不再产生 B.甲中气体密度保持不变
C.2v正(A)= 3v逆(D) D.甲中气体压强保持不变
(2)若5分钟时测得甲中A为amol,则该反应从起始到平衡时间内A的平均反应速率为
(3)甲容器改变某一条件,该反应的平衡常数K值变大,则该反应
A.一定向正反应方向移动 B.一定向逆反应方向应当
C.逆反应速率先增大后减小 D.逆反应速率先减小后增大
(4)5分钟时活塞向上拉,乙容器中平衡移动方向为
您最近一年使用:0次
【推荐2】不同价态含硫化合物的转化在工业上有重要的应用。回答下列问题:
I.利用NO2将SO2转化为SO3的反应过程如下:
i.SO2(g)+NO2(g)=SO3(g)+NO(g) ΔH=QkJ·mol-1
ii.2NO(g)+O2(g)=2NO2(g) ΔH=-114.1kJ·mol-1
反应2SO2(g)+O2(g)=2SO3(g) ΔH=-197.7kJ·mol-1。则Q=_______ ;NO2的作用是_______ 。
II.某化学小组对反应2SO2(g)+O2(g)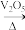 2SO3(g)进行研究。
2SO3(g)进行研究。
(1)相同条件下,在某恒容密闭容器中充入2molSO2和1molO2,发生上述反应。下列情况能说明反应达到化学平衡状态的是_______ (填标号)。
A.2υ(SO2)=υ(O2)
B.容器内气体的压强保持不变
C.SO2与O2的浓度比保持不变
D.混合气体的平均相对分子质量保持不变
(2)在一个容积为2L的恒温恒容密闭容器中,以不同投料方式研究上述反应,得到的数据如下表:
①表中a=_______ ,甲组实验在该条件下的平衡常数K=_______ 。
②在相同条件下,若将甲组实验按2molSO2、1molO2、1molSO3进行投料,则反应开始时v正____ v逆(填“>”“=”或“<”),平衡时SO3的百分含量与原甲组实验相比__________ (填“变大”“变小”或“不变”)。
③为加快乙组实验的反应速率,下列措施可行的是_______ (填标号)。
A.升高温度 B.降低温度 C.充入适量N2 D.移走SO2
若将乙组实验的容器改为绝热容器,则b值_______ (填“变大”“变小”或“不变”)。
I.利用NO2将SO2转化为SO3的反应过程如下:
i.SO2(g)+NO2(g)=SO3(g)+NO(g) ΔH=QkJ·mol-1
ii.2NO(g)+O2(g)=2NO2(g) ΔH=-114.1kJ·mol-1
反应2SO2(g)+O2(g)=2SO3(g) ΔH=-197.7kJ·mol-1。则Q=
II.某化学小组对反应2SO2(g)+O2(g)
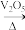 2SO3(g)进行研究。
2SO3(g)进行研究。(1)相同条件下,在某恒容密闭容器中充入2molSO2和1molO2,发生上述反应。下列情况能说明反应达到化学平衡状态的是
A.2υ(SO2)=υ(O2)
B.容器内气体的压强保持不变
C.SO2与O2的浓度比保持不变
D.混合气体的平均相对分子质量保持不变
(2)在一个容积为2L的恒温恒容密闭容器中,以不同投料方式研究上述反应,得到的数据如下表:
| 实验分组 | 甲组 | 乙组 |
| 反应物 | 2molSO2、1molO2 | 2molSO3 |
| 反应热量 | 放热158.16kJ | |
| 反应物的平衡转化率 | a | b |
①表中a=
②在相同条件下,若将甲组实验按2molSO2、1molO2、1molSO3进行投料,则反应开始时v正
③为加快乙组实验的反应速率,下列措施可行的是
A.升高温度 B.降低温度 C.充入适量N2 D.移走SO2
若将乙组实验的容器改为绝热容器,则b值
您最近一年使用:0次
【推荐3】硫酸工业和合成氨工业是衡量一个国家工业发展水平的重要指标,下图是硫酸工业和合成氨工业联合生产示意图:

回答下列问题:
(1)已知:
4Fe(s)+3O2(g)=2Fe2O3(s) ∆H=akJ/mol
SO2 (g)=S(s)+O2(g) ∆H=bkJ/mol
Fe(s)+2S(s)=Fe2S(s) ∆H=ckJ/mol
沸腾炉中主要反应的热化学方程式为____ 。
(2)如果生产过程中H2的总转化率为90%,FeS2的总转化率为95%,氨与硫酸生成硫酸铵的转化率为100%,则最初FeS2和H2的物质的量之比为___ 。
(3)在一定条件下,分别向体积相同的恒容密闭容器甲,乙、丙中通入一定量的N2、H2或 NH3,发生反应:N2(g)+3H2(g)⇌2NH3 (g),相关数据如下:
①乙中NH3的转化率为___ ,丙中x的取值范围为___ 。
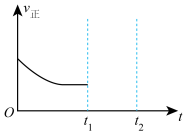
②在t1时升高甲容器的温度,至t2时再次达到平衡,测得t2时混合气体的平均摩尔质量比tl时小。请在图中画出tl~t2时间段正反应速率的变化示意图______________ 。
(4)尾气中含有SO2,直接排放会造成环境污染,可用Fe2(SO4)3溶液吸收。某科研团队对pH、c(Fe3+)、温度等因素对SO2最高吸收率的影响进行研究,结果如图:
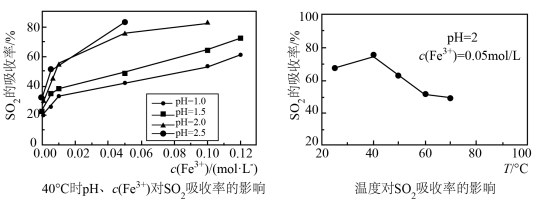
40℃时SO2的最高吸收率随pH、c(Fe3+)的增大而__ ,其原因是___ ;温度高于 40℃后,SO2的最高吸收率随温度的升高而减小,其原因是____ 。

回答下列问题:
(1)已知:
4Fe(s)+3O2(g)=2Fe2O3(s) ∆H=akJ/mol
SO2 (g)=S(s)+O2(g) ∆H=bkJ/mol
Fe(s)+2S(s)=Fe2S(s) ∆H=ckJ/mol
沸腾炉中主要反应的热化学方程式为
(2)如果生产过程中H2的总转化率为90%,FeS2的总转化率为95%,氨与硫酸生成硫酸铵的转化率为100%,则最初FeS2和H2的物质的量之比为
(3)在一定条件下,分别向体积相同的恒容密闭容器甲,乙、丙中通入一定量的N2、H2或 NH3,发生反应:N2(g)+3H2(g)⇌2NH3 (g),相关数据如下:
| 容器 | 甲 | 乙 | 丙 |
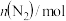 | 1 | 0 | 2 |
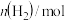 | 3 | 0 | 6 |
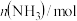 | 0 | 2 | 0 |
平衡时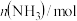 | 0.8 | x |
②在t1时升高甲容器的温度,至t2时再次达到平衡,测得t2时混合气体的平均摩尔质量比tl时小。请在图中画出tl~t2时间段正反应速率的变化示意图

(4)尾气中含有SO2,直接排放会造成环境污染,可用Fe2(SO4)3溶液吸收。某科研团队对pH、c(Fe3+)、温度等因素对SO2最高吸收率的影响进行研究,结果如图:

40℃时SO2的最高吸收率随pH、c(Fe3+)的增大而
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】锰及其化合物主要用于锰矿的开采、锰铁冶炼、化肥和医药等领域。
(1) 位于第
位于第_________ 周期。
(2)早期冶炼金属 的一种方法是先煅烧软锰矿(主要成分为
的一种方法是先煅烧软锰矿(主要成分为 )生成
)生成 ,再利用铝热反应制备金属
,再利用铝热反应制备金属 ,该铝热反应的化学方程式为
,该铝热反应的化学方程式为____________________________________ 。
(3)工业上通常采用软锰矿与 固体在空气中共热生成
固体在空气中共热生成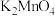 ,再通入
,再通入 的方法制备
的方法制备 。
。
各物质的溶解度如下表所示:
① 与
与 的反应中氧化产物和还原产物的比值为
的反应中氧化产物和还原产物的比值为____________ 。
②该制备过程需控制通入 的量,若
的量,若 过量,还会生成物质A
过量,还会生成物质A____________ (填化学式)。
③从 和
和 混合溶液中分离提纯出
混合溶液中分离提纯出 晶体的步骤为
晶体的步骤为_________ 、_________ 过滤、洗涤、干燥;物质A的生成会使 的纯度降低,原因是
的纯度降低,原因是__________________________________________ 。
(4)常温下,向 溶液中加入
溶液中加入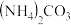 溶液,可能会产生
溶液,可能会产生 ,反应方程式为
,反应方程式为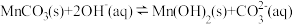 ,该反应的平衡常数为
,该反应的平衡常数为__________ (保留2位有效数字);若向溶液中加入 固体,则平衡常数
固体,则平衡常数__________ (填“增大”“减小”或“不变”)[已知 、
、 的
的 分别为
分别为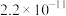 、
、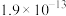 ]。
]。
(1)
 位于第
位于第(2)早期冶炼金属
 的一种方法是先煅烧软锰矿(主要成分为
的一种方法是先煅烧软锰矿(主要成分为 )生成
)生成 ,再利用铝热反应制备金属
,再利用铝热反应制备金属 ,该铝热反应的化学方程式为
,该铝热反应的化学方程式为(3)工业上通常采用软锰矿与
 固体在空气中共热生成
固体在空气中共热生成 ,再通入
,再通入 的方法制备
的方法制备 。
。各物质的溶解度如下表所示:
温度/℃ 物质 | 0 | 10 | 20 | 30 | 40 | 60 | 80 | 100 |
| 2.83 | 4.31 | 6.34 | 9.03 | 12.6 | 22.1 | 41.1 | 50.5 |
| 105 | 109 | 111 | 114 | 117 | 127 | 140 | 156 |
A | 22.5 | 27.4 | 33.7 | 39.9 | 47.5 | 65.6 | — | — |
①
 与
与 的反应中氧化产物和还原产物的比值为
的反应中氧化产物和还原产物的比值为②该制备过程需控制通入
 的量,若
的量,若 过量,还会生成物质A
过量,还会生成物质A③从
 和
和 混合溶液中分离提纯出
混合溶液中分离提纯出 晶体的步骤为
晶体的步骤为 的纯度降低,原因是
的纯度降低,原因是(4)常温下,向
 溶液中加入
溶液中加入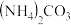 溶液,可能会产生
溶液,可能会产生 ,反应方程式为
,反应方程式为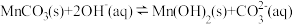 ,该反应的平衡常数为
,该反应的平衡常数为 固体,则平衡常数
固体,则平衡常数 、
、 的
的 分别为
分别为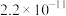 、
、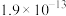 ]。
]。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】I已知:①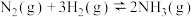
 ;
;
②
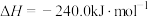 ;
;
③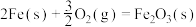
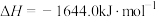 。
。
(1)则反应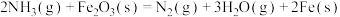

_____  。
。
Ⅱ化学反应的速率和限度对人类生产生活有重要的意义。
(2)已知 。甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响,设计实验如表(所取溶液体积均为2mL):
。甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响,设计实验如表(所取溶液体积均为2mL):
①上述实验中溶液最先变浑浊的是_________ (填实验编号,下同)。
②控制变量是科学研究的重要方法,为探究浓度对化学反应速率的影响,应选择__________ 。
(3)在10L的密闭容器中,进行如下化学反应: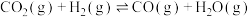 ,其化学平衡常数K和温度t的关系如下表:
,其化学平衡常数K和温度t的关系如下表:
请回答:
①该反应的化学平衡常数表达式为K=________ 。
②该反应为________ (填“吸热”或“放热”)反应。
③能说明该反应达到化学平衡状态的是_________ (填字母)。
a.容器中压强不变 b.混合气体中 不变
不变
c. d.
d.
④某温度下,平衡浓度符合下式: ,试判断此时的温度为
,试判断此时的温度为_______ ℃。
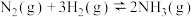
 ;
;②

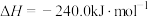 ;
;③
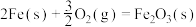
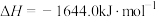 。
。(1)则反应
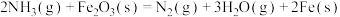

 。
。Ⅱ化学反应的速率和限度对人类生产生活有重要的意义。
(2)已知
 。甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响,设计实验如表(所取溶液体积均为2mL):
。甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响,设计实验如表(所取溶液体积均为2mL):| 实验编号 | 温度/℃ | 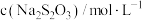 | 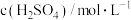 |
| I | 25 | 0.1 | 0.1 |
| Ⅱ | 25 | 0.2 | 0.1 |
| Ⅲ | 50 | 0.2 | 0.1 |
②控制变量是科学研究的重要方法,为探究浓度对化学反应速率的影响,应选择
(3)在10L的密闭容器中,进行如下化学反应:
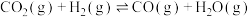 ,其化学平衡常数K和温度t的关系如下表:
,其化学平衡常数K和温度t的关系如下表:| t/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
①该反应的化学平衡常数表达式为K=
②该反应为
③能说明该反应达到化学平衡状态的是
a.容器中压强不变 b.混合气体中
 不变
不变c.
 d.
d.
④某温度下,平衡浓度符合下式:
 ,试判断此时的温度为
,试判断此时的温度为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究。已知在不同温度下的化学反应平衡常数(K1、K2、K3)如表所示,请回答下列问题:
(1)反应②是___________ (填“吸热”或“放热”)反应。
(2)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=___________ (用K1、K2表示),△H3=___________ (用△H1、△H2表示)。
(3)反应③在一定条件下建立的平衡,写出该反应的化学平衡常数的表达式为:K3=___________
(4)要使反应③在一定条件下建立的平衡正向移动,可采取的措施有___________ (填写字母序号)。
A.缩小反应容器的容积 B.扩大反应容器的容积
C.升高温度 D.降低温度
E.使用合适的催化剂 F.从平衡体系中及时分离出CH3OH
(5)500℃时,测得反应③在某时刻,CO2(g)、H2(g)、CH3OH(g)、H2O(g)的浓度分别为0.1mol·L−1、0.3mol·L−1、0.3mol·L−1、0.15mol·L−1,则此时v正___________ v逆(填“>”、“<”或“=”)
| 化学反应 | 焓变 | 平衡常数 | 温度/℃ | ||
| 500 | 700 | 800 | |||
| ①2H2(g)+CO(g) ⇌ CH3OH(g) |  | K1 | 2.5 | 0.34 | 0.15 |
| ②CO2(g)+H2(g) ⇌CO(g)+H2O(g) |  | K2 | 1.0 | 1.70 | 2.52 |
| ③CO2(g)+3H2(g) ⇌CH3OH(g)+H2O(g) |  | K3 | |||
(1)反应②是
(2)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=
(3)反应③在一定条件下建立的平衡,写出该反应的化学平衡常数的表达式为:K3=
(4)要使反应③在一定条件下建立的平衡正向移动,可采取的措施有
A.缩小反应容器的容积 B.扩大反应容器的容积
C.升高温度 D.降低温度
E.使用合适的催化剂 F.从平衡体系中及时分离出CH3OH
(5)500℃时,测得反应③在某时刻,CO2(g)、H2(g)、CH3OH(g)、H2O(g)的浓度分别为0.1mol·L−1、0.3mol·L−1、0.3mol·L−1、0.15mol·L−1,则此时v正
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】氨气中氢含量高,是一种优良的小分子储氢载体,且安全、易储运,可通过下面两种方法由氨气得到氢气方法,氨热分解法制氢气。
相关化学键的键能数据
一定温度下,利用催化剂将 分解为
分解为 和
和 。回答下列问题:
。回答下列问题:
(1)反应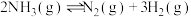

_______  ;
;
(2)已知该反应的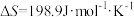 ,在下列哪些温度下反应能自发进行?_______(填标号)
,在下列哪些温度下反应能自发进行?_______(填标号)
(3)某兴趣小组对该反应进行了实验探究。在一定温度和催化剂的条件下,将0.1mol 通入3L的密闭容器中进行反应(此时容器内总压为2kPa),各物质的分压随时间的变化曲线如图所示。
通入3L的密闭容器中进行反应(此时容器内总压为2kPa),各物质的分压随时间的变化曲线如图所示。
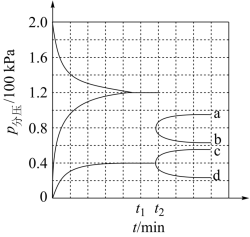
①若保持容器体积不变, 时反应达到平衡,用
时反应达到平衡,用 的浓度变化表示0~
的浓度变化表示0~ 时间内的反应速率
时间内的反应速率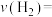
_______  (用含
(用含 的代数式表示)
的代数式表示)
②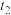 时将容器体积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后
时将容器体积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后 分压变化趋势的曲线是
分压变化趋势的曲线是_______ (用图中a、b、c、d表示),理由是_______ ;
③在该温度下,反应的平衡常数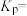
_______ 。
相关化学键的键能数据
| 化学键 | N≡N | H−H | N−H |
键能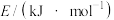 | 946 | 436.0 | 390.8 |
一定温度下,利用催化剂将
 分解为
分解为 和
和 。回答下列问题:
。回答下列问题:(1)反应
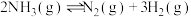

 ;
;(2)已知该反应的
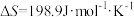 ,在下列哪些温度下反应能自发进行?_______(填标号)
,在下列哪些温度下反应能自发进行?_______(填标号)| A.25℃ | B.125℃ | C.225℃ | D.325℃ |
 通入3L的密闭容器中进行反应(此时容器内总压为2kPa),各物质的分压随时间的变化曲线如图所示。
通入3L的密闭容器中进行反应(此时容器内总压为2kPa),各物质的分压随时间的变化曲线如图所示。
①若保持容器体积不变,
 时反应达到平衡,用
时反应达到平衡,用 的浓度变化表示0~
的浓度变化表示0~ 时间内的反应速率
时间内的反应速率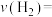
 (用含
(用含 的代数式表示)
的代数式表示)②
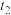 时将容器体积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后
时将容器体积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后 分压变化趋势的曲线是
分压变化趋势的曲线是③在该温度下,反应的平衡常数
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】600℃时,将0.2molNO(g)和0.2molO2(g)置于2L密闭容器内发生反应生成NO2(g)的体系中,n(NO)随时间的变化如表所示:
(1)上述反应__ (填“是”或“不是”)可逆反应,在第2s时,NO的转化率为__ 。
(2)如图中表示NO2变化曲线的是___ ,用O2表示从0~1s内该反应的平均反应速率v=__ 。
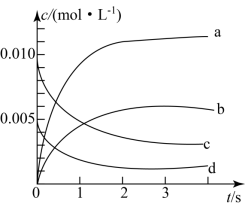
(3)平衡时体系压强与反应起始时体系压强的比为__ 。
(4)若该反应低温自发,欲增大该反应的K值,可采取的措施有(填序号)__ 。
A.降低温度 B.向混合气体中通入Cl2 C.使用高效催化剂 D.升高温度
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.20 | 0.12 | 0.08 | 0.06 | 0.06 | 0.06 |
(2)如图中表示NO2变化曲线的是

(3)平衡时体系压强与反应起始时体系压强的比为
(4)若该反应低温自发,欲增大该反应的K值,可采取的措施有(填序号)
A.降低温度 B.向混合气体中通入Cl2 C.使用高效催化剂 D.升高温度
您最近一年使用:0次
【推荐3】将氮氧化物进行无害化处理对治理大气污染、建设生态文明具有重要意义。
(1)O3的氧化性强于O2,能更有效地氧化NO。已知:
2NO(g)+O2(g)=2NO2(g) ΔH1=-114 kJ·mol-1
2O3(g)=3O2(g) ΔH2=-284 kJ·mol-1
则NO(g)+O3(g)=NO2(g)+O2(g) ΔH3=_______ kJ·mol-1。
(2)在汽车排气管上安装催化转化器,能有效消除尾气对环境的污染:2NO(g)+2CO(g) N2(g)+2CO2(g) △H<0,该反应能自发进行所需的温度条件是
N2(g)+2CO2(g) △H<0,该反应能自发进行所需的温度条件是_______ (填“高温”或“低温”)。
(3)某温度下,在催化剂的作用下发生反应:2NO(g)+2CO(g) N2(g)+2CO2(g),测得密闭容器中不同时间时CO和NO的浓度如表。
N2(g)+2CO2(g),测得密闭容器中不同时间时CO和NO的浓度如表。
①该温度下,达到平衡时NO的转化率为_______ 。
②该温度下,该反应的平衡常数为_______ 。
③恒温恒容条件下,下列能说明该反应达到化学平衡状态的是_______ (填序号)。
a.体系的压强保持不变
b.v(NO)=2v(N2)
c.混合气体的密度不变
d.NO的转化率保持不变
④下列措施能提高该反应中NO平衡转化率的是_______ (填序号)。
a.恒温恒容时,提高CO的浓度
b.恒温恒容时,填充更多的催化剂
c.恒温时,压缩容器的体积
d.将恒温恒容容器改为绝热恒容容器
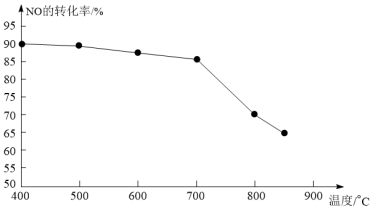
⑤恒容条件下,上述反应中若NO和CO的起始浓度一定,催化反应相同时间,测得NO的转化率随温度的变化如图所示,当温度超过700℃时,随温度的升高,NO的转化率下降明显,原因是_______ 。
(1)O3的氧化性强于O2,能更有效地氧化NO。已知:
2NO(g)+O2(g)=2NO2(g) ΔH1=-114 kJ·mol-1
2O3(g)=3O2(g) ΔH2=-284 kJ·mol-1
则NO(g)+O3(g)=NO2(g)+O2(g) ΔH3=
(2)在汽车排气管上安装催化转化器,能有效消除尾气对环境的污染:2NO(g)+2CO(g)
 N2(g)+2CO2(g) △H<0,该反应能自发进行所需的温度条件是
N2(g)+2CO2(g) △H<0,该反应能自发进行所需的温度条件是(3)某温度下,在催化剂的作用下发生反应:2NO(g)+2CO(g)
 N2(g)+2CO2(g),测得密闭容器中不同时间时CO和NO的浓度如表。
N2(g)+2CO2(g),测得密闭容器中不同时间时CO和NO的浓度如表。| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(CO)/(10-4mol·L-1) | 36.0 | 30.5 | 28.5 | 27.5 | 27.0 | 27.0 |
| c(NO)/(10-4mol·L-1) | 10.0 | 4.5 | 2.5 | 1.5 | 1.0 | 1.0 |
②该温度下,该反应的平衡常数为
③恒温恒容条件下,下列能说明该反应达到化学平衡状态的是
a.体系的压强保持不变
b.v(NO)=2v(N2)
c.混合气体的密度不变
d.NO的转化率保持不变
④下列措施能提高该反应中NO平衡转化率的是
a.恒温恒容时,提高CO的浓度
b.恒温恒容时,填充更多的催化剂
c.恒温时,压缩容器的体积
d.将恒温恒容容器改为绝热恒容容器
⑤恒容条件下,上述反应中若NO和CO的起始浓度一定,催化反应相同时间,测得NO的转化率随温度的变化如图所示,当温度超过700℃时,随温度的升高,NO的转化率下降明显,原因是

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】甲醇(CH3OH)是一种无色液体,在作为内燃机燃料、制作燃料电池等方面具有重要的用途。
(1)已知:2CH3OH(g)+O2(g)⇌2CO2(g)+4H2(g)的能量变化如图所示,下列说法正确的是_______ 。(填字母)
a.该过程是一个吸收能量的过程
b.H2的生成速率与CH3OH的消耗速率之比为1∶2
c.化学反应不仅有新物质生成,同时也一定伴随能量变化
d.2mol甲醇和1mol氧气的总键能大于2mol二氧化碳和4mol氢气的总键能
(2)某温度下,将5molCH3OH和2molO2充入2L的密闭容器中,反应4min后,测得c(O2)=0.4mol/L。则4min内平均反应速率v(H2)=_______ 。
(3)CH3OH燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、氧气和KOH溶液构成。该燃料电池的总反应为CH3OH+O2+KOH=K2CO3+H2O(未配平)。回答下列问题:
①该电池的正极反应物为_______ 。②负极的电极反应式为_______ 。
(4)工业上以CO和H2为原料合成甲醇的反应: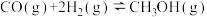 △H
△H
①已知CO(g)、H2(g)的标准燃烧热分别为△H=﹣283kJ·mol﹣1,△H=﹣286kJ·mol﹣1。
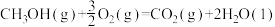 △H=﹣761kJ·mol﹣1
△H=﹣761kJ·mol﹣1
则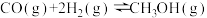 的△H=
的△H=_______ 。
②如图,研究表明,在酸性条件下CO也可通过电化学的方法制备甲醇。
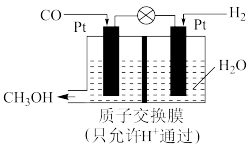
工作时,溶液中H+的移动方向是_______ (填“从左向右”或“从右向左”),产生甲醇的电极反应式为_______ 。
(1)已知:2CH3OH(g)+O2(g)⇌2CO2(g)+4H2(g)的能量变化如图所示,下列说法正确的是

a.该过程是一个吸收能量的过程
b.H2的生成速率与CH3OH的消耗速率之比为1∶2
c.化学反应不仅有新物质生成,同时也一定伴随能量变化
d.2mol甲醇和1mol氧气的总键能大于2mol二氧化碳和4mol氢气的总键能
(2)某温度下,将5molCH3OH和2molO2充入2L的密闭容器中,反应4min后,测得c(O2)=0.4mol/L。则4min内平均反应速率v(H2)=
(3)CH3OH燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、氧气和KOH溶液构成。该燃料电池的总反应为CH3OH+O2+KOH=K2CO3+H2O(未配平)。回答下列问题:
①该电池的正极反应物为
(4)工业上以CO和H2为原料合成甲醇的反应:
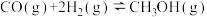 △H
△H①已知CO(g)、H2(g)的标准燃烧热分别为△H=﹣283kJ·mol﹣1,△H=﹣286kJ·mol﹣1。
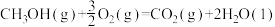 △H=﹣761kJ·mol﹣1
△H=﹣761kJ·mol﹣1则
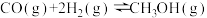 的△H=
的△H=②如图,研究表明,在酸性条件下CO也可通过电化学的方法制备甲醇。

工作时,溶液中H+的移动方向是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】氮的氧化物是大气主要污染物,研究含氮物质间的转化是环境科学的重要课题。
(1)①在恒温恒容的密闭容器中充入1mol 和3mol
和3mol 发生反应生成
发生反应生成 ,下列能说明反应达到平衡状态的是
,下列能说明反应达到平衡状态的是_______ (填标号)。
A.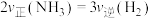 B.容器内压强不变
B.容器内压强不变
C.气体的密度不再改变 D.容器内气体的平均摩尔质量不变
②以 为还原剂,在催化剂作用下选择性地与
为还原剂,在催化剂作用下选择性地与 发生氧化还原反应生成
发生氧化还原反应生成 和
和 。已知:
。已知:
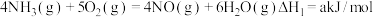
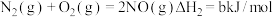
则 与NO反应的热化学方程式
与NO反应的热化学方程式 的
的 =
=_______ kJ/mol(用含a、b的代数式表示)。
(2)已知 的反应历程分两步:
的反应历程分两步:
I. (快平衡)
(快平衡)
Ⅱ.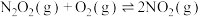 (慢反应)
(慢反应)
决定NO氧化反应速率的步骤是_______ (填“I”或“Ⅱ”)。用 表示的速率方程为
表示的速率方程为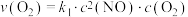 ;用
;用 表示的速率方程为
表示的速率方程为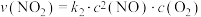 ,
, 与
与 分别表示速率常数(与温度有关),则
分别表示速率常数(与温度有关),则 与
与 的关系为
的关系为_______ 。
(3)将0.2molNO(g)、0.1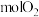 (g)和0.2molHe(g)通入反应器,在温度T、压强
(g)和0.2molHe(g)通入反应器,在温度T、压强 条件下进行反应
条件下进行反应 和
和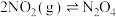 (g)。tmin时达到化学平衡,NO的转化率为60%,且
(g)。tmin时达到化学平衡,NO的转化率为60%,且 与
与 的物质的量相等,则v
的物质的量相等,则v =
=_______ 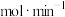 。该温度时,反应
。该温度时,反应 的平衡常数
的平衡常数
_______  (分压=总压×物质的量分数)。
(分压=总压×物质的量分数)。
(4)利用 与
与 反应构成电池,能消除氮氧化物的排放,减轻环境污染,装置如图所示:
反应构成电池,能消除氮氧化物的排放,减轻环境污染,装置如图所示:

①电极B的电极反应式为_______ 。
②当有2.4mol 通过阴离子交换膜时,理论上生成
通过阴离子交换膜时,理论上生成 的体积为
的体积为_______ (标准状况)。
(1)①在恒温恒容的密闭容器中充入1mol
 和3mol
和3mol 发生反应生成
发生反应生成 ,下列能说明反应达到平衡状态的是
,下列能说明反应达到平衡状态的是A.
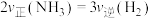 B.容器内压强不变
B.容器内压强不变C.气体的密度不再改变 D.容器内气体的平均摩尔质量不变
②以
 为还原剂,在催化剂作用下选择性地与
为还原剂,在催化剂作用下选择性地与 发生氧化还原反应生成
发生氧化还原反应生成 和
和 。已知:
。已知: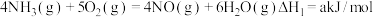
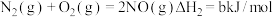
则
 与NO反应的热化学方程式
与NO反应的热化学方程式 的
的 =
=(2)已知
 的反应历程分两步:
的反应历程分两步:I.
 (快平衡)
(快平衡)Ⅱ.
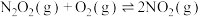 (慢反应)
(慢反应)决定NO氧化反应速率的步骤是
 表示的速率方程为
表示的速率方程为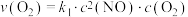 ;用
;用 表示的速率方程为
表示的速率方程为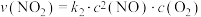 ,
, 与
与 分别表示速率常数(与温度有关),则
分别表示速率常数(与温度有关),则 与
与 的关系为
的关系为(3)将0.2molNO(g)、0.1
 (g)和0.2molHe(g)通入反应器,在温度T、压强
(g)和0.2molHe(g)通入反应器,在温度T、压强 条件下进行反应
条件下进行反应 和
和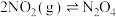 (g)。tmin时达到化学平衡,NO的转化率为60%,且
(g)。tmin时达到化学平衡,NO的转化率为60%,且 与
与 的物质的量相等,则v
的物质的量相等,则v =
=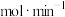 。该温度时,反应
。该温度时,反应 的平衡常数
的平衡常数
 (分压=总压×物质的量分数)。
(分压=总压×物质的量分数)。(4)利用
 与
与 反应构成电池,能消除氮氧化物的排放,减轻环境污染,装置如图所示:
反应构成电池,能消除氮氧化物的排放,减轻环境污染,装置如图所示:
①电极B的电极反应式为
②当有2.4mol
 通过阴离子交换膜时,理论上生成
通过阴离子交换膜时,理论上生成 的体积为
的体积为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】Ⅰ.红磷在氯气中燃烧的能量变化关系如图所示。
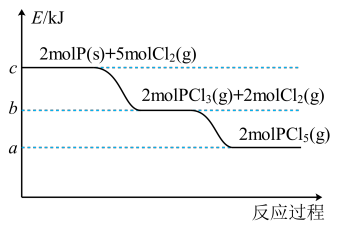
(1)根据图中信息,反应PCl3(g)+Cl2(g)=PCl5(g)_______ (填“放出”或“吸收”)_______ kJ热量。
(2)SiH4是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和液态H2O。已知室温下1 g SiH4自燃放出热量a kJ。SiH4自燃的热化学方程式为_______ 。
Ⅱ.航天飞机常采用新型燃料电池作为电能来源,燃料电池一般指采用H2、CH4、CO、C2H5OH等可燃物质与O2一起构成的电池装置,它可直接将化学能转化为电能,该电池以KOH溶液为电解质,其总反应的化学方程式为CH4+2O2+2OH-= +3H2O
+3H2O
(3)负极上的电极反应为_______ 。
(4)消耗标准状况下5.6LO2时,有_______  电子发生转移。
电子发生转移。
(5)开始放电时,正极附近溶液的pH_______ (填“增大”、“减小”或“不变”)。
(6)用该燃料电池作为电能来源,用石墨电极电解硫酸铜溶液,阳极发生的电极反应式为_______ 。

(1)根据图中信息,反应PCl3(g)+Cl2(g)=PCl5(g)
(2)SiH4是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和液态H2O。已知室温下1 g SiH4自燃放出热量a kJ。SiH4自燃的热化学方程式为
Ⅱ.航天飞机常采用新型燃料电池作为电能来源,燃料电池一般指采用H2、CH4、CO、C2H5OH等可燃物质与O2一起构成的电池装置,它可直接将化学能转化为电能,该电池以KOH溶液为电解质,其总反应的化学方程式为CH4+2O2+2OH-=
 +3H2O
+3H2O(3)负极上的电极反应为
(4)消耗标准状况下5.6LO2时,有
 电子发生转移。
电子发生转移。(5)开始放电时,正极附近溶液的pH
(6)用该燃料电池作为电能来源,用石墨电极电解硫酸铜溶液,阳极发生的电极反应式为
您最近一年使用:0次



