发展洁净煤技术、利用CO2制备清洁能源等都是实现减碳排放的重要途径。
(1)将煤转化成水煤气的反应:C(s)+H2O(g)⇌CO(g)+H2(g)可有效提高能源利用率,若在上述反应体系中加入催化剂(其他条件保持不变),此反应的△H______ (填“增大”、“减小”或“不变”),判断的理由是________ 。
(2)CO2制备甲醇:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)ΔH=-49.0 kJ·mol-1,在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,测得CO2(g)和CH3OH(g)浓度随时间变化如图所示。
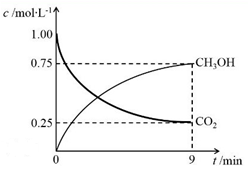
①该反应化学平衡常数K的表达式是____________________ 。
②0~9min时间内,该反应的平均反应速率ν(H2) =_______ 。
③在相同条件下,密闭容器的体积缩小至0.5 L时,此反应达平衡时放出的热量(Q)可能是________ (填字母序号)kJ。
a. 0< Q <29.5 b. 29.5< Q <36.75 c. 36.75< Q <49 d. 49< Q <98
④在一定条件下,体系中CO2的平衡转化率(α)与L和 X的关系如图所示,L和X分别表示温度或压强。
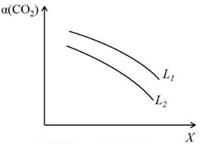
i. X表示的物理量是:_____________ 。
ii. 判断L1与L2的大小关系,并简述理由:_______________________ 。
(1)将煤转化成水煤气的反应:C(s)+H2O(g)⇌CO(g)+H2(g)可有效提高能源利用率,若在上述反应体系中加入催化剂(其他条件保持不变),此反应的△H
(2)CO2制备甲醇:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)ΔH=-49.0 kJ·mol-1,在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,测得CO2(g)和CH3OH(g)浓度随时间变化如图所示。

①该反应化学平衡常数K的表达式是
②0~9min时间内,该反应的平均反应速率ν(H2) =
③在相同条件下,密闭容器的体积缩小至0.5 L时,此反应达平衡时放出的热量(Q)可能是
a. 0< Q <29.5 b. 29.5< Q <36.75 c. 36.75< Q <49 d. 49< Q <98
④在一定条件下,体系中CO2的平衡转化率(α)与L和 X的关系如图所示,L和X分别表示温度或压强。

i. X表示的物理量是:
ii. 判断L1与L2的大小关系,并简述理由:
更新时间:2017-07-21 16:14:37
|
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】(1)25℃,有pH=12的氢氧化钠溶液100mL,要使它的pH降为11.应加蒸馏水的体积为________ mL;若加pH=10的氢氧化钠溶液,应加________ mL.
(2)某温度下,纯水的c(H+)=3×10﹣7mol/L,Na2S和NaOH两溶液的pH均为12,则两溶液中由水电离出的c(OH﹣)的比值为________ .
(3)已知 Na2SO4(s)+4H2(g)⇌Na2S(s)+4H2O(g)该温度下,在2L盛有2.84g Na2SO4的密闭容器中通入H2气体,10分钟后测得固体质量为2.264g.则10分钟内H2的平均反应速率为________ .
(2)某温度下,纯水的c(H+)=3×10﹣7mol/L,Na2S和NaOH两溶液的pH均为12,则两溶液中由水电离出的c(OH﹣)的比值为
(3)已知 Na2SO4(s)+4H2(g)⇌Na2S(s)+4H2O(g)该温度下,在2L盛有2.84g Na2SO4的密闭容器中通入H2气体,10分钟后测得固体质量为2.264g.则10分钟内H2的平均反应速率为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】一定条件下,在体积为3L的密闭容器中化学反应CO(g)+2H2(g) CH3OH(g)达到平衡状态。
CH3OH(g)达到平衡状态。
(1)该反应的平衡常数表达式K=______ ;根据图,升高温度,K值将______ (填“增大”“减小”或“不变”)。

(2)500℃时,从反应开始达到化学平衡,以H2的浓度变化表示的化学反应速率是______ (用nB、tB表示)。
(3)判断该可逆反应达到化学平衡状态的标志是_________ (填字母,下同)。
a.v生成(CH3OH)=v消耗(CO)
b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变
d.CO、H2、CH3OH的浓度之比为1:2:1
(4)300℃时,将容器的容积压缩到原来的 ,在其他条件不变的情况下,对平衡体系产生的影响是
,在其他条件不变的情况下,对平衡体系产生的影响是______ (填字母)。
a.c(H2)减小
b.正反应速率加快,逆反应速率减慢
c.CH3OH的物质的量增加
d.重新平衡时 减小
减小
 CH3OH(g)达到平衡状态。
CH3OH(g)达到平衡状态。(1)该反应的平衡常数表达式K=

(2)500℃时,从反应开始达到化学平衡,以H2的浓度变化表示的化学反应速率是
(3)判断该可逆反应达到化学平衡状态的标志是
a.v生成(CH3OH)=v消耗(CO)
b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变
d.CO、H2、CH3OH的浓度之比为1:2:1
(4)300℃时,将容器的容积压缩到原来的
 ,在其他条件不变的情况下,对平衡体系产生的影响是
,在其他条件不变的情况下,对平衡体系产生的影响是a.c(H2)减小
b.正反应速率加快,逆反应速率减慢
c.CH3OH的物质的量增加
d.重新平衡时
 减小
减小
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】利用化学反应原理分析指导工业生产具有重要的现实意义。工业合成氨的反应原理为:
 ,一定温度下在容积为4L的恒容密闭容器中通入
,一定温度下在容积为4L的恒容密闭容器中通入 和
和 发生反应。
发生反应。
(1)下列能说明该反应达到平衡状态的是_______。(填字母)
(2)以上反应的平衡常数K与温度T的关系如表所示:
①写出平衡常数K的表达式:_______ 。
②比较 、
、 的大小,
的大小,
_______  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(3)5min时反应达到平衡状态,此时 的物质的量为1.6mol,求:
的物质的量为1.6mol,求:
①达平衡时 的转化率为
的转化率为_______ ,0~5min内该反应的平均速率
_______ 。
②相同条件下,改变反应物的起始通入量,某时刻测得 、
、 、
、 的物质的量分别为2mol、3.6mol、2mol,则此时反应
的物质的量分别为2mol、3.6mol、2mol,则此时反应
_______  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(4)平衡后,若要提高 的转化率,可以采取的措施有_______(填字母)。
的转化率,可以采取的措施有_______(填字母)。

 ,一定温度下在容积为4L的恒容密闭容器中通入
,一定温度下在容积为4L的恒容密闭容器中通入 和
和 发生反应。
发生反应。(1)下列能说明该反应达到平衡状态的是_______。(填字母)
| A.容器内压强不再变化 | B.每消耗1mol氮气的同时,生成2mol氨气 |
C. | D.容器内气体总质量不再变化 |
| T/℃ | 200 | 300 |
| K |  |  |
②比较
 、
、 的大小,
的大小,
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。(3)5min时反应达到平衡状态,此时
 的物质的量为1.6mol,求:
的物质的量为1.6mol,求:①达平衡时
 的转化率为
的转化率为
②相同条件下,改变反应物的起始通入量,某时刻测得
 、
、 、
、 的物质的量分别为2mol、3.6mol、2mol,则此时反应
的物质的量分别为2mol、3.6mol、2mol,则此时反应
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。(4)平衡后,若要提高
 的转化率,可以采取的措施有_______(填字母)。
的转化率,可以采取的措施有_______(填字母)。| A.加入催化剂 | B.增大容器容积 |
| C.降低反应体系的温度 | D.加入一定量 |
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】一定条件下,在2L的密闭容器中充入1molA和3molB,发生如下反应:aA(g)+bB(g)⇌cC(?)+dD(g)ΔH。达到平衡后,测得A减少了0.5mol,B的物质的量浓度为0.75mol•L﹣1,C的物质的量为1mol,v(B):v(D)=3:2,请回答下列问题:
(1)a:b:c:d=_____ 。
(2)增大压强至原来的2倍,D的物质的量不发生变化,则C为_____ 态(填“固”、“液”或“气”),当增大压强至原来的10倍,D的物质的量增大,则可能的原因是_____ 。
(3)升高温度,D的物质的量浓度增大,则ΔH_____ 0.(填“>”“<”或“=”)
(4)保持体积不变,且反应体系中各物质均为气态时,若再加入10molA,则A的转化率_____ (填“增大”、“减小”或“不变”,下同),C的体积分数_____ 。保持体积不变,若再加入10molAr,则A的正反应速率_____ ,混合气体的密度_____ 。
(5)在恒容、绝热的密闭容器中,反应体系中各物质均为气态时,下列情况不能说明该反应已达到平衡状态的是_____。(填正确答案标号)
(1)a:b:c:d=
(2)增大压强至原来的2倍,D的物质的量不发生变化,则C为
(3)升高温度,D的物质的量浓度增大,则ΔH
(4)保持体积不变,且反应体系中各物质均为气态时,若再加入10molA,则A的转化率
(5)在恒容、绝热的密闭容器中,反应体系中各物质均为气态时,下列情况不能说明该反应已达到平衡状态的是_____。(填正确答案标号)
| A.平衡常数不再变化 |
| B.混合气体的平均相对分子质量不再改变 |
| C.压强不再变化 |
| D.v正(A):v逆(D)=1:2 |
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】已知可逆反应:M(g)+N(g) ⇌ P(g)+Q(g) ΔH>0,请回答下列问题:
(1)在某温度下,反应物的起始浓度分别为c(M)=1mol·L-1,c(N)=2.4mol·L-1;达到平衡后,M的转化率为60%,此时N的转化率为_______ 。
(2)该温度下,反应的K值为_______ 。
(3)若反应温度升高,M的转化率_______ (填“增大”“减小”或“不变”)。
(4)若反应温度不变,反应物的起始浓度分别为c(M)=4mol·L-1,c(N)=a mol·L-1;达到平衡后,c(P)=2mol·L-1,a=_______ 。
(1)在某温度下,反应物的起始浓度分别为c(M)=1mol·L-1,c(N)=2.4mol·L-1;达到平衡后,M的转化率为60%,此时N的转化率为
(2)该温度下,反应的K值为
(3)若反应温度升高,M的转化率
(4)若反应温度不变,反应物的起始浓度分别为c(M)=4mol·L-1,c(N)=a mol·L-1;达到平衡后,c(P)=2mol·L-1,a=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】煤的液化是把固体煤炭通过化学加工过程,使其转化成为液体燃料、化工原料和产品的先进洁净煤技术,其中合成CH3OH 是最重要的研究方向之一。
(1)在2L密闭容器中,由CO2和H2合成甲醇CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),在其他条件不变的情况下,探究温度对反应的影响,实验结果如下图所示:
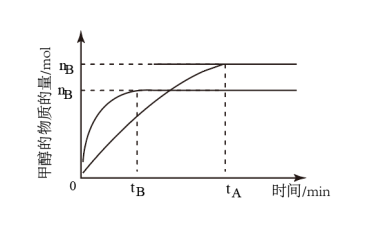
①T1_______ T2(填“>”“<”或“=”),△H_______ 0(填“>”“<”或“=”)
②温度为T2时,从反应开始到平衡,甲醇的平均反应速率为_______ mol·L-1·min-1。
③下列情形能说明上述反应已达到平衡状态的是_______
a.体系压强保持不变
b.密闭容器中CO2、H2、CH3OH、H2O四种气体共存
c.CH3OH与H2物质的量之比为1∶3
d.每消耗1 mol CO2的同时生成3molH2
(2)在容积可变的密闭容器中,由CO和H2合成甲醇CO(g)+2H2(g)⇌CH3OH(g),CO在不同温度下的平衡转化率与压强的关系如下图所示。

该反应的平衡常数表达式为K=_______ ,250℃、0.5×104kPa下的平衡常数 _______ 300℃、0.5×104kPa下的平衡常数(填“>”、“<”或“=”)。
(1)在2L密闭容器中,由CO2和H2合成甲醇CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),在其他条件不变的情况下,探究温度对反应的影响,实验结果如下图所示:

①T1
②温度为T2时,从反应开始到平衡,甲醇的平均反应速率为
③下列情形能说明上述反应已达到平衡状态的是
a.体系压强保持不变
b.密闭容器中CO2、H2、CH3OH、H2O四种气体共存
c.CH3OH与H2物质的量之比为1∶3
d.每消耗1 mol CO2的同时生成3molH2
(2)在容积可变的密闭容器中,由CO和H2合成甲醇CO(g)+2H2(g)⇌CH3OH(g),CO在不同温度下的平衡转化率与压强的关系如下图所示。

该反应的平衡常数表达式为K=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】工业上用CO和H2反应制备二甲醚(CH3OCH3)的条件是压强2.0~10.0 MPa,温度300 ℃。设备中进行如下反应。
①CO(g)+2H2(g) CH3OH(g) ΔH=-90.7 kJ/mol
CH3OH(g) ΔH=-90.7 kJ/mol
②2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ/mol
CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ/mol
③CO(g)+H2O(g) CO2(g)+H2(g) ΔH=-41.2 kJ/mol
CO2(g)+H2(g) ΔH=-41.2 kJ/mol
请回答下列问题:
(1)在温度和容器容积不变的条件下发生反应①,能说明该反应达到平衡状态的依据是_______ 。
a.容器中压强保持不变
b. 混合气体中c(CO)不变
c.混合气体的平均相对分子质量不变
d.v正(CO)=v逆(H2)
(2)在容积为2 L的恒温密闭容器中加入a mol CH3OH(g)发生反应②,达到平衡后若再加入a mol CH3OH(g)重新达到平衡时,CH3OH的转化率_______ (填“增大”“减小”或“不变”)。
(3)850 ℃时在一容积为10 L的密闭容器中通入一定量的CO和H2O(g)发生反应③,CO和H2O(g)浓度变化如图所示。
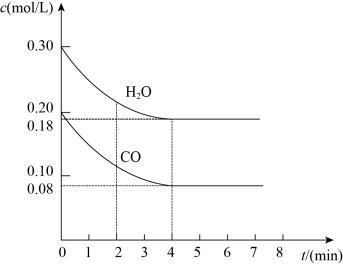
①0~4 min的平均反应速率v(CO)=_______ 。
②若温度不变,向该容器中加入4 mol CO(g)、2 mol H2O(g)、3 mol CO2(g)和3 mol H2(g),起始时v正(CO)_______ v逆(H2)(填“<”“>”或“=”),请结合必要的计算过程说明理由: _______ 。
①CO(g)+2H2(g)
 CH3OH(g) ΔH=-90.7 kJ/mol
CH3OH(g) ΔH=-90.7 kJ/mol②2CH3OH(g)
 CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ/mol
CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ/mol③CO(g)+H2O(g)
 CO2(g)+H2(g) ΔH=-41.2 kJ/mol
CO2(g)+H2(g) ΔH=-41.2 kJ/mol请回答下列问题:
(1)在温度和容器容积不变的条件下发生反应①,能说明该反应达到平衡状态的依据是
a.容器中压强保持不变
b. 混合气体中c(CO)不变
c.混合气体的平均相对分子质量不变
d.v正(CO)=v逆(H2)
(2)在容积为2 L的恒温密闭容器中加入a mol CH3OH(g)发生反应②,达到平衡后若再加入a mol CH3OH(g)重新达到平衡时,CH3OH的转化率
(3)850 ℃时在一容积为10 L的密闭容器中通入一定量的CO和H2O(g)发生反应③,CO和H2O(g)浓度变化如图所示。

①0~4 min的平均反应速率v(CO)=
②若温度不变,向该容器中加入4 mol CO(g)、2 mol H2O(g)、3 mol CO2(g)和3 mol H2(g),起始时v正(CO)
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】工业上采用高温分解H2S制取氢气,其反应为2H2S(g) 2H2(g)+S2(g),在膜反应器中分离出H2。
2H2(g)+S2(g),在膜反应器中分离出H2。
(1)在密闭容器中,充入0.10molH2S(g),发生反应2H2S(g) 2H2(g)+S2(g),控制不同的温度和压强进行实验,结果如图。
2H2(g)+S2(g),控制不同的温度和压强进行实验,结果如图。

图中压强p1、p2、p3由大到小的顺序为___ 。
(2)若容器的容积为2.0L,则压强为p3,温度为950℃时,反应经3h达到平衡,化学反应速率v(S2)=___ 。
(3)若压强p2=7.2MPa、温度为975℃时,该反应的平衡常数Kp=__ (用平衡分压代替平衡浓度,分压=总压×物质的量分数,结果保留两位有效数字)。
 2H2(g)+S2(g),在膜反应器中分离出H2。
2H2(g)+S2(g),在膜反应器中分离出H2。(1)在密闭容器中,充入0.10molH2S(g),发生反应2H2S(g)
 2H2(g)+S2(g),控制不同的温度和压强进行实验,结果如图。
2H2(g)+S2(g),控制不同的温度和压强进行实验,结果如图。
图中压强p1、p2、p3由大到小的顺序为
(2)若容器的容积为2.0L,则压强为p3,温度为950℃时,反应经3h达到平衡,化学反应速率v(S2)=
(3)若压强p2=7.2MPa、温度为975℃时,该反应的平衡常数Kp=
您最近一年使用:0次
【推荐3】T℃时,将3molA和2molB气体通入体积为2L的密闭容器中(容积不变),发生如下反应:3A(气)+B(气)  xC(气),2min时反应达到平衡状态(温度不变),剩余1.8molB,并测得C的浓度为O.4mol/L,请填写下列空白:
xC(气),2min时反应达到平衡状态(温度不变),剩余1.8molB,并测得C的浓度为O.4mol/L,请填写下列空白:
(1)反应达到平衡时,A、B两反应物的转化率之比为α(A):α(B)=___________ 。
(2)若继续向原平衡混合物的容器中通入少量氦气(氦气和A、B、C都不反应)后,下列说法中正确的是__ (填写字母序号)。
A.化学平衡向正反应方向移动 B.化学平衡向逆反应方向移动
C.化学平衡不会发生移动 D.正、逆反应的化学反应速率保持不变
(3)在T℃时,若向原平衡混合物的容器中再充入amolC,欲使达到新的平衡时,各物质的物质的量分数与原平衡相同,则至少应再充入__________ (填A或B)________ mol(用a表示)。
 xC(气),2min时反应达到平衡状态(温度不变),剩余1.8molB,并测得C的浓度为O.4mol/L,请填写下列空白:
xC(气),2min时反应达到平衡状态(温度不变),剩余1.8molB,并测得C的浓度为O.4mol/L,请填写下列空白:(1)反应达到平衡时,A、B两反应物的转化率之比为α(A):α(B)=
(2)若继续向原平衡混合物的容器中通入少量氦气(氦气和A、B、C都不反应)后,下列说法中正确的是
A.化学平衡向正反应方向移动 B.化学平衡向逆反应方向移动
C.化学平衡不会发生移动 D.正、逆反应的化学反应速率保持不变
(3)在T℃时,若向原平衡混合物的容器中再充入amolC,欲使达到新的平衡时,各物质的物质的量分数与原平衡相同,则至少应再充入
您最近一年使用:0次
【推荐1】某校课外活动小组利用NO2与N2O4的反应来探究温度对化学平衡的影响。已知:2NO2(g) N2O4(g) ΔH=-52.7kJ·mol-1
N2O4(g) ΔH=-52.7kJ·mol-1
(1)该化学反应的平衡常数表达式为___________ 。
(2)该小组的同学取了两个烧瓶A和B,分别加入相同浓度的NO2与N2O4的混合气体,中间用夹子夹紧,并将A和B浸入到已盛有水的两个水槽中(如下图所示),然后分别向两个水槽中加入热水和冰块。

请回答:
①A中的现象为___________ 。
②由上述实验现象可知,降低温度,该反应化学平衡向___________ (填“正”或“逆”)反应方向移动。
③升高温度,该反应的化学平衡常数将___________ (填“增大”“减小”或“不变”)。
 N2O4(g) ΔH=-52.7kJ·mol-1
N2O4(g) ΔH=-52.7kJ·mol-1(1)该化学反应的平衡常数表达式为
(2)该小组的同学取了两个烧瓶A和B,分别加入相同浓度的NO2与N2O4的混合气体,中间用夹子夹紧,并将A和B浸入到已盛有水的两个水槽中(如下图所示),然后分别向两个水槽中加入热水和冰块。

请回答:
①A中的现象为
②由上述实验现象可知,降低温度,该反应化学平衡向
③升高温度,该反应的化学平衡常数将
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】2L密闭容器中,有下列反应体系:2NO(g)+O2(g)⇌2NO2(g)。
(1)将amol NO和bmol O2发生反应,要使反应达到平衡后反应物的物质的量和生成物的物质的量相等,则 的取值范围是
的取值范围是_____ 。
a.0< <
< b.
b. <
< <1 c.
<1 c. <
< <4 d.1<
<4 d.1< <
<
(2)某温度时,按物质的量比2:1充入NO和O2开始反应,n(NO)随时间的变化如表:
写出该反应的平衡常数表达式:K=_____ 。0~1s内以O2浓度变化表示的正反应速率_____ 0~5s内以NO浓度变化表示的正反应速率(选填“小于”、“大于”、“等于”、“无法确定”)。
(3)能说明该反应已达到平衡状态的是_____ 。
a.气体颜色不再变化 b.容器内压强保持不变 c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)已知:K300℃>K350℃,能使该反应的反应速率增大且平衡向正反应方向移动的是_______ 。
a.及时分离出NO2气体 b.适当升高温度 c.增大O2的浓度 d.选择高效催化剂
(1)将amol NO和bmol O2发生反应,要使反应达到平衡后反应物的物质的量和生成物的物质的量相等,则
 的取值范围是
的取值范围是a.0<
 <
< b.
b. <
< <1 c.
<1 c. <
< <4 d.1<
<4 d.1< <
<
(2)某温度时,按物质的量比2:1充入NO和O2开始反应,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
写出该反应的平衡常数表达式:K=
(3)能说明该反应已达到平衡状态的是
a.气体颜色不再变化 b.容器内压强保持不变 c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)已知:K300℃>K350℃,能使该反应的反应速率增大且平衡向正反应方向移动的是
a.及时分离出NO2气体 b.适当升高温度 c.增大O2的浓度 d.选择高效催化剂
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】工业上可利用CH4还原NO减少氮氧化物的排放。向2L恒容密闭容器中通入2molCH4(g)、4molNO(g),发生 反应,测得CH4的物质的量随时间变化如表,回答问题
反应,测得CH4的物质的量随时间变化如表,回答问题
(1)写出该反应的化学平衡常数表达式______
(2)0~10min内,用H2O表示该反应的平均反应速率为______ 。30min时,CO2的物质的量浓度为______  。
。
(3)平衡时,N2的体积分数为______ 。
(4)下列措施能够加快该反应速率的是______(填编号)。
 反应,测得CH4的物质的量随时间变化如表,回答问题
反应,测得CH4的物质的量随时间变化如表,回答问题| 时间/min | 0 | 10 | 20 | 30 | 40 | 50 |
| n(CH4)/mol | 2 | 1.7 | 1.5 | 1.35 | 1.25 | 1.25 |
(2)0~10min内,用H2O表示该反应的平均反应速率为
 。
。(3)平衡时,N2的体积分数为
(4)下列措施能够加快该反应速率的是______(填编号)。
| A.使用催化剂 | B.降低温度 | C.及时分离水 | D.压缩体积 |
您最近一年使用:0次



