草酸和高锰酸钾能发生反应: 2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
Ⅰ.某小组同学探究草酸浓度对反应速率的影响时,设计了如下系列实验:
(1)V1=___________ ; V2=___________ 。
(2)褪色时间t1、t2、t3由长到短的顺序为____________________ 。
Ⅱ.在探究浓度对速率的影响时,同学们发现溶液褪色先慢后快,即反应速率由小变大。大家对此“异常”现象展开了讨论,根据外界条件对速率的影响进行分析,猜想造成这种现象的最可能原因有两种,并为此设计实验进行探究验证。
猜想Ⅰ:此反应过程放热,温度升高,反应速率加快;
猜想Ⅱ:……。
(1)要完成对猜想Ⅰ的实验验证,至少还需要一种实验仪器是___________ 。
(2)猜想Ⅱ可能是______________________ 。要设计实验验证猜想Ⅱ,进行该实验还要补充的一种试剂是___________ 。
Ⅰ.某小组同学探究草酸浓度对反应速率的影响时,设计了如下系列实验:
| 实验序号 | KMnO4酸性洛液 | H2C2O4溶液 | H2O | 褪色时间 | ||
| V/mL | c/(mol/L) | V/mL | c/(mol/L) | V/mL | ||
| ① | 10.0 | 0.01 | 5.0 | 0.50 | V1 | t1 |
| ② | 10.0 | 0.01 | V2 | 0.50 | 2.0 | t2 |
| ③ | 10.0 | 0.01 | 10.0 | 0.50 | 0 | t3 |
(2)褪色时间t1、t2、t3由长到短的顺序为
Ⅱ.在探究浓度对速率的影响时,同学们发现溶液褪色先慢后快,即反应速率由小变大。大家对此“异常”现象展开了讨论,根据外界条件对速率的影响进行分析,猜想造成这种现象的最可能原因有两种,并为此设计实验进行探究验证。
猜想Ⅰ:此反应过程放热,温度升高,反应速率加快;
猜想Ⅱ:……。
(1)要完成对猜想Ⅰ的实验验证,至少还需要一种实验仪器是
(2)猜想Ⅱ可能是
更新时间:2017-08-20 09:08:35
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应率的影响。设计实验如表(所取溶液体积均为5mL):
(1)其他条件不变时:探究温度对化学反应速率的影响,应选择__________ (填实验编号)。
(2)Na2S2O3和H2SO4反应的离子方程式为__________ 。
(3)若实验①中加入反应物各5mL后加入10mL水,出现浑浊的时间为t1,实验②中加入反应物各5mL后加入30mL水,出现浑浊的时间为t2,则t1__________ t2 (选填“>”、“<”或“=”)。
| 实验编号 | 实验温度/℃ | c (Na2S2O3)/mol·L-1 | c(H2SO4)/mol·L-1 |
| ① | 25 | 0.1 | 0.1 |
| ② | 25 | 0.2 | 0.2 |
| ③ | 50 | 0.2 | 0.1 |
| ④ | 50 | 0.1 | 0.1 |
(1)其他条件不变时:探究温度对化学反应速率的影响,应选择
(2)Na2S2O3和H2SO4反应的离子方程式为
(3)若实验①中加入反应物各5mL后加入10mL水,出现浑浊的时间为t1,实验②中加入反应物各5mL后加入30mL水,出现浑浊的时间为t2,则t1
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐2】某校化学课外兴趣小组为了探究影响化学反应速率的因素,做了以下实验。
用三支试管各取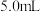 、
、 的酸性
的酸性 溶液,再分别滴入
溶液,再分别滴入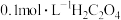 溶液,实验报告如下。
溶液,实验报告如下。
分析实验设计方案和表格中的数据,完成下面的问题:
(1)实验 、
、 研究的是
研究的是___________ 对反应速率的影响。
(2)表中
___________  。
。
(3)实验3用 表示的反应速率为
表示的反应速率为___________ 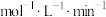 。
。
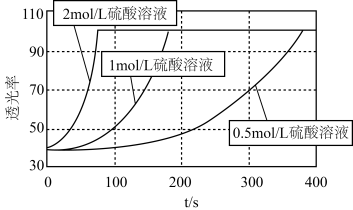
(4)研究发现 溶液的酸化程度对反应的速率也有较大影响,用不同浓度的硫酸进行酸化,其余条件均相同时,测得反应溶液的透光率(溶液颜色越浅,透光率越高)随时间变化如图所示,由此得出的结论是
溶液的酸化程度对反应的速率也有较大影响,用不同浓度的硫酸进行酸化,其余条件均相同时,测得反应溶液的透光率(溶液颜色越浅,透光率越高)随时间变化如图所示,由此得出的结论是___________ 。
用三支试管各取
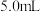 、
、 的酸性
的酸性 溶液,再分别滴入
溶液,再分别滴入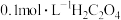 溶液,实验报告如下。
溶液,实验报告如下。| 实验编号 |  酸性 酸性 溶液 溶液 |   溶液 溶液 | 水 | 反应温度/℃ | 溶液颜色褪至无色所需时间/s |
| 1 | 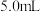 | 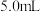 | 0 | 20 | 125 |
| 2 | 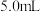 |  | 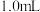 | 20 | 320 |
| 3 | 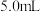 | 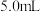 | 0 | 50 | 30 |
(1)实验
 、
、 研究的是
研究的是(2)表中

 。
。(3)实验3用
 表示的反应速率为
表示的反应速率为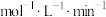 。
。(4)研究发现
 溶液的酸化程度对反应的速率也有较大影响,用不同浓度的硫酸进行酸化,其余条件均相同时,测得反应溶液的透光率(溶液颜色越浅,透光率越高)随时间变化如图所示,由此得出的结论是
溶液的酸化程度对反应的速率也有较大影响,用不同浓度的硫酸进行酸化,其余条件均相同时,测得反应溶液的透光率(溶液颜色越浅,透光率越高)随时间变化如图所示,由此得出的结论是
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐3】碘及其化合物在生产生活中有重要作用。
(1)单质碘可与氢气反应生成碘化氢。将物质的量比为 2:1 的氢气和碘蒸气放入密闭容器中进行反应:H2(g)+I2(g)=2HI(g),反应经过 5 分钟测得碘化氢的浓度为 0.1mol·L-1,碘蒸气的浓度为 0.05mol·L-1。
①前 5 分钟平均反应速率 v(H2)=_______ ,H2的初始浓度是_______ 。
②下列能说明反应已达平衡状态的是_______ (填序号)。
a.氢气的生成速率等于碘化氢的消耗速率
b.单位时间内断裂的 H-H 键数目与断裂的 H-I 键数目相等
c.c(H2):c(I2):c(HI)=1:1:2
d.2v(I2)正=v(HI)逆
e.反应混合体系的颜色不再发生变化
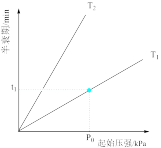
(2)已知:2N2O=2N2 +O2,不同温度(T)下,N2O 分解半衰期随起始压强的变化关系如图所示( 图中半衰期指任一浓度 N2O消耗一半时所需的相应时间) ,则 T1_______ T2(填“>”、“=”或“<”)。当温度为 T1、起始压强为p0,反应至 t1min 时,此时体系压强 p=_______ (用 p0 表示)。
(3)某小组同学在室温下进行“碘钟实验”:将浓度均为 0.01mol·L-1的 H2O2、H2SO4、HI、Na2S2O3溶液及淀粉混合,一定时间后溶液变为蓝色。
已知:“碘钟实验”的总反应的离子方程式为 H2O2+2S2O +2H+=S4O
+2H+=S4O +2H2O
+2H2O
反应分两步进行:
反应 A:……反应 B:I2+2S2O =2I-+S4O
=2I-+S4O
①反应 A 的离子方程式是_______ 。对于总反应,I-的作用是_______
②为探究溶液变蓝快慢的影响因素,进行实验 Ⅰ、Ⅱ(溶液浓度均为 0.01mol·L-1)。
溶液从混合时的无色变为蓝色的时间:实验 Ⅰ是 30min、实验 Ⅱ是 40min。实验Ⅱ中,x、y、z 所对成的数值分别是_______ ;对比实验 Ⅰ、Ⅱ,可得出的实验结论是________
(1)单质碘可与氢气反应生成碘化氢。将物质的量比为 2:1 的氢气和碘蒸气放入密闭容器中进行反应:H2(g)+I2(g)=2HI(g),反应经过 5 分钟测得碘化氢的浓度为 0.1mol·L-1,碘蒸气的浓度为 0.05mol·L-1。
①前 5 分钟平均反应速率 v(H2)=
②下列能说明反应已达平衡状态的是
a.氢气的生成速率等于碘化氢的消耗速率
b.单位时间内断裂的 H-H 键数目与断裂的 H-I 键数目相等
c.c(H2):c(I2):c(HI)=1:1:2
d.2v(I2)正=v(HI)逆
e.反应混合体系的颜色不再发生变化
(2)已知:2N2O=2N2 +O2,不同温度(T)下,N2O 分解半衰期随起始压强的变化关系如图所示( 图中半衰期指任一浓度 N2O消耗一半时所需的相应时间) ,则 T1

(3)某小组同学在室温下进行“碘钟实验”:将浓度均为 0.01mol·L-1的 H2O2、H2SO4、HI、Na2S2O3溶液及淀粉混合,一定时间后溶液变为蓝色。
已知:“碘钟实验”的总反应的离子方程式为 H2O2+2S2O
 +2H+=S4O
+2H+=S4O +2H2O
+2H2O反应分两步进行:
反应 A:……反应 B:I2+2S2O
 =2I-+S4O
=2I-+S4O
①反应 A 的离子方程式是
②为探究溶液变蓝快慢的影响因素,进行实验 Ⅰ、Ⅱ(溶液浓度均为 0.01mol·L-1)。
| 试剂 用量(mL) 序号 | H2O2溶液 | H2SO4溶液 | Na2S2O3溶液 | KI 溶液(含淀粉) | H2O |
| 实验 Ⅰ | 5 | 4 | 8 | 3 | 0 |
| 实验 Ⅱ | 5 | 2 | x | y | z |
您最近一年使用:0次
【推荐1】九天揽月探广寒,嫦娥携宝返神舟,我国探月工程取得重大成果。高氯酸铵( )是运载火箭推进剂的重要成分,其在一定条件下分解产生
)是运载火箭推进剂的重要成分,其在一定条件下分解产生 (g)和
(g)和 、
、 、
、 。三种单质气体。
。三种单质气体。
(1)某研究小组在实验室设计如下装置检验高氯酸铵分解的产物。该小组连接好装置后,检查装置的气密性,装入试剂,通干燥的惰性气体排尽装置内的空气,将导管末端移入盛满水的试管,通入气体产物。(已知:焦性没食子酸溶液可吸收氧气)
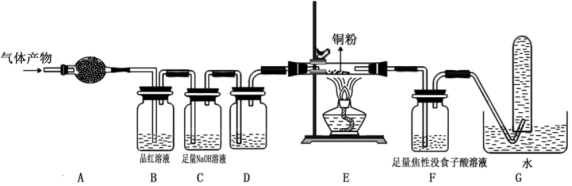
①装置A用于检验分解产物中的 (g),则A中盛放的试剂为
(g),则A中盛放的试剂为_______ 。
②品红溶液的作用是_______ ,E装置硬质玻璃管中的现象是_______ 。
③G装置试管中收集到的气体是_______ 。
(2)研究小组通过甲醛(HCHO)法测定某样品中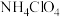 的质量分数。已知:
的质量分数。已知: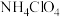 的相对分子质量为117.5;
的相对分子质量为117.5; 与甲醛反应的离子方程式为:
与甲醛反应的离子方程式为:
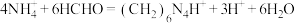
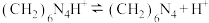
实验步骤:准确称取3.1250g样品溶于水配制成250mL溶液,量取25.00mL样品溶液于锥形瓶中,加入过量中性甲醛溶液(甲醛与NaOH不反应),摇匀、静置5min后,加入1~2滴酚酞试液用0. 1000 NaOH标准溶液滴定至终点,记录数据。重复此操作2次,平均消耗NaOH标准溶液25.00mL。
NaOH标准溶液滴定至终点,记录数据。重复此操作2次,平均消耗NaOH标准溶液25.00mL。
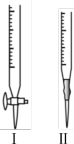
①标准溶液应盛放在下图装置_______ 中(填“Ⅰ”或“Ⅱ”),达到滴定终点的现象是_______ 。
②该样品中 的质量分数为
的质量分数为_______ 。
 )是运载火箭推进剂的重要成分,其在一定条件下分解产生
)是运载火箭推进剂的重要成分,其在一定条件下分解产生 (g)和
(g)和 、
、 、
、 。三种单质气体。
。三种单质气体。(1)某研究小组在实验室设计如下装置检验高氯酸铵分解的产物。该小组连接好装置后,检查装置的气密性,装入试剂,通干燥的惰性气体排尽装置内的空气,将导管末端移入盛满水的试管,通入气体产物。(已知:焦性没食子酸溶液可吸收氧气)

①装置A用于检验分解产物中的
 (g),则A中盛放的试剂为
(g),则A中盛放的试剂为②品红溶液的作用是
③G装置试管中收集到的气体是
(2)研究小组通过甲醛(HCHO)法测定某样品中
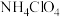 的质量分数。已知:
的质量分数。已知: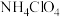 的相对分子质量为117.5;
的相对分子质量为117.5; 与甲醛反应的离子方程式为:
与甲醛反应的离子方程式为: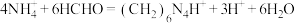
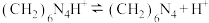
实验步骤:准确称取3.1250g样品溶于水配制成250mL溶液,量取25.00mL样品溶液于锥形瓶中,加入过量中性甲醛溶液(甲醛与NaOH不反应),摇匀、静置5min后,加入1~2滴酚酞试液用0. 1000
 NaOH标准溶液滴定至终点,记录数据。重复此操作2次,平均消耗NaOH标准溶液25.00mL。
NaOH标准溶液滴定至终点,记录数据。重复此操作2次,平均消耗NaOH标准溶液25.00mL。①标准溶液应盛放在下图装置

②该样品中
 的质量分数为
的质量分数为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐2】草酸是一种重要的试剂。下面是利用草酸探究浓度对反应速率影响的实验。
(1)为证明浓度对反应速率的影响,教科书《化学反应原理》中设计了如下实验:取两支试管,各加入4mL0.01mol·L-1的KMnO4酸性溶液,分别向其中加入0.1mol·L-1、0.2mol·L-1H2C2O4溶液2mL,记录溶液褪色所需时间。
实验中发生反应的离子方程式为___ 。
预期现象是:
①溶液的颜色由___ 色变为___ 色。
②其中加入___ mol·L-1H2C2O4的那支试管中的溶液先变色。然而实验结果并不尽如人意。实验过程颜色复杂,且褪色先缓慢后逐渐加快;最大的问题是草酸浓度大,反应速率却更慢。
本实验能否作为课堂实验研究浓度对化学反应速率的影响?适宜的条件是怎样的?某校一研究小组对此进行了探究。下面是他们的实验报告的一部分:
表1试验安排及结果
应用SPSS16.0对正交试验结果进行方差分析,结果如表:
表2各因素水平的数据处理结果
(2)由表2可知,三因素中,____ 的浓度(选填“A”、“B”或“C”,下同)对反应速率影响显著,而___ 的浓度对反应速率的影响不显著。
(3)由表2可知,当高锰酸钾浓度为___ mol·L-1、草酸浓度为____ mol·L-1时,反应最快。即因素A、B的较适宜实验条件得以确定。
根据以上实验结果,该小组同学继续探究硫酸的浓度是怎样影响本反应速率的,测得实验结果如下:
表3不同硫酸浓度下的褪色时间
(4)根据课堂实验的合适时间,可选溶液的褪色时间约为1分钟和2分钟的两份溶液,即此时硫酸的浓度____ mol·L-1和___ mol·L-1,这也有利于观察这两个反应速率的差异。
结论:草酸与酸性高锰酸钾溶液的反应,可作为课堂实验探究浓度对反应速率的影响。
(1)为证明浓度对反应速率的影响,教科书《化学反应原理》中设计了如下实验:取两支试管,各加入4mL0.01mol·L-1的KMnO4酸性溶液,分别向其中加入0.1mol·L-1、0.2mol·L-1H2C2O4溶液2mL,记录溶液褪色所需时间。
实验中发生反应的离子方程式为
预期现象是:
①溶液的颜色由
②其中加入
本实验能否作为课堂实验研究浓度对化学反应速率的影响?适宜的条件是怎样的?某校一研究小组对此进行了探究。下面是他们的实验报告的一部分:
表1试验安排及结果
| 实验 编号 | A(KMnO4溶液 浓度/mol·L-1) | B(草酸溶液 浓度/mol·L-1) | C(硫酸溶液 浓度/mol·L-1) | 褪色时间/s |
| 1 | 3 | 3 | 1 | 336 |
| 2 | 1 | 2 | 3 | 82 |
| 3 | 3 | 1 | 3 | 76 |
| 4 | 1 | 3 | 2 | 133 |
| 5 | 2 | 3 | 3 | 102 |
| 6 | 3 | 2 | 2 | 156 |
| 7 | 2 | 2 | 1 | 300 |
| 8 | 2 | 1 | 2 | 115 |
| 9 | 1 | 1 | 1 | 200 |
表2各因素水平的数据处理结果
| A(KMnO4溶液) | B(草酸溶液) | C(硫酸溶液) | |||||||
| 浓度/mol·L-1 | 0.005 | 0.010 | 0.015 | 0.1 | 0.5 | 0.9 | 6 | 12 | 18 |
| 平均褪色时间/s | 138.3 | 172.3 | 189.3 | 130.3 | 179.3 | 190.3 | 278.7 | 134.7 | 86.7 |
(3)由表2可知,当高锰酸钾浓度为
根据以上实验结果,该小组同学继续探究硫酸的浓度是怎样影响本反应速率的,测得实验结果如下:
表3不同硫酸浓度下的褪色时间
| c(H2SO4)/mol·L-1 | 18 | 16 | 14 | 12 | 10 | 8 | 6 |
| 褪色时间/s | 67 | 83 | 90 | 103 | 129 | 146 | 200 |
结论:草酸与酸性高锰酸钾溶液的反应,可作为课堂实验探究浓度对反应速率的影响。
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐3】同学们研究 溶液与
溶液与 溶液反应,探究过程如下。
溶液反应,探究过程如下。
资料:ⅰ. 在强酸性条件下被还原为
在强酸性条件下被还原为 ,在近中性条件下被还原为
,在近中性条件下被还原为 。
。
ⅱ.单质硫可溶于硫化钠溶液,溶液呈淡黄色。
(1)根据硫元素的价态分析, 具有
具有_________ 性。
(2)甲同学预测:实验I中 被氧化成
被氧化成 价硫(
价硫( 、
、 等)。
等)。
①根据实验现象,乙同学认为甲的预测不合理,理由是_________ 。
②乙同学取实验I中少量溶液进行实验,_________ (填写操作和现象)检测到有 。乙同学认为实验I中的
。乙同学认为实验I中的 被氧化成
被氧化成 ,丙同学否定了该结论,原因是
,丙同学否定了该结论,原因是_________ 。
③同学们经过进一步的实验,证实了该条件下 的确可以将
的确可以将 氧化成
氧化成 。
。
(3)实验I的现象与资料i存在差异,其原因是新生成的产物( )与过量的反应物(
)与过量的反应物( )发生反应,该反应的离子方程式是
)发生反应,该反应的离子方程式是_________ 。
(4)实验II的现象与资料也不完全相符,丁同学猜想其原因与(3)相似,经验证猜想成立,他的实验方案是_________ 。
(5)同学们反思该实验,实验中反应物相同,而现象不同,体现了物质变化不仅与其自身的性质有关,还与_________ 因素有关(填写一点即可)。
 溶液与
溶液与 溶液反应,探究过程如下。
溶液反应,探究过程如下。| 实验序号 | Ⅰ | Ⅱ |
| 实验过程 | 滴加10滴(约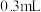 ) )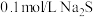 溶液 溶液  酸性 酸性 溶液( 溶液( 酸化至 酸化至 ) ) | 滴加10滴(约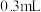 ) )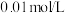 酸性 酸性 溶液( 溶液( 酸化至 酸化至 ) )  溶液 溶液 |
| 实验现象 | 紫色变浅( ),生成棕褐色沉淀( ),生成棕褐色沉淀( ) ) | 溶液呈淡黄色( ),生成浅粉色沉淀( ),生成浅粉色沉淀( ) ) |
 在强酸性条件下被还原为
在强酸性条件下被还原为 ,在近中性条件下被还原为
,在近中性条件下被还原为 。
。ⅱ.单质硫可溶于硫化钠溶液,溶液呈淡黄色。
(1)根据硫元素的价态分析,
 具有
具有(2)甲同学预测:实验I中
 被氧化成
被氧化成 价硫(
价硫( 、
、 等)。
等)。①根据实验现象,乙同学认为甲的预测不合理,理由是
②乙同学取实验I中少量溶液进行实验,
 。乙同学认为实验I中的
。乙同学认为实验I中的 被氧化成
被氧化成 ,丙同学否定了该结论,原因是
,丙同学否定了该结论,原因是③同学们经过进一步的实验,证实了该条件下
 的确可以将
的确可以将 氧化成
氧化成 。
。(3)实验I的现象与资料i存在差异,其原因是新生成的产物(
 )与过量的反应物(
)与过量的反应物( )发生反应,该反应的离子方程式是
)发生反应,该反应的离子方程式是(4)实验II的现象与资料也不完全相符,丁同学猜想其原因与(3)相似,经验证猜想成立,他的实验方案是
(5)同学们反思该实验,实验中反应物相同,而现象不同,体现了物质变化不仅与其自身的性质有关,还与
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
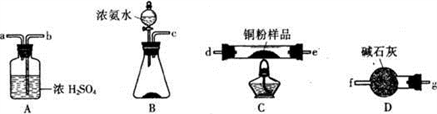
【推荐1】甲、乙两化学小组拟根据氨气还原氧化铜反应的原理测定某铜粉样品(混有CuO粉未)中金属铜的含量。
(1)甲小组利用下图装置(可以重复选用),通过测定反应生成水的质量来达到实验目的。
①按气流方向连接各仪器接口,顺序为______________ (填小写字母序号)。
②装置B中固体试剂的名称为____________________ 。
③装置A的作用为____________ 。
④下列两步操作应该先进行的是___________ (填序号):i.加热反应管 ii.向锥形瓶中逐滴滴加浓氨水,原因为________________________ 。
(2)乙小组利用上述装置通过测定反应前后装置C中固体的质量变化来达到实验目的。
①按气流方向连接各装置,顺序为______________ (填大写字母序号)。
②称取m1 g铜粉样品,测得反应前装置C的质量为m2 g,充分反应后装置C的质量为m3g。写出样品中金属铜的质量分数表达式__________________ 。
(3)从稀盐酸、浓硝酸、蒸馏水、双氧水中选用合适的试剂,重新设计一个测定样品中金属铜含量的实验方案(写出主要步骤,不必描述操作过程的细节)_____________________________ 。
(1)甲小组利用下图装置(可以重复选用),通过测定反应生成水的质量来达到实验目的。
①按气流方向连接各仪器接口,顺序为
②装置B中固体试剂的名称为
③装置A的作用为
④下列两步操作应该先进行的是
(2)乙小组利用上述装置通过测定反应前后装置C中固体的质量变化来达到实验目的。
①按气流方向连接各装置,顺序为
②称取m1 g铜粉样品,测得反应前装置C的质量为m2 g,充分反应后装置C的质量为m3g。写出样品中金属铜的质量分数表达式
(3)从稀盐酸、浓硝酸、蒸馏水、双氧水中选用合适的试剂,重新设计一个测定样品中金属铜含量的实验方案(写出主要步骤,不必描述操作过程的细节)
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
【推荐2】从粉煤灰(含莫来石、石英等)中回收 的一种工艺流程如下:
的一种工艺流程如下:
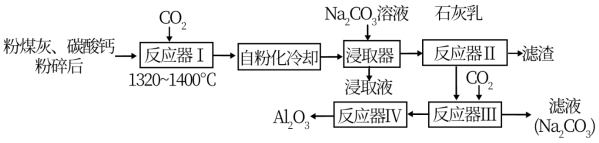
(1)经反应器I可使莫来石和石英转化为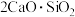 (硅酸二钙)和
(硅酸二钙)和______________ (七铝十二钙,填化学式),从而使其中的 得到活化。
得到活化。
(2)控制条件,经反应器I烧结后固体自身不需要机械加工即可变成粉末,“自粉化”的意义是_______ 。
(3)浸取器中,适量增大 溶液的投料,有利于提高铝酸钙转化为
溶液的投料,有利于提高铝酸钙转化为 的产率,其原因是
的产率,其原因是_______________________________________ ;同时有少量硅进入浸取渣,硅的存在形式是________________________________ (填化学式)。
(4)反应器Ⅲ中发生反应的离子方程式为:__________________________________ 。
(5)反应器Ⅳ采取工艺方法是_____________________ ;上述工艺流程中可以循环使用的物质是_______________________________ (填化学式)。
 的一种工艺流程如下:
的一种工艺流程如下:
(1)经反应器I可使莫来石和石英转化为
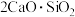 (硅酸二钙)和
(硅酸二钙)和 得到活化。
得到活化。(2)控制条件,经反应器I烧结后固体自身不需要机械加工即可变成粉末,“自粉化”的意义是
(3)浸取器中,适量增大
 溶液的投料,有利于提高铝酸钙转化为
溶液的投料,有利于提高铝酸钙转化为 的产率,其原因是
的产率,其原因是(4)反应器Ⅲ中发生反应的离子方程式为:
(5)反应器Ⅳ采取工艺方法是
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐3】某学习小组为证实Ba(OH)2溶液和H2SO4溶液的反应是离子反应,设计了如下实验。请补充完成该实验报告。
(1)【实验原理】
溶液的导电性由溶液中离子的浓度及离子电荷数决定。观察_____ ,据此判断溶液中自由移动的离子浓度的变化,从而证明反应是离子反应。
(2)【实验装置】如图1所示。

【实验过程与记录】
(3)整个过程中混合溶液的导电能力(用电流强度Ⅰ表示)可近似地用图2中的_____ (填序号)曲线表示。
(4)下列三种情况下,与上述实验中离子方程式相同的是_____ 。
A 向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至SO42﹣恰好完全沉淀
B 向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至至溶液显中性
C 向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至过量
(5)已知:PbSO4难溶于水,但可溶于醋酸氨溶液中形成无色溶液,其化学方程式为:PbSO4+2CH3COONH4=(CH3COO)2Pb+(NH4)2SO4.写出该反应的离子方程式为_____ 。
(1)【实验原理】
溶液的导电性由溶液中离子的浓度及离子电荷数决定。观察
(2)【实验装置】如图1所示。

【实验过程与记录】
| 实验步骤 | 实验现象 | 实验结论 |
| 连接好装置,向烧杯中加入25mL1mol•L﹣1的Ba(OH)2溶液和2滴酚酞溶液,逐滴滴加1mol•L﹣1的H2SO4溶液直至过量,边滴边振荡。 | (2) | Ba(OH)2溶液和H2SO4溶液的反应是离子反应 |
(4)下列三种情况下,与上述实验中离子方程式相同的是
A 向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至SO42﹣恰好完全沉淀
B 向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至至溶液显中性
C 向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至过量
(5)已知:PbSO4难溶于水,但可溶于醋酸氨溶液中形成无色溶液,其化学方程式为:PbSO4+2CH3COONH4=(CH3COO)2Pb+(NH4)2SO4.写出该反应的离子方程式为
您最近一年使用:0次



