对于平衡体系:a A(g)+b B(g) c C(g)+d D(s) △H<0,下列判断中正确的是
c C(g)+d D(s) △H<0,下列判断中正确的是
 c C(g)+d D(s) △H<0,下列判断中正确的是
c C(g)+d D(s) △H<0,下列判断中正确的是| A.若(a+b) < (c+d),则反应一定能自发向右进行 |
| B.若起始时只充入A、B,且物质的量之比为a:b,则平衡时A、B的转化率之比为a:b |
| C.若a+b = c+d,往含m mol气体的平衡体系中充入n mol B,则达到平衡时气体总物质的量等于(m+n)mol。 |
| D.若a+b = c,对于体积不变的容器,升高温度,平衡向左移动,容器中气体的压强增大 |
更新时间:2018-01-15 21:17:48
|
相似题推荐
单选题
|
较难
(0.4)
名校
【推荐1】煤炭燃烧过程中会释放出大量的SO2,严重破坏生态环境。采用一定的脱硫技术可以把硫元素以CaSO4的形式固定,从而降低SO2的排放。但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率。相关反应的热化学方程式如下:
CaSO4(s)+CO(g) CaO(s)+SO2(g)+CO2(g) △H1=+218.4 kJ/mol(反应I)
CaO(s)+SO2(g)+CO2(g) △H1=+218.4 kJ/mol(反应I)
CaSO4(s)+4CO(g) CaS(s)+4CO2(g) △H2=-175.6 kJ/mol (反应II)
CaS(s)+4CO2(g) △H2=-175.6 kJ/mol (反应II)
下列有关说法正确的是
CaSO4(s)+CO(g)
 CaO(s)+SO2(g)+CO2(g) △H1=+218.4 kJ/mol(反应I)
CaO(s)+SO2(g)+CO2(g) △H1=+218.4 kJ/mol(反应I)CaSO4(s)+4CO(g)
 CaS(s)+4CO2(g) △H2=-175.6 kJ/mol (反应II)
CaS(s)+4CO2(g) △H2=-175.6 kJ/mol (反应II)下列有关说法正确的是
| A.提高反应体系的温度,能降低该反应体系中SO2生成量 |
| B.反应II在较低的温度下可自发进行 |
C.用生石灰固硫的反应为:4CaO(s)+4SO2(g)  3CaSO4(s)+CaS(s) △H3,则△H3>△H2 3CaSO4(s)+CaS(s) △H3,则△H3>△H2 |
D.由反应I和反应II可计算出反应CaSO4(s) CaO(s)+SO3(g)的焓变 CaO(s)+SO3(g)的焓变 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐2】工业上用CO2和H2合成甲醇涉及以下反应:
反应I.CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1
CH3OH(g)+H2O(g) ΔH1
反应Ⅱ. CO2(g)+H2(g) CO(g)+H2O(g) ΔH2
CO(g)+H2O(g) ΔH2
在催化剂作用下,将1molCO2和2molH2的混合气体充入一恒容密闭容器中进行反应,达到平衡时,CO2的转化率和容器中混合气体的平均相对分子质量随温度变化如图。下列判断正确的是
反应I.CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH1
CH3OH(g)+H2O(g) ΔH1反应Ⅱ. CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH2
CO(g)+H2O(g) ΔH2在催化剂作用下,将1molCO2和2molH2的混合气体充入一恒容密闭容器中进行反应,达到平衡时,CO2的转化率和容器中混合气体的平均相对分子质量随温度变化如图。下列判断正确的是

| A.ΔH2<0 |
| B.T℃,平衡时甲醇的选择性为40% |
C.T℃,反应Ⅱ平衡常数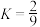 |
| D.为同时提高CO2的平衡转化率和平衡时甲醇的选择性,应选择的反应条件为高温、高压 |
您最近一年使用:0次
单选题
|
较难
(0.4)
解题方法
【推荐1】在不同温度下,向2L密闭容器中加入0.5mol NO和0.5mol活性炭,发生反应:2NO(g)+C(s)  N2(g)+CO2(g) ΔH<0,5min后反应达到平衡,平衡数据如下:
N2(g)+CO2(g) ΔH<0,5min后反应达到平衡,平衡数据如下:
下列有关说法正确的是
 N2(g)+CO2(g) ΔH<0,5min后反应达到平衡,平衡数据如下:
N2(g)+CO2(g) ΔH<0,5min后反应达到平衡,平衡数据如下:| 温度/℃ | n(C)/mol | n(CO2)/mol |
| T1 | 0.15 | |
| T2 | 0.375 |
A.T1℃时,该反应的平衡常数K=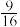 |
| B.T1℃时,5min时CO2的反应速率为0.015mol·L-1·min-1 |
| C.由上述信息可推知:T1>T2 |
| D.T2℃时,反应达到平衡后再通入NO,c(N2):c(NO)增大 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】在体积最大为25L的密闭容器中,一定温度下,充入1mol气体,保持体积为10L不变至反应达到平衡,3min时只改变一个条件(温度或体积),5min时反应再次达到平衡,A、B、C三种气体的物质的量变化如图所示。下列判断正确的是
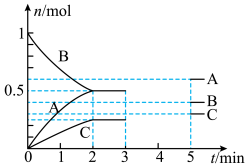
A.该反应的化学方程式可表示为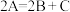 | B.3~5min内,反应向正反应方向进行 |
| C.3min时改变的条件可能是增大体积 | D.5min反应达到平衡后,此时K=0.025 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐3】已知反应:2NO2(红棕色) N2O4(无色)△H<0。将一定量的NO2充入注射器中后封口,下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小,且整个操作过程物质均为气态)。下列说法不正确的是
N2O4(无色)△H<0。将一定量的NO2充入注射器中后封口,下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小,且整个操作过程物质均为气态)。下列说法不正确的是
 N2O4(无色)△H<0。将一定量的NO2充入注射器中后封口,下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小,且整个操作过程物质均为气态)。下列说法不正确的是
N2O4(无色)△H<0。将一定量的NO2充入注射器中后封口,下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小,且整个操作过程物质均为气态)。下列说法不正确的是
| A.b点到c点的实验现象是气体颜色先变深后变浅,最后气体颜色比a点还要深 |
| B.c点与a点相比,n(NO2)减小,混合气体密度增大 |
| C.d 点:v(正)<v(逆) |
D.若在注射器中对反应H2(g)+I2(g)  2HI(g)进行完全相同的操作,最后能得到相似的透光率变化趋势图象 2HI(g)进行完全相同的操作,最后能得到相似的透光率变化趋势图象 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐1】在密闭容器中发生 2CO(g)+SO2(g)  2CO2(g)+S(s) △H=-akJ·mol-1(a>0)的反应,下列叙述正确的是
2CO2(g)+S(s) △H=-akJ·mol-1(a>0)的反应,下列叙述正确的是
 2CO2(g)+S(s) △H=-akJ·mol-1(a>0)的反应,下列叙述正确的是
2CO2(g)+S(s) △H=-akJ·mol-1(a>0)的反应,下列叙述正确的是| A.若反应开始时投入2 mol CO,则达平衡时,放出热量为a kJ |
| B.达到化学平衡后加入C18O,达新平衡前SO2中不含有18O |
| C.增大压强或升高温度都可以加快化学反应速率并能提高SO2的转化率 |
| D.达到化学平衡后,其它条件不变,容器体积缩小为原来的一半,CO的浓度增大 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
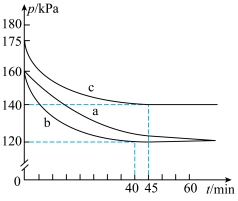
【推荐2】将 催化转化成CO是实现
催化转化成CO是实现 资源化利用的关键步骤,发生的反应有
资源化利用的关键步骤,发生的反应有
反应Ⅰ:

反应Ⅱ: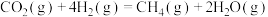

反应Ⅲ: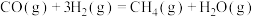
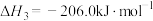 ,0.1MPa,在密闭容器中按
,0.1MPa,在密闭容器中按 投料,平衡时各组分的摩尔分数[物质i的摩尔分数:
投料,平衡时各组分的摩尔分数[物质i的摩尔分数: ,
, 未计入]随温度的变化如图。下列说法
未计入]随温度的变化如图。下列说法不正确 的是
 催化转化成CO是实现
催化转化成CO是实现 资源化利用的关键步骤,发生的反应有
资源化利用的关键步骤,发生的反应有反应Ⅰ:


反应Ⅱ:
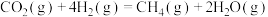

反应Ⅲ:
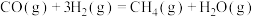
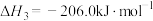 ,0.1MPa,在密闭容器中按
,0.1MPa,在密闭容器中按 投料,平衡时各组分的摩尔分数[物质i的摩尔分数:
投料,平衡时各组分的摩尔分数[物质i的摩尔分数: ,
, 未计入]随温度的变化如图。下列说法
未计入]随温度的变化如图。下列说法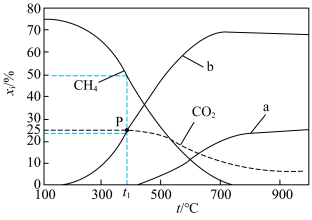
| A.低温下有利于反应Ⅱ正向进行 | B.曲线b为 |
C.P点时反应Ⅰ的 约为 约为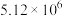 | D.900℃时,适当增大体系压强,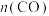 保持不变 保持不变 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐1】煤燃烧排放的烟气含有SO2和NOx,对烟气进行脱硫、脱硝,对环境保护有着重要意义。在脱硫实验中发生反应: 2CO(g) + SO2(g)  2CO2(g)+S(s) ΔH<0,在体积为 2 L的恒容密闭容器中,通入2.2 molCO和1 mol SO2,在不同条件下进行反应时体系的总压强随时间的变化如图所示。下列说法错误的是
2CO2(g)+S(s) ΔH<0,在体积为 2 L的恒容密闭容器中,通入2.2 molCO和1 mol SO2,在不同条件下进行反应时体系的总压强随时间的变化如图所示。下列说法错误的是
 2CO2(g)+S(s) ΔH<0,在体积为 2 L的恒容密闭容器中,通入2.2 molCO和1 mol SO2,在不同条件下进行反应时体系的总压强随时间的变化如图所示。下列说法错误的是
2CO2(g)+S(s) ΔH<0,在体积为 2 L的恒容密闭容器中,通入2.2 molCO和1 mol SO2,在不同条件下进行反应时体系的总压强随时间的变化如图所示。下列说法错误的是
| A.与a相比,c可能改变的条件为升高温度 |
| B.a和b的化学平衡常数相等 |
| C.b对应40min达到平衡,则在0~40min内用CO表示的平均反应速率为0.02mol·L-1·min-1 |
| D.a达到平衡时,SO2的转化率小于CO的转化率 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】利用反应: 可实现从燃煤烟气中回收硫。在恒温恒容条件下,向两个体积均为VL的密闭容器中各充入
可实现从燃煤烟气中回收硫。在恒温恒容条件下,向两个体积均为VL的密闭容器中各充入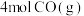 和
和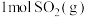 发生该反应,在不同温度下两个反应体系的总压强随时间的变化如图所示。
发生该反应,在不同温度下两个反应体系的总压强随时间的变化如图所示。
 可实现从燃煤烟气中回收硫。在恒温恒容条件下,向两个体积均为VL的密闭容器中各充入
可实现从燃煤烟气中回收硫。在恒温恒容条件下,向两个体积均为VL的密闭容器中各充入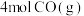 和
和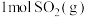 发生该反应,在不同温度下两个反应体系的总压强随时间的变化如图所示。
发生该反应,在不同温度下两个反应体系的总压强随时间的变化如图所示。
A.容器Ⅰ中CO的体积分数: |
B.容器Ⅱ中 的平衡转化率是80% 的平衡转化率是80% |
C.平衡常数: |
D. 内用 内用 表示容器I中的平均反应速率为 表示容器I中的平均反应速率为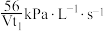 |
您最近一年使用:0次

 恒容密闭容器中充入
恒容密闭容器中充入 、
、 ,发生反应
,发生反应 ,测得反应
,测得反应 时,不同温度下氢气的转化率如图所示。[已知:该反应的速率方程
时,不同温度下氢气的转化率如图所示。[已知:该反应的速率方程 、
、 ,
, 、
、 只与温度有关]
只与温度有关]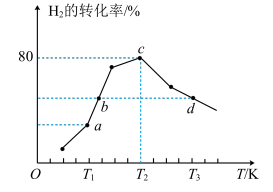
 由大到小的顺序为
由大到小的顺序为
 温度下,起始时容器内的压强为
温度下,起始时容器内的压强为 ,
,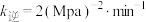 ,则该温度下
,则该温度下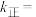
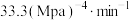
 的真空容器中通入
的真空容器中通入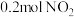 ,在
,在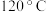 时发生反应
时发生反应
 ,测得平衡时
,测得平衡时 为
为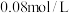 。各物质的消耗速率存在关系:
。各物质的消耗速率存在关系: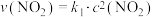 ,
,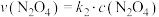 ,且消耗速率随浓度变化的如下图所示,下列有关说法正确的是
,且消耗速率随浓度变化的如下图所示,下列有关说法正确的是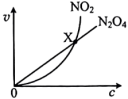
 点处在平衡状态
点处在平衡状态 时,若
时,若 ,则
,则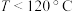
 ,则平衡转化率为
,则平衡转化率为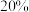
 的体积分数将增大
的体积分数将增大

