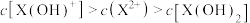常温下有H2RO4=H++HRO4-、HRO4- H++RO42-,现有物质的量浓度都为0.1mol/L的三种溶液:①NaHRO4溶液; ②H2RO4溶液; ③Na2RO4溶液。下列说法正确的是
H++RO42-,现有物质的量浓度都为0.1mol/L的三种溶液:①NaHRO4溶液; ②H2RO4溶液; ③Na2RO4溶液。下列说法正确的是
 H++RO42-,现有物质的量浓度都为0.1mol/L的三种溶液:①NaHRO4溶液; ②H2RO4溶液; ③Na2RO4溶液。下列说法正确的是
H++RO42-,现有物质的量浓度都为0.1mol/L的三种溶液:①NaHRO4溶液; ②H2RO4溶液; ③Na2RO4溶液。下列说法正确的是| A.②和③等体积混合后的溶液中: c( Na+)= c( HRO4-)+c(H2RO4) +c(RO42-) |
| B.100mL①溶液中: n(HRO4-)+n(RO42-)+n(OH-)-n(H+)= 0.01 |
| C.①和②等体积混合后的溶液中可能的离子浓度为c( HRO4-)>c(H+)>c(Na+) |
| D.若①和③等体积混合后,会抑制水的电离,则HRO4-的电离程度肯定大于RO42-的水解程度 |
更新时间:2018/01/25 22:35:21
|
相似题推荐
单选题-单题
|
较难
(0.4)
真题
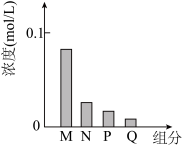
【推荐1】环境保护工程师研究利用 、
、 和
和 处理水样中的
处理水样中的 。已知
。已知 时,
时, 饱和溶液浓度约为
饱和溶液浓度约为 ,
,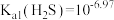 ,
,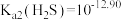 ,
,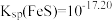 ,
,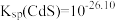 。下列说法错误的是
。下列说法错误的是
 、
、 和
和 处理水样中的
处理水样中的 。已知
。已知 时,
时, 饱和溶液浓度约为
饱和溶液浓度约为 ,
,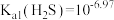 ,
,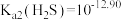 ,
,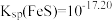 ,
,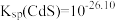 。下列说法错误的是
。下列说法错误的是A. 溶液中: 溶液中: |
B.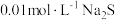 溶液中: 溶液中: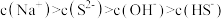 |
C.向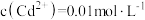 的溶液中加入 的溶液中加入 ,可使 ,可使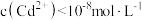 |
D.向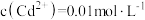 的溶液中通入 的溶液中通入 气体至饱和,所得溶液中: 气体至饱和,所得溶液中: |
您最近一年使用:0次
单选题
|
较难
(0.4)
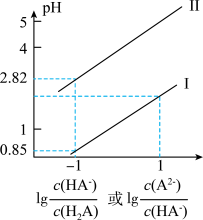
【推荐2】25℃时,向25mL0.1mol·L-1 H2A溶液中加入KOH固体或通入HCl气体,混合溶液中pc[pc=-1gc(HA-)或-lgc(A2-)]与pH的关系如图所示(忽略溶液体积变化和H2A可能逸出)。下列有关叙述正确的是
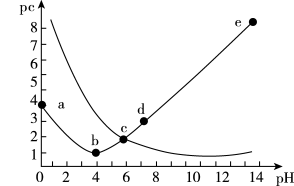

| A.c点c(K+)=0.15mol·L-1 |
| B.H2A的Ka1约为1.0×10-3 |
| C.b点有关微粒浓度的大小关系为c(HA-)>c(K+)>c(A2-) |
| D.从b点到e点,水电离产生的c(H+)先减小后增大 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐1】25℃时,下列对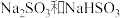 混合溶液中的微粒浓度关系的说法正确的是
混合溶液中的微粒浓度关系的说法正确的是
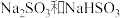 混合溶液中的微粒浓度关系的说法正确的是
混合溶液中的微粒浓度关系的说法正确的是A.一定存在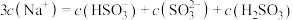 |
B.一定存在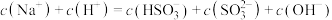 |
C.若混合溶液中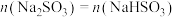 时,溶液呈酸性,则有 时,溶液呈酸性,则有 |
D.若混合溶液中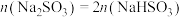 时,溶液呈碱性,则有 时,溶液呈碱性,则有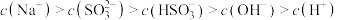 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐2】常温下,向100 mL 0.01 mol·L-1HA溶液中逐滴加入0.02 mol·L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计)。下列说法中,不正确的是( )
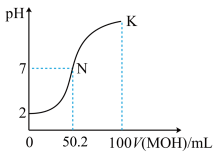

A.HA的电离方程式为:HA=H++A-  | B.MOH为一元弱碱 |
C.K点对应的溶液中有:c(MOH)+c(M+)=0.02mol  L-1 L-1 | D.N点对应的溶液中有:c(M+)=c(A-) |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐1】25℃时,用0.2 的NaOH溶液滴定50mL 0.1
的NaOH溶液滴定50mL 0.1
 溶液,溶液中
溶液,溶液中 和
和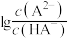 与pH的关系如图所示,已知
与pH的关系如图所示,已知 ,下列说法正确的是
,下列说法正确的是
 的NaOH溶液滴定50mL 0.1
的NaOH溶液滴定50mL 0.1
 溶液,溶液中
溶液,溶液中 和
和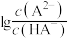 与pH的关系如图所示,已知
与pH的关系如图所示,已知 ,下列说法正确的是
,下列说法正确的是
A.曲线Ⅱ表示 与pH的关系 与pH的关系 |
B. 的数量级为 的数量级为 |
C.滴入25mL NaOH溶液时,溶液呈碱性,存在关系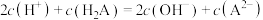 |
| D.滴入50mL NaOH溶液时,溶液的pH约为8.26 |
您最近一年使用:0次
单选题-单题
|
较难
(0.4)
名校
解题方法
【推荐2】常温下, 在不同pH的
在不同pH的 溶液中的存在形式不同,
溶液中的存在形式不同, 溶液中pM[
溶液中pM[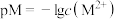 ]随pH的变化、
]随pH的变化、 溶液中含A微粒的物质的量分数随pH的变化如图所示。已知MA、
溶液中含A微粒的物质的量分数随pH的变化如图所示。已知MA、 均为难溶物,下列说法错误的是
均为难溶物,下列说法错误的是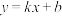 (k、b是常数,
(k、b是常数, ),x为自变量,y为因变量,将这两个变量分别作为横、纵坐标,则图像在平面上呈一条直线。
),x为自变量,y为因变量,将这两个变量分别作为横、纵坐标,则图像在平面上呈一条直线。
 在不同pH的
在不同pH的 溶液中的存在形式不同,
溶液中的存在形式不同, 溶液中pM[
溶液中pM[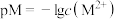 ]随pH的变化、
]随pH的变化、 溶液中含A微粒的物质的量分数随pH的变化如图所示。已知MA、
溶液中含A微粒的物质的量分数随pH的变化如图所示。已知MA、 均为难溶物,下列说法错误的是
均为难溶物,下列说法错误的是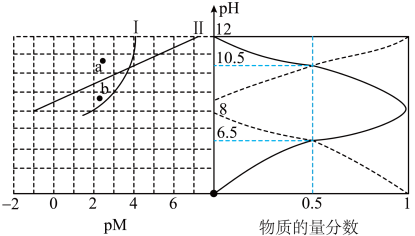
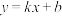 (k、b是常数,
(k、b是常数, ),x为自变量,y为因变量,将这两个变量分别作为横、纵坐标,则图像在平面上呈一条直线。
),x为自变量,y为因变量,将这两个变量分别作为横、纵坐标,则图像在平面上呈一条直线。| A.NaHA溶液呈碱性 |
B.  溶液中存在: 溶液中存在: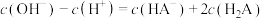 |
C.曲线Ⅱ上的点满足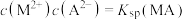 |
| D.初始状态的b点发生反应生成MA沉淀 |
您最近一年使用:0次


 水溶液中相关组分的物质的量分数
水溶液中相关组分的物质的量分数 随溶液
随溶液 变化的曲线如图所示,下列说法错误的是
变化的曲线如图所示,下列说法错误的是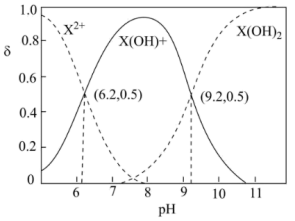
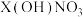 水溶液显酸性
水溶液显酸性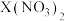 和
和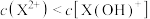
 的水溶液中,
的水溶液中,