氮氧化物是环境污染物,研究氮氧化物转化有重要的意义。
回答下列问题
(1)催化转化器可使汽车尾气反应而转化:
2NO(g)+2CO(g) N2(g)+2CO2(g) △H
N2(g)+2CO2(g) △H
已知:N2(g)+O2(g)==2NO(g) △H1= a kJ·mol-1
2C(s)+O2(g)==2CO(g) △H2= b kJ·mol-1
C(s)+ O2(g)=CO2(g) △H3= c kJ·mol-1
△H=___________ kJ·mol-1(用含a、b、c的代数式表示)
(2)T℃时,将等物质的量的NO和CO充入容积为2L的密闭容器中发生尾气转化反应,容器中NO物质的量随时间变化如图所示。

①T℃时,该化学反应的平衡常数K=___________ 。
②下列事实无法判断汽车尾气转化反应达到到化学平衡状态的是___________ ;
A.NO消耗速率等于N2消耗速率的2倍 B.混合气体平均相对分子质量不再变化
C.体系中NO的转化率和CO的转化率相等 D.气体的密度不再变化
③已知汽车尾气转化反应的△H<0。10min后,改变下列示意图横坐标对应的反应条件,纵坐标对应的量变化关系正确的是___________ 。(填序号)

(3)碘蒸气存在能大幅度提高N2O的分解速率,反应历程为:
第一步I2(g) 2I(g)(快反应)
2I(g)(快反应)
第二步I(g)+N2O(g)→N2(g)+IO(g)(慢反应)
第三步IO(g)+N2O(g)→N2(g)+O2(g)+I2(g)(快反应)
实验表明,含碘时N2O分解速率方程v=k·c(N2O)·[c(I2)0.5(k为速率常数)。下列表述正确的是___________ (填标号)。
A.N2O分解反应中,k值与是否含碘蒸气无关
B.第二步对总反应速率起决定作用
C.第二步活化能比第三步小
D.IO为反应的中间产物
(4)碱吸收、碳还原是目前工业生产中处理氮氧化物的常用方法。
①碱吸收的常见产物为NaNO2。常温下,pH=8的NaNO2溶液中c(Na+)-c(NO2-)=___________ mol·L-1(用精确值表示)
②碳还原法是在高温条件下将NO与NO2混合气体与焦炭反应,生成CO和N2。已知,采用碳还原法处理某工厂氮氧化物废气时,生成的CO与N2的物质的量之比为4︰3。则该工厂尾气中NO和NO2的物质的量比为___________ 。
回答下列问题
(1)催化转化器可使汽车尾气反应而转化:
2NO(g)+2CO(g)
 N2(g)+2CO2(g) △H
N2(g)+2CO2(g) △H已知:N2(g)+O2(g)==2NO(g) △H1= a kJ·mol-1
2C(s)+O2(g)==2CO(g) △H2= b kJ·mol-1
C(s)+ O2(g)=CO2(g) △H3= c kJ·mol-1
△H=
(2)T℃时,将等物质的量的NO和CO充入容积为2L的密闭容器中发生尾气转化反应,容器中NO物质的量随时间变化如图所示。

①T℃时,该化学反应的平衡常数K=
②下列事实无法判断汽车尾气转化反应达到到化学平衡状态的是
A.NO消耗速率等于N2消耗速率的2倍 B.混合气体平均相对分子质量不再变化
C.体系中NO的转化率和CO的转化率相等 D.气体的密度不再变化
③已知汽车尾气转化反应的△H<0。10min后,改变下列示意图横坐标对应的反应条件,纵坐标对应的量变化关系正确的是

(3)碘蒸气存在能大幅度提高N2O的分解速率,反应历程为:
第一步I2(g)
 2I(g)(快反应)
2I(g)(快反应)第二步I(g)+N2O(g)→N2(g)+IO(g)(慢反应)
第三步IO(g)+N2O(g)→N2(g)+O2(g)+I2(g)(快反应)
实验表明,含碘时N2O分解速率方程v=k·c(N2O)·[c(I2)0.5(k为速率常数)。下列表述正确的是
A.N2O分解反应中,k值与是否含碘蒸气无关
B.第二步对总反应速率起决定作用
C.第二步活化能比第三步小
D.IO为反应的中间产物
(4)碱吸收、碳还原是目前工业生产中处理氮氧化物的常用方法。
①碱吸收的常见产物为NaNO2。常温下,pH=8的NaNO2溶液中c(Na+)-c(NO2-)=
②碳还原法是在高温条件下将NO与NO2混合气体与焦炭反应,生成CO和N2。已知,采用碳还原法处理某工厂氮氧化物废气时,生成的CO与N2的物质的量之比为4︰3。则该工厂尾气中NO和NO2的物质的量比为
更新时间:2019-03-06 16:15:42
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】氯气及其化合物在生产和生活中有广泛应用。化学上,在一定温度和压强下,由最稳定的单质生成 纯物质的热效应称为生成热。
纯物质的热效应称为生成热。
信息1:几种碱金属氯化物的生成热如表所示。
(1)写出表示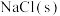 生成热的热化学力程式:
生成热的热化学力程式:___________ 。
(2)预测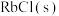 的生成热范围为
的生成热范围为___________ 。
信息2:M和几种含氯阴离子的生成热与氯元素化合价的关系如图所示(生成热可以视为物质的相对能量)。

(3)在含氯阴离子中,最稳定的阴离子是___________ (填离子符号,下同),最不稳定的阴离子是___________ 。
(4)常温下,b的钠盐溶液的pH___________ (填“>”“<”或“=”),其原因是___________ (用离子方程式表示)。
(5)氯气与 溶液在不同条件下的反应不同。
溶液在不同条件下的反应不同。
①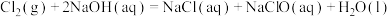

②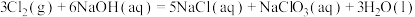

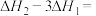
___________  。
。
 纯物质的热效应称为生成热。
纯物质的热效应称为生成热。信息1:几种碱金属氯化物的生成热如表所示。
| 碱金属氯化物 | 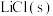 | 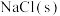 | 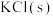 | 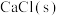 |
生成热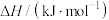 | -409 | -411 | -437 | -443 |
(1)写出表示
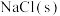 生成热的热化学力程式:
生成热的热化学力程式:(2)预测
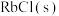 的生成热范围为
的生成热范围为信息2:M和几种含氯阴离子的生成热与氯元素化合价的关系如图所示(生成热可以视为物质的相对能量)。

(3)在含氯阴离子中,最稳定的阴离子是
(4)常温下,b的钠盐溶液的pH
(5)氯气与
 溶液在不同条件下的反应不同。
溶液在不同条件下的反应不同。①
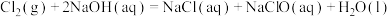

②
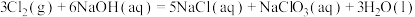

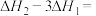
 。
。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】甲醇是一种重要的基础有机化工原料和优质燃料,用CO2制备甲醇可实现碳循环,制备方法为
反应I:

反应Ⅱ:

反应Ⅲ:

(1)反应I、Ⅱ、Ⅲ以物质的量分数表示的平衡常数K与温度T变化关系如图所示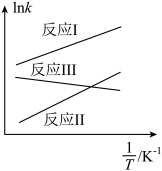 。根据据图判断,随着温度的升高CH3OH的平衡产率
。根据据图判断,随着温度的升高CH3OH的平衡产率___________ (填“增大”,“减小”或“不变”), 的数值范围是
的数值范围是___________ (填标号)。
A.<-1 B.-1~0 C.0~1 D.>1
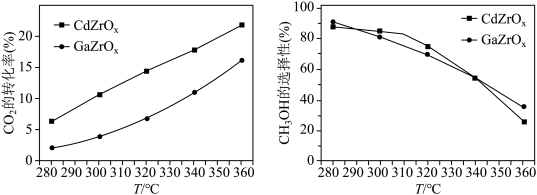
(2)已知初始投料比 ,在5MPa恒压条件下,使用不同的催化剂,经过相同时间,CO2的转化率和CH3OH的选择性随温度的变化如图所示。
,在5MPa恒压条件下,使用不同的催化剂,经过相同时间,CO2的转化率和CH3OH的选择性随温度的变化如图所示。
(CH3OH选择性=.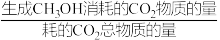 ×100%)
×100%)
①由图像可知,工业上合成甲醇,考虑到生产效率,最合适的催化剂和温度是___________ 。
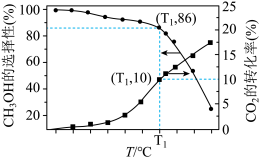
②工业上使用一种催化剂,CO2的转化率和CH3OH的选择性随温度的变化如图所示,随温度升高CH3OH产率的变化趋势为___________ ,T1温度下CH3OH的产率为___________ ,H2O(g)的体积分数为___________ 。随着温度的升高,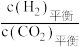 逐渐
逐渐___________ (填“增大”,“减小”或“不变”)。
反应I:


反应Ⅱ:


反应Ⅲ:


(1)反应I、Ⅱ、Ⅲ以物质的量分数表示的平衡常数K与温度T变化关系如图所示
 。根据据图判断,随着温度的升高CH3OH的平衡产率
。根据据图判断,随着温度的升高CH3OH的平衡产率 的数值范围是
的数值范围是A.<-1 B.-1~0 C.0~1 D.>1
(2)已知初始投料比
 ,在5MPa恒压条件下,使用不同的催化剂,经过相同时间,CO2的转化率和CH3OH的选择性随温度的变化如图所示。
,在5MPa恒压条件下,使用不同的催化剂,经过相同时间,CO2的转化率和CH3OH的选择性随温度的变化如图所示。
(CH3OH选择性=.
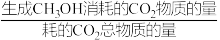 ×100%)
×100%)①由图像可知,工业上合成甲醇,考虑到生产效率,最合适的催化剂和温度是
②工业上使用一种催化剂,CO2的转化率和CH3OH的选择性随温度的变化如图所示,随温度升高CH3OH产率的变化趋势为
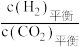 逐渐
逐渐
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】二甲醚(DME)被誉为“21世纪的清洁燃料”,由合成气制备二甲醚的主要原理如下:
①CO(g)+2H2 (g) CH3OH(g) ΔH1=-90.7kJ·mol-1K1
CH3OH(g) ΔH1=-90.7kJ·mol-1K1
②2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH2=-23.5kJ·mol-1K2
CH3OCH3(g)+H2O(g) ΔH2=-23.5kJ·mol-1K2
③CO(g)+H2O(g) CO2(g)+H2 (g) ΔH3=-41.2kJ·mol-1K3
CO2(g)+H2 (g) ΔH3=-41.2kJ·mol-1K3
回答下列问题:
(1)反应3H2 (g)+3CO(g) CH3OCH3 (g)+CO2(g)的ΔH=
CH3OCH3 (g)+CO2(g)的ΔH=_____ kJ·mol-1;该反应的平衡常数K=_____ (用K1、K2、K3表示)。随温度的升高,该反应的平衡常数K的变化趋势是_____ (填增大、减小、或不变)
(2)下列措施中,能提高(1)中CH3OCH3产率的有_____ (填字母)。
A.使用过量的CO B.升高温度 C.增大压强
(3)一定温度下,将0.2molCO和0.1molH2O(g)通入2L恒容密闭容器中,发生反应③,5min后达到化学平衡,平衡后测得H2的体积分数为0.1.则0~5min内v(H2O)=_____ ,CO的转化率为_____ ,向上述平衡体系中再充入0.2molCO和0.1molH2O(g),再次达到平衡时,H2的体积分数_____ 0.1(填大于、小于、或等于)
(4)将合成气以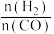 =2通入1L的反应器中,一定条件下发生反应:4H2 (g)+2CO(g)
=2通入1L的反应器中,一定条件下发生反应:4H2 (g)+2CO(g) CH3OCH3 (g)+H2O(g)ΔH,其中CO的平衡转化率随温度、压强的变化关系如图1所示,下列说法正确的是
CH3OCH3 (g)+H2O(g)ΔH,其中CO的平衡转化率随温度、压强的变化关系如图1所示,下列说法正确的是_____ (填字母)。
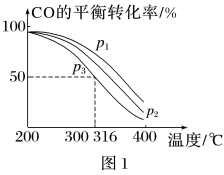
A.ΔH<0
B.p1>p2>p3
C.若在p3和316℃时,起始时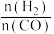 =3,则平衡时,α(CO)小于50%
=3,则平衡时,α(CO)小于50%
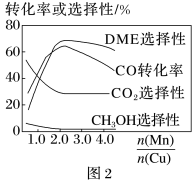
(5)采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2制备二甲醚(DME)。观察图2,当 约为
约为_____ 时最有利于二甲醚的合成。
①CO(g)+2H2 (g)
 CH3OH(g) ΔH1=-90.7kJ·mol-1K1
CH3OH(g) ΔH1=-90.7kJ·mol-1K1②2CH3OH(g)
 CH3OCH3(g)+H2O(g) ΔH2=-23.5kJ·mol-1K2
CH3OCH3(g)+H2O(g) ΔH2=-23.5kJ·mol-1K2③CO(g)+H2O(g)
 CO2(g)+H2 (g) ΔH3=-41.2kJ·mol-1K3
CO2(g)+H2 (g) ΔH3=-41.2kJ·mol-1K3回答下列问题:
(1)反应3H2 (g)+3CO(g)
 CH3OCH3 (g)+CO2(g)的ΔH=
CH3OCH3 (g)+CO2(g)的ΔH=(2)下列措施中,能提高(1)中CH3OCH3产率的有
A.使用过量的CO B.升高温度 C.增大压强
(3)一定温度下,将0.2molCO和0.1molH2O(g)通入2L恒容密闭容器中,发生反应③,5min后达到化学平衡,平衡后测得H2的体积分数为0.1.则0~5min内v(H2O)=
(4)将合成气以
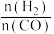 =2通入1L的反应器中,一定条件下发生反应:4H2 (g)+2CO(g)
=2通入1L的反应器中,一定条件下发生反应:4H2 (g)+2CO(g) CH3OCH3 (g)+H2O(g)ΔH,其中CO的平衡转化率随温度、压强的变化关系如图1所示,下列说法正确的是
CH3OCH3 (g)+H2O(g)ΔH,其中CO的平衡转化率随温度、压强的变化关系如图1所示,下列说法正确的是
A.ΔH<0
B.p1>p2>p3
C.若在p3和316℃时,起始时
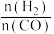 =3,则平衡时,α(CO)小于50%
=3,则平衡时,α(CO)小于50%(5)采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2制备二甲醚(DME)。观察图2,当
 约为
约为
您最近一年使用:0次
【推荐1】(1)t℃时,将2molSO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生如下反应: 2SO2(g)+O2(g)═2SO3(g),此反应放热。2min时反应达到化学平衡,此时测得容器内的压强为起始压强的0.8倍,请填写下列空白:
①从反应开始到达化学平衡,生成SO3的平均反应速率为_______ ;平衡时,SO2转化率为 _____
②下列叙述能证明该反应已达到化学平衡状态的是_________
A.容器内压强不再发生变化
B.SO2的体积分数不再发生变化
C.容器内气体原子总数不再发生变化
D.相同时间内消耗2nmolSO2的同时消耗nmolO2
E.相同时间内消耗2nmolSO2的同时生成nmolO2
F.混合气体密度不再变化
(2)Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2。电池的总反应可表示为:4Li+2SOCl2═4LiCl+S+SO2。请回答下列问题:
①电池的负极材料为______ ,发生的电极反应为______ ;
②电池正极发生的电极反应为______ ;
③SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。如果把少量水滴到SOCl2中,实验现象是____ ,反应的化学方程式为______
(3)一种以肼(N2H4)为液体燃料的电池装置如图所示。该电池用空气中的氧气作氧化剂,KOH作电解质。负极反应式为______ ,正极反应式为 ____

①从反应开始到达化学平衡,生成SO3的平均反应速率为
②下列叙述能证明该反应已达到化学平衡状态的是
A.容器内压强不再发生变化
B.SO2的体积分数不再发生变化
C.容器内气体原子总数不再发生变化
D.相同时间内消耗2nmolSO2的同时消耗nmolO2
E.相同时间内消耗2nmolSO2的同时生成nmolO2
F.混合气体密度不再变化
(2)Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2。电池的总反应可表示为:4Li+2SOCl2═4LiCl+S+SO2。请回答下列问题:
①电池的负极材料为
②电池正极发生的电极反应为
③SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。如果把少量水滴到SOCl2中,实验现象是
(3)一种以肼(N2H4)为液体燃料的电池装置如图所示。该电池用空气中的氧气作氧化剂,KOH作电解质。负极反应式为

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】2017年11月16日,国土资源部召开新闻发布会,宣布天然气水合物,即“可燃冰”新矿种获得国务院批准,成为我国第173个矿种。“可燃冰”主要成分的分子式是CH4·8H2O,一旦温度升高或压强降低,甲烷气就会逸出,固体水合物便趋于崩解。“可燃冰”将成为人类的后续能源。
(1)将320 g可燃冰释放的甲烷完全燃烧生成液态水时,可放出1 780.6 kJ的能量,则表示甲烷燃烧热的热化学方程式是__________________ 。
(2)CH4不仅是优质的气体燃料,还能利用它和CO2重整,发生反应:CO2(g)+CH4(g) 2CO(g)+2H2(g),获得合成气(主要成分为CO、H2),从而减少温室气体的排放。在一定条件下CH4的平衡转化率与温度及压强(单位:Pa)的关系如图所示。则y点:v(正)
2CO(g)+2H2(g),获得合成气(主要成分为CO、H2),从而减少温室气体的排放。在一定条件下CH4的平衡转化率与温度及压强(单位:Pa)的关系如图所示。则y点:v(正)____ (填“>”、“=”或“<”,下同)v(逆);压强:p1____ p2;该反应的ΔH____ 0。
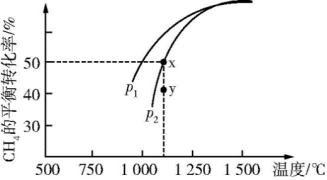
(3)在恒温、p2下,在一容积可变的容器中,达到平衡状态x时四种气体的物质的量均为1 mol,若此时再充入四种气体各1 mol,则平衡____ (填“向左”、“向右”或“不”)移动。
(4)一定条件下,CH4还可与NO2反应,改善雾霾天气,其化学方程式为CH4(g)+2NO2(g) CO2(g)+2H2O(g)+N2(g),在恒温恒容下,下列可以判断该反应达到平衡状态的是
CO2(g)+2H2O(g)+N2(g),在恒温恒容下,下列可以判断该反应达到平衡状态的是____ (填序号)。
a.v逆(N2)=2v正(H2O)
b.混合气体的密度不再变化
c.混合气体的物质的量不再变化
d.单位时间内有1 mol NO2消耗同时消耗1 mol CO2
e.混合气体的平均相对分子质量不变
f.CH4与CO2的物质的量之比不再发生变化
(5)在恒温恒容下,使1 mol CH4(g)与2 mol NO2反应,达平衡后,再往反应器中分别充入下列气体,可以使CH4(g)+2NO2(g) CO2(g)+2H2O(g)+N2(g)中NO2转化率增大的是
CO2(g)+2H2O(g)+N2(g)中NO2转化率增大的是____ (填序号)。
A.CH4 B.CO2 C.物质的量之比为1∶2的CH4与NO2 D.N2
(6)CH4还可以运用到电化学中,某课外小组用CH4为燃料,空气为氧化剂,稀土金属材料作电极,电浮选凝聚法处理污水,设计如图所示装置。则甲烷燃料电池的总反应式为______ 。为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环(如图),A物质的化学式是______ 。
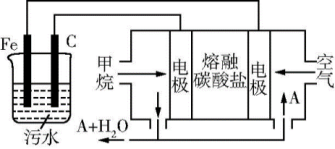
(1)将320 g可燃冰释放的甲烷完全燃烧生成液态水时,可放出1 780.6 kJ的能量,则表示甲烷燃烧热的热化学方程式是
(2)CH4不仅是优质的气体燃料,还能利用它和CO2重整,发生反应:CO2(g)+CH4(g)
 2CO(g)+2H2(g),获得合成气(主要成分为CO、H2),从而减少温室气体的排放。在一定条件下CH4的平衡转化率与温度及压强(单位:Pa)的关系如图所示。则y点:v(正)
2CO(g)+2H2(g),获得合成气(主要成分为CO、H2),从而减少温室气体的排放。在一定条件下CH4的平衡转化率与温度及压强(单位:Pa)的关系如图所示。则y点:v(正)
(3)在恒温、p2下,在一容积可变的容器中,达到平衡状态x时四种气体的物质的量均为1 mol,若此时再充入四种气体各1 mol,则平衡
(4)一定条件下,CH4还可与NO2反应,改善雾霾天气,其化学方程式为CH4(g)+2NO2(g)
 CO2(g)+2H2O(g)+N2(g),在恒温恒容下,下列可以判断该反应达到平衡状态的是
CO2(g)+2H2O(g)+N2(g),在恒温恒容下,下列可以判断该反应达到平衡状态的是a.v逆(N2)=2v正(H2O)
b.混合气体的密度不再变化
c.混合气体的物质的量不再变化
d.单位时间内有1 mol NO2消耗同时消耗1 mol CO2
e.混合气体的平均相对分子质量不变
f.CH4与CO2的物质的量之比不再发生变化
(5)在恒温恒容下,使1 mol CH4(g)与2 mol NO2反应,达平衡后,再往反应器中分别充入下列气体,可以使CH4(g)+2NO2(g)
 CO2(g)+2H2O(g)+N2(g)中NO2转化率增大的是
CO2(g)+2H2O(g)+N2(g)中NO2转化率增大的是A.CH4 B.CO2 C.物质的量之比为1∶2的CH4与NO2 D.N2
(6)CH4还可以运用到电化学中,某课外小组用CH4为燃料,空气为氧化剂,稀土金属材料作电极,电浮选凝聚法处理污水,设计如图所示装置。则甲烷燃料电池的总反应式为

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】能量、速率与限度是认识和研究化学反应的重要视角,回答下列问题:
(1)天然气已成为我国主要的清洁能源,主要成分甲烷( )燃烧时的能量变化如图所示:
)燃烧时的能量变化如图所示:___________ (填字母)
A.甲烷完全燃烧时化学能全部转化为热能
B.由图可知二氧化碳比甲烷稳定
C.标准状况下,1mol甲烷完全燃烧时放出802kJ的热量
D.该反应中断键吸收的总能量低于形成键放出的总能量
②已知断开部分化学键需要的能量为,C―H:a kJ/mol,O=O:b kJ/mol,C=O:c kJ/mol,则形成1mol O―H释放的能量为___________ kJ。
(2)一定温度下在容积可变的密闭容器中投入10mol 和6mol
和6mol ,发生反应:
,发生反应:
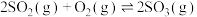
 。下列情况能说明该反应达到化学平衡的是
。下列情况能说明该反应达到化学平衡的是___________ 。
A.体系的压强保持不变
B.混合气体的密度保持不变
C.单位时间内生成1mol 的同时断开0.5mol O=O键
的同时断开0.5mol O=O键
D.混合气体的平均相对分子质量保持不变
E. 和
和 的物质的量之比保持不变
的物质的量之比保持不变
(3)在一定条件下,二氧化硫和氧气反应过程中各物质物质的量浓度变化如图所示,根据图中判断,___________ ;20min时改变的反应条件可能是___________ 。
a加入催化剂 b.缩小容器容积 c.升高温度 d.增加 的物质的量
的物质的量
②第12min时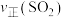
___________ 第18min时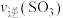 填(“>”“<”“=”或“无法比较”)。
填(“>”“<”“=”或“无法比较”)。
(1)天然气已成为我国主要的清洁能源,主要成分甲烷(
 )燃烧时的能量变化如图所示:
)燃烧时的能量变化如图所示:
A.甲烷完全燃烧时化学能全部转化为热能
B.由图可知二氧化碳比甲烷稳定
C.标准状况下,1mol甲烷完全燃烧时放出802kJ的热量
D.该反应中断键吸收的总能量低于形成键放出的总能量
②已知断开部分化学键需要的能量为,C―H:a kJ/mol,O=O:b kJ/mol,C=O:c kJ/mol,则形成1mol O―H释放的能量为
(2)一定温度下在容积可变的密闭容器中投入10mol
 和6mol
和6mol ,发生反应:
,发生反应: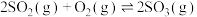
 。下列情况能说明该反应达到化学平衡的是
。下列情况能说明该反应达到化学平衡的是A.体系的压强保持不变
B.混合气体的密度保持不变
C.单位时间内生成1mol
 的同时断开0.5mol O=O键
的同时断开0.5mol O=O键D.混合气体的平均相对分子质量保持不变
E.
 和
和 的物质的量之比保持不变
的物质的量之比保持不变(3)在一定条件下,二氧化硫和氧气反应过程中各物质物质的量浓度变化如图所示,根据图中判断,

a加入催化剂 b.缩小容器容积 c.升高温度 d.增加
 的物质的量
的物质的量②第12min时
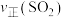
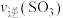 填(“>”“<”“=”或“无法比较”)。
填(“>”“<”“=”或“无法比较”)。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】研究NOx、CO、SO2等大气污染气体的治理,对保护环境有重要的意义。回答下列问题:
(1)在一定温度下,向2L的恒容密闭容器中充入4.0molNO2和4.0molCO,在催化剂作用下发生反应:2NO2(g)+4CO(g) N2(g)+4CO2(g),测得相关数据如下:
N2(g)+4CO2(g),测得相关数据如下:
①其他条件不变,若不使用催化剂,则0~5minNO2的转化率将___________ (填“变大”、“变小”或“不变”)。
②以下表述能说明该反应已达到平衡状态的是___________ 。
A.CO的反应速率为N2的4倍 B.气体的颜色不再变化
C.化学平衡常数K不再变化 D.混合气的压强不再变化
③该温度下反应的化学平衡常数K=___________ (保留两位有效数字)。
④在20min时,保持温度不变,继续向容器中再加入2.0molNO2和2.0molN2,则化学平衡___________ 移动(填“正向”、“逆向”或“不”)。
(2)在高效催化剂的作用下用CH4还原NO2,也可消除氮氧化物的污染。CH4还原NO2反应的化学方程式为___________ 。
(1)在一定温度下,向2L的恒容密闭容器中充入4.0molNO2和4.0molCO,在催化剂作用下发生反应:2NO2(g)+4CO(g)
 N2(g)+4CO2(g),测得相关数据如下:
N2(g)+4CO2(g),测得相关数据如下:| 0min | 5min | 10min | 15min | 20min | |
| c(NO2)/mol·L−1 | 2.0 | 1.7 | 1.56 | 1.5 | 1.5 |
| c(N2)/mol·L−1 | 0 | 0.15 | 0.22 | 0.25 | 0.25 |
②以下表述能说明该反应已达到平衡状态的是
A.CO的反应速率为N2的4倍 B.气体的颜色不再变化
C.化学平衡常数K不再变化 D.混合气的压强不再变化
③该温度下反应的化学平衡常数K=
④在20min时,保持温度不变,继续向容器中再加入2.0molNO2和2.0molN2,则化学平衡
(2)在高效催化剂的作用下用CH4还原NO2,也可消除氮氧化物的污染。CH4还原NO2反应的化学方程式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】我国提出努力争取2060年前实现碳中和目标,通过反应将 转化为
转化为 是实现该目标的一种方式。回答下列问题:
是实现该目标的一种方式。回答下列问题:
(1)向 恒容密闭容器中充入
恒容密闭容器中充入 和
和 ,发生反应
,发生反应 测定不同温度下
测定不同温度下 的平衡转化率如表所示。
的平衡转化率如表所示。
①该反应的
___________ (填“>”或“<”)0
已知: ,
,
则反应

___________ (用 和
和 表示)。
表示)。
②下列有利于增大 的平衡转化率的措施为
的平衡转化率的措施为___________ (填标号)。
a.增大反应体系的压强 b.增大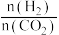
c.降低反应温度 d.移出
(3)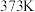 下,该反应的平衡常数
下,该反应的平衡常数
___________ (用含 的代数式表示)。
的代数式表示)。
(2)浙江大学某实验室用水热法还原 转化为
转化为 ,探究了不同条件下
,探究了不同条件下 的转化率,数据如图所示。
的转化率,数据如图所示。
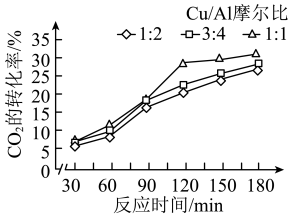
根据以上数据,最佳的Cu/Al摩尔比和反应时间分别是___________ 、___________ 。
 转化为
转化为 是实现该目标的一种方式。回答下列问题:
是实现该目标的一种方式。回答下列问题:(1)向
 恒容密闭容器中充入
恒容密闭容器中充入 和
和 ,发生反应
,发生反应 测定不同温度下
测定不同温度下 的平衡转化率如表所示。
的平衡转化率如表所示。 | 373 | 473 | 573 | 673 |
 的平衡转化率 的平衡转化率 |  | 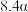 | 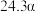 | 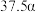 |

已知:
 ,
,则反应


 和
和 表示)。
表示)。②下列有利于增大
 的平衡转化率的措施为
的平衡转化率的措施为a.增大反应体系的压强 b.增大
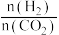
c.降低反应温度 d.移出

(3)
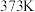 下,该反应的平衡常数
下,该反应的平衡常数
 的代数式表示)。
的代数式表示)。(2)浙江大学某实验室用水热法还原
 转化为
转化为 ,探究了不同条件下
,探究了不同条件下 的转化率,数据如图所示。
的转化率,数据如图所示。
根据以上数据,最佳的Cu/Al摩尔比和反应时间分别是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】H2和CO2的资源化可以推动经济高质量发展和生态环境质量的持续改善。
请回答下列问题:
(1)已知:Ⅰ.2H2(g)+O2(g)=2H2O(g)△H1=﹣483.6kJ/mol
Ⅱ.CH4(g)+2O2(g)⇌CO2(g)+2H2O(g)ΔH2=﹣802.0kJ/mol
Ⅲ.4H2(g)+CO2(g)⇌CH4(g)+2H2O(g)ΔH3
若反应Ⅲ的逆反应活化能为EakJ/mol,则正反应活化能为___________ kJ/mol(用含Ea和必要的数值的式子表示);能表示反应Ⅱ已达平衡状态的是 ___________ (填字母)。
A.单位时间内生成1molCO2的同时消耗了1molCH4
B.在恒温恒容的容器中,混合气体的密度保持不变
C.在绝热恒容的容器中,反应的平衡常数不再变化
D.在恒温恒压的容器中,气体的平均摩尔质量不再变化
(2)CO2和M2CO3反应制备MHCO3.某学习兴趣小组为了研究该反应,将足量的某碳酸氢盐(MHCO3)固体置于真空恒容密闭容器中,发生如下反应:2MHCO3(s) M2CO3(s)+H2O(g)+CO2(g)。反应达平衡时体系的总压为50kPa.保持温度不变,开始时在体系中先通入一定量的CO2(g),再加入足量MHCO3(s),欲使平衡时体系中水蒸气的分压小于5kPa,则CO2(g)平衡时压强应大于
M2CO3(s)+H2O(g)+CO2(g)。反应达平衡时体系的总压为50kPa.保持温度不变,开始时在体系中先通入一定量的CO2(g),再加入足量MHCO3(s),欲使平衡时体系中水蒸气的分压小于5kPa,则CO2(g)平衡时压强应大于 ___________ kPa。
(3)CO2和H2制备甲醇,反应体系中涉及以下两个反应:
Ⅰ.CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)ΔH1<0
Ⅱ.CO2(g)+H2(g)⇌CO(g)+H2O(g)ΔH2>0
将CO2和H2按物质的量之比1:3混合通入刚性密闭容器中,在催化剂作用下发生反应Ⅰ和反应Ⅱ,在相同的时间内CH3OH的选择性和产率随温度的变化如图所示。

已知:CH3OH的选择性=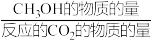 ×100%。
×100%。
①在上述条件下合成甲醇的工业条件是___________ 。
A.230℃ B.250℃ C.催化CZT D.催化剂CZ(Zr﹣1)T
②为提高CH3OH的选择性,可采取的措施有___________ 、___________ 。
③在温度230℃时,向某容器中充入1molCO2和3molH2,发生反应Ⅰ。如果该容器为恒压容器,维持体系总压强p恒定,达到平衡时2的转化率为75%,则在该温度下平衡常数Kp=___________ ;如果该容器为恒容容器,达到平衡时,H2的转化率 ___________ (填“>”、“<”或“=”)75%,理由是 ___________ 。
请回答下列问题:
(1)已知:Ⅰ.2H2(g)+O2(g)=2H2O(g)△H1=﹣483.6kJ/mol
Ⅱ.CH4(g)+2O2(g)⇌CO2(g)+2H2O(g)ΔH2=﹣802.0kJ/mol
Ⅲ.4H2(g)+CO2(g)⇌CH4(g)+2H2O(g)ΔH3
若反应Ⅲ的逆反应活化能为EakJ/mol,则正反应活化能为
A.单位时间内生成1molCO2的同时消耗了1molCH4
B.在恒温恒容的容器中,混合气体的密度保持不变
C.在绝热恒容的容器中,反应的平衡常数不再变化
D.在恒温恒压的容器中,气体的平均摩尔质量不再变化
(2)CO2和M2CO3反应制备MHCO3.某学习兴趣小组为了研究该反应,将足量的某碳酸氢盐(MHCO3)固体置于真空恒容密闭容器中,发生如下反应:2MHCO3(s)
 M2CO3(s)+H2O(g)+CO2(g)。反应达平衡时体系的总压为50kPa.保持温度不变,开始时在体系中先通入一定量的CO2(g),再加入足量MHCO3(s),欲使平衡时体系中水蒸气的分压小于5kPa,则CO2(g)平衡时压强应大于
M2CO3(s)+H2O(g)+CO2(g)。反应达平衡时体系的总压为50kPa.保持温度不变,开始时在体系中先通入一定量的CO2(g),再加入足量MHCO3(s),欲使平衡时体系中水蒸气的分压小于5kPa,则CO2(g)平衡时压强应大于 (3)CO2和H2制备甲醇,反应体系中涉及以下两个反应:
Ⅰ.CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)ΔH1<0
Ⅱ.CO2(g)+H2(g)⇌CO(g)+H2O(g)ΔH2>0
将CO2和H2按物质的量之比1:3混合通入刚性密闭容器中,在催化剂作用下发生反应Ⅰ和反应Ⅱ,在相同的时间内CH3OH的选择性和产率随温度的变化如图所示。

已知:CH3OH的选择性=
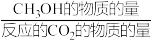 ×100%。
×100%。①在上述条件下合成甲醇的工业条件是
A.230℃ B.250℃ C.催化CZT D.催化剂CZ(Zr﹣1)T
②为提高CH3OH的选择性,可采取的措施有
③在温度230℃时,向某容器中充入1molCO2和3molH2,发生反应Ⅰ。如果该容器为恒压容器,维持体系总压强p恒定,达到平衡时2的转化率为75%,则在该温度下平衡常数Kp=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】锑钾[Sb-K]合金、镍钴锰酸锂[LiNixCoyMn(1-x-y)O2]、磷酸铁钠[NaFePO4]分别作为钾离子电池、三元锂离子电池、钠离子电池的电极材料。这些电池成为目前实现碳中和研发的热点。请按要求回答下列问题。
(1)上述电池涉及的主族元素中,电负性最大的是_______ 。
(2)Sb是比P的周期数大2的同主族元素。基态Sb原子价电子排布式为_______ 。
(3)在回收电极材料中的Co时,测得溶液中c(Co2+)=1.0 mol·L-1,通入NH3生成 Co(OH)2沉淀,则Co2+沉淀完全时溶液的c(OH-)最小为_______ mol·L-1,(已知沉淀完全时c(Co2+)≤1.0×10-5 mol·L-1,此温度下Ksp[Co(OH)2]=4.0×10-15,溶液体积变化忽略不计)。
(4)钠离子电池电极材料制备:向含Fe3+的溶液中加入过量Na2HPO4溶液,过滤后 进一步处理得FePO4沉淀。然后将FePO4与NaI混合,在He气氛中加热,制得NaFePO4.已知常温下

 +H+ ,Ka2 =6.2×10-8,
+H+ ,Ka2 =6.2×10-8, 

 +H+Ka3 =4.8×10-13。
+H+Ka3 =4.8×10-13。
①钠离子电池工作时,NaFePO4转化为FePO4,则NaFePO4在电池_______ (填"正" 或"负”)极放电。
②NaI在制NaFePO4的反应中的作用:_______ 。
③Na2HPO4溶液中含P元素离子的浓度由大到小的顺序为_______ 。
(5)立方晶系锑钾合金的晶胞结构如图1所示,其中晶胞的一部分如图2所示。

①该晶胞中,Sb和K的原子数之比为_______ 。
②该晶体的密度为_______ g·cm-3(设阿伏加德罗常数的值为NA,用含a、NA的代数式表示)
(1)上述电池涉及的主族元素中,电负性最大的是
(2)Sb是比P的周期数大2的同主族元素。基态Sb原子价电子排布式为
(3)在回收电极材料中的Co时,测得溶液中c(Co2+)=1.0 mol·L-1,通入NH3生成 Co(OH)2沉淀,则Co2+沉淀完全时溶液的c(OH-)最小为
(4)钠离子电池电极材料制备:向含Fe3+的溶液中加入过量Na2HPO4溶液,过滤后 进一步处理得FePO4沉淀。然后将FePO4与NaI混合,在He气氛中加热,制得NaFePO4.已知常温下


 +H+ ,Ka2 =6.2×10-8,
+H+ ,Ka2 =6.2×10-8, 

 +H+Ka3 =4.8×10-13。
+H+Ka3 =4.8×10-13。①钠离子电池工作时,NaFePO4转化为FePO4,则NaFePO4在电池
②NaI在制NaFePO4的反应中的作用:
③Na2HPO4溶液中含P元素离子的浓度由大到小的顺序为
(5)立方晶系锑钾合金的晶胞结构如图1所示,其中晶胞的一部分如图2所示。

①该晶胞中,Sb和K的原子数之比为
②该晶体的密度为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】现有常温下的六份溶液:①0.01mol/LCH3COOH溶液;②0.01mol/LHCl溶液;③pH=12的氨水;④pH=12的NaOH溶液;⑤0.01mol/LCH3COOH溶液与 pH=12的氨水等体积混合后所得溶液;⑥0.01mol/LHCl溶液与 pH=12的NaOH溶液等体积混合所得溶液。
(1)其中水的电离程度最大的是________ (选填序号);
(2)若将②、③混合后所得溶液 pH=7,则消耗溶液的体积:②______ ③(选填“>”、“<”或“=”,下同);若将②、③溶液等体积混合后,所得溶液 pH_____________ 7。
(3)若将①、④溶液按体积比为2:1混合后,所得溶液pH______ 7(选填“>”、“<”或“=”)此时溶液中除水分子外的各微粒的浓度由大到小的顺序为:__________ ;将①、④混合,若有c(CH3COO-)>c(H+),则混合液可能呈_________ (填序号)。
a.酸性 b.碱性 c.中性
(1)其中水的电离程度最大的是
(2)若将②、③混合后所得溶液 pH=7,则消耗溶液的体积:②
(3)若将①、④溶液按体积比为2:1混合后,所得溶液pH
a.酸性 b.碱性 c.中性
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐3】如图所示的转化关系中,已知A是由短周期元素组成的酸式盐。D、Y、H为气体,X为无色液体,G和K均是常见的强酸。H与Na2O2可发生化合反应,生成的盐与Ba2+反应可生成不溶于稀G的白色沉淀,一个D分子中含有10个电子。

请回答下列问题:
(1)用电子式表示X的形成过程:____________________ 。
(2)写出D、H、X反应生成A的离子反应方程式:____________________ 。
(3)已知:2H(g)+Y(g)⇌2I(g)△H=-196.6 kJ•mol-1.当加入4 mol H和2 mol Y后,放出345 kJ的热量时,H的转化率最接近于__________(填字母)。
(4)写出D与K反应生成的正盐溶液中的离子浓度大小关系:__________________ 。
(5)一定温度下,有可逆反应:Ad(g)+bY(g)⇌cE(g)+dX(g)。在2L密闭容器中,充入4mol D和5mol Y,有催化剂存在下,2min后反应达到平衡,测得平衡时容器内的压强比反应前增加了 ,则前2min内用E表示的平均反应速率为
,则前2min内用E表示的平均反应速率为________ mol•L-1•min-1,平衡时D的浓度为__________ mol•L-1。

请回答下列问题:
(1)用电子式表示X的形成过程:
(2)写出D、H、X反应生成A的离子反应方程式:
(3)已知:2H(g)+Y(g)⇌2I(g)△H=-196.6 kJ•mol-1.当加入4 mol H和2 mol Y后,放出345 kJ的热量时,H的转化率最接近于__________(填字母)。
| A.40% | B.50% | C.80% | D.90% |
(5)一定温度下,有可逆反应:Ad(g)+bY(g)⇌cE(g)+dX(g)。在2L密闭容器中,充入4mol D和5mol Y,有催化剂存在下,2min后反应达到平衡,测得平衡时容器内的压强比反应前增加了
 ,则前2min内用E表示的平均反应速率为
,则前2min内用E表示的平均反应速率为
您最近一年使用:0次



