氮及其化合物在工农业生产、生活中有重要作用。请按要求回答下列相关问题:
(1)汽车发动机工作时也会引发N2和O2反应产生大气污染物NO,其能量变化示意图为
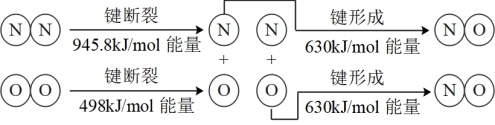
则该反应的热化学方程式为___ 。
(2)工业合成氨的反应:N2(g)+3H2(g) 2NH3(g) △H<0,分别在T1、T2温度下,改变起始氢气物质的量,测得平衡时氨的体积分数如图所示:
2NH3(g) △H<0,分别在T1、T2温度下,改变起始氢气物质的量,测得平衡时氨的体积分数如图所示:
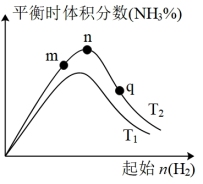
①比较在m、n、q三点所处的平衡状态中,反应物N2的转化率最高的是___ 点。
②T2条件下,在2L的密闭容器中,充入xmolN2和ymolH2时,3min达平衡,此时反应物的转化率均为a,写出下列仅含a、x的表达式(不必化简):v(N2)=___ ;该反应的平衡常数的值K=___ 。
③图象中T2___ T1(填“高于”、“低于”、“等于”或“无法确定”)。
(1)汽车发动机工作时也会引发N2和O2反应产生大气污染物NO,其能量变化示意图为

则该反应的热化学方程式为
(2)工业合成氨的反应:N2(g)+3H2(g)
 2NH3(g) △H<0,分别在T1、T2温度下,改变起始氢气物质的量,测得平衡时氨的体积分数如图所示:
2NH3(g) △H<0,分别在T1、T2温度下,改变起始氢气物质的量,测得平衡时氨的体积分数如图所示:
①比较在m、n、q三点所处的平衡状态中,反应物N2的转化率最高的是
②T2条件下,在2L的密闭容器中,充入xmolN2和ymolH2时,3min达平衡,此时反应物的转化率均为a,写出下列仅含a、x的表达式(不必化简):v(N2)=
③图象中T2
更新时间:2019-11-01 12:25:35
|
相似题推荐
填空题
|
较难
(0.4)
名校
【推荐1】甲醇作为基本的有机化工产品和环保动力燃料具有广阔的应用前景,CO2 加氢合成甲醇是合理利用 CO2 的有效途径。由 CO2 制备甲醇过程可能涉及反应如下:
反应Ⅰ:CO2(g)+H2(g) CO(g)+H2O(g) ΔH1=+41.19 kJ·mol-1
CO(g)+H2O(g) ΔH1=+41.19 kJ·mol-1
反应Ⅱ:CO(g)+2H2(g) CH3OH(g) ΔH2
CH3OH(g) ΔH2
反应Ⅲ:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH3=-49.58 kJ·mol-1
CH3OH(g)+H2O(g) ΔH3=-49.58 kJ·mol-1
回答下列问题:
(1)反应Ⅲ的 ΔS_____ (填“<”、“=”或“>”)0;反应Ⅱ的 ΔH2=_____ 。
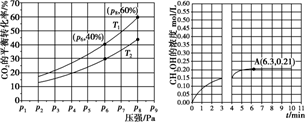
(2)在恒压密闭容器中,充入一定量的 H2 和 CO2(假定仅发生反应Ⅲ),实验测得反应物在不同温度下,反应体系中 CO2 的平衡转化率与压强的关系曲线如图所示。
①比较 T1与 T2 的大小关系:T1_____ T2 (填“ < ”、“= ”或“> ”) ,理由是:_____ 。
②在 T1 和 p6 的条件下,往密闭容器中充入 3 mol H2 和 1 mol CO2,该反应在第 5 min 时达到平衡,此时容器的体积为 1.8 L,则该反应在此温度下的平衡常数为_____ 。
a.若此条件下反应至 3 min 时刻,改变条件并于 A 点处达到平衡,CH3OH 的浓度随反应时间的变化趋势如图所示(3~4 min 的浓度变化未表示出来),则改变的条件为_____ ,请用 H2 的浓度变化计算从4 min 开始到A点的反应速率v(H2)=_____ (保留两位小数)。
b.若温度不变,压强恒定在 p8 的条件下重新达到平衡时,容器的体积变为_____ L。
反应Ⅰ:CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH1=+41.19 kJ·mol-1
CO(g)+H2O(g) ΔH1=+41.19 kJ·mol-1反应Ⅱ:CO(g)+2H2(g)
 CH3OH(g) ΔH2
CH3OH(g) ΔH2反应Ⅲ:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH3=-49.58 kJ·mol-1
CH3OH(g)+H2O(g) ΔH3=-49.58 kJ·mol-1回答下列问题:
(1)反应Ⅲ的 ΔS

(2)在恒压密闭容器中,充入一定量的 H2 和 CO2(假定仅发生反应Ⅲ),实验测得反应物在不同温度下,反应体系中 CO2 的平衡转化率与压强的关系曲线如图所示。
①比较 T1与 T2 的大小关系:T1
②在 T1 和 p6 的条件下,往密闭容器中充入 3 mol H2 和 1 mol CO2,该反应在第 5 min 时达到平衡,此时容器的体积为 1.8 L,则该反应在此温度下的平衡常数为
a.若此条件下反应至 3 min 时刻,改变条件并于 A 点处达到平衡,CH3OH 的浓度随反应时间的变化趋势如图所示(3~4 min 的浓度变化未表示出来),则改变的条件为
b.若温度不变,压强恒定在 p8 的条件下重新达到平衡时,容器的体积变为
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐2】CO、H2、CH3OH均是清洁能源。
(1)已知部分化学键键能数据如下:
2CO(g) +O2(g)==2CO2(g) H1 H2O(g)+CO(g)==H2(g) + CO2(g)
H1 H2O(g)+CO(g)==H2(g) + CO2(g)  H2 = -41 kJ•mol-1
H2 = -41 kJ•mol-1
CH3OH(g)+ 3/2O2(g)==CO2(g)+2H2O(g) H3 = -660kJ•mol-1
H3 = -660kJ•mol-1
则△H1=_____ kJ•mol-1,反应CO(g)+2H2(g) CH3OH(g)的△H=
CH3OH(g)的△H=_____ kJ•mol-1。
(2)一定条件下,在容积为2 L的密闭容器Q中充入a mol CO与b molH2合成甲醇:CO(g) +2H2(g) CH3OH(g)。测得平衡时混合气体中CH3OH的体积百分含量与温度、 压强之间的关系如图1所示,图2表示在一定温度下,H2的平衡转化率与反应开始时两种反应物的投料物质的量之比(用X表示)、压强之间的关系。
CH3OH(g)。测得平衡时混合气体中CH3OH的体积百分含量与温度、 压强之间的关系如图1所示,图2表示在一定温度下,H2的平衡转化率与反应开始时两种反应物的投料物质的量之比(用X表示)、压强之间的关系。

①压强相同时,温度为T1、T2时,反应达到平衡所需要的时间分别为t1、t2,则二者之间的相对大小为t1___ t2(填“>”、“<”、“=”或“无法确定”)。
②P1_____ P2(填“>”、“<”、“=”或“无法确定”)。
③若a =2,b=4,则压强为P1、温度为T1时该反应的平衡常数K=______________ 。
④若在压强为P1、温度为T1时,向Q容器中同时加入等物质的量的CO、H2、CH3OH三种气体,则反应开始时,v(CH3OH)正_____ v(CH3OH)逆(填“>”、“<”、“=”或“无法确定”)。
(1)已知部分化学键键能数据如下:
| 化学键 | C O O | O=O | C=O | C-O |
| E/(kJ • mol-1) | 958.5 | 497 | 745 | 351 |
2CO(g) +O2(g)==2CO2(g)
 H1 H2O(g)+CO(g)==H2(g) + CO2(g)
H1 H2O(g)+CO(g)==H2(g) + CO2(g)  H2 = -41 kJ•mol-1
H2 = -41 kJ•mol-1 CH3OH(g)+ 3/2O2(g)==CO2(g)+2H2O(g)
 H3 = -660kJ•mol-1
H3 = -660kJ•mol-1则△H1=
 CH3OH(g)的△H=
CH3OH(g)的△H=(2)一定条件下,在容积为2 L的密闭容器Q中充入a mol CO与b molH2合成甲醇:CO(g) +2H2(g)
 CH3OH(g)。测得平衡时混合气体中CH3OH的体积百分含量与温度、 压强之间的关系如图1所示,图2表示在一定温度下,H2的平衡转化率与反应开始时两种反应物的投料物质的量之比(用X表示)、压强之间的关系。
CH3OH(g)。测得平衡时混合气体中CH3OH的体积百分含量与温度、 压强之间的关系如图1所示,图2表示在一定温度下,H2的平衡转化率与反应开始时两种反应物的投料物质的量之比(用X表示)、压强之间的关系。
①压强相同时,温度为T1、T2时,反应达到平衡所需要的时间分别为t1、t2,则二者之间的相对大小为t1
②P1
③若a =2,b=4,则压强为P1、温度为T1时该反应的平衡常数K=
④若在压强为P1、温度为T1时,向Q容器中同时加入等物质的量的CO、H2、CH3OH三种气体,则反应开始时,v(CH3OH)正
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
解题方法
【推荐3】NH3、N2H4在工业生产和国防建设中都有广泛应用。回答下列问题:
(1)①N2H4 (g) ⇌ N2(g)+2H2(g) △H1
②N2(g)+3H2(g) ⇌ 2NH3(g) △H2
③7N2H4(g) ⇌ 8NH3(g)+3N2(g)+2H2(g) △H3
△H3=___________ (用含△H1和△H2的代数式表示),反应③的平衡行数表达式为K=___________ 。
(2)纳米钴的催化作用下,N2H4可分解生成两种气体,其中一种能使湿润的红色石蕊试纸变蓝。当反应在不同温度下达到平衡时,混合气体中各组分的体积分数如图所示。
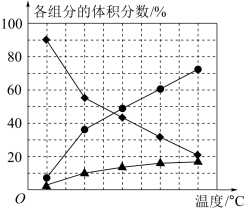
该反应的△H_____________ (填“>”或“<”)0,N2H4发生分解反应的化学方程式为________ 。
(1)①N2H4 (g) ⇌ N2(g)+2H2(g) △H1
②N2(g)+3H2(g) ⇌ 2NH3(g) △H2
③7N2H4(g) ⇌ 8NH3(g)+3N2(g)+2H2(g) △H3
△H3=
(2)纳米钴的催化作用下,N2H4可分解生成两种气体,其中一种能使湿润的红色石蕊试纸变蓝。当反应在不同温度下达到平衡时,混合气体中各组分的体积分数如图所示。

该反应的△H
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐1】研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
I.已知:NO2(g)+SO2(g) SO3(g)+NO(g)
SO3(g)+NO(g)
(1)一定条件下,将NO2与SO2以体积比1:2置于恒容密闭容器中发生上述反应,下列能说明反应达到平衡状态的是________ 。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO2和NO2的体积比保持不变 d.每消耗1 mol SO3的同时生成1 molNO2
e.气体密度保持不变
(2)若保持体积不变,升高温度,体系颜色加深,则说明该反应的∆H________ 0(填”>””<”或”=”)
II.对于反应2SO2(g)+O2(g) 2SO3(g);ΔH=-196.6kJ/mol。
2SO3(g);ΔH=-196.6kJ/mol。
在一定温度下,向一个容积不变的容器中,通入3mol SO2和2mol O2及固体催化剂,使之反应。平衡时容器内气体压强为起始时的90%。此时
(3)加入3mol SO2和2mol O2发生反应,达到平衡时,放出的热量为___________ 。
(4)保持同一温度,在相同的容器中,将起始物质的量改为amol SO2、bmol O2、cmol SO3(g)及固体催化剂,欲使起始时反应表现为向正反应方向进行,且平衡时SO3的体积分数为2/9,a的取值范围是____________ 。
(5)保持同一温度,在相同容器中,将起始物质的量改为3mol SO2、6mol O2、3mol SO3(g)及固体催化剂,则平衡_________ 移动。(填“正向、不、逆向或无法确定是否”)
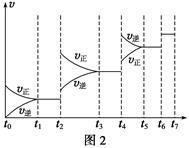
(6)某SO2(g)和O2(g)体系,时间t1达到平衡后,改变某一外界条件,反应速率v与时间t的关系如图2所示,若不改变SO2(g)和O2(g)的量,则图中t4时引起平衡移动的条件可能是__________ ;图中表示平衡混合物中SO3的含量最高的一段时间是____________ 。
(7)各阶段平衡时对应的平衡常数如下表所示:
K1、K2、K3、K4之间的关系为__________________ 。
I.已知:NO2(g)+SO2(g)
 SO3(g)+NO(g)
SO3(g)+NO(g)(1)一定条件下,将NO2与SO2以体积比1:2置于恒容密闭容器中发生上述反应,下列能说明反应达到平衡状态的是
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO2和NO2的体积比保持不变 d.每消耗1 mol SO3的同时生成1 molNO2
e.气体密度保持不变
(2)若保持体积不变,升高温度,体系颜色加深,则说明该反应的∆H
II.对于反应2SO2(g)+O2(g)
 2SO3(g);ΔH=-196.6kJ/mol。
2SO3(g);ΔH=-196.6kJ/mol。在一定温度下,向一个容积不变的容器中,通入3mol SO2和2mol O2及固体催化剂,使之反应。平衡时容器内气体压强为起始时的90%。此时
(3)加入3mol SO2和2mol O2发生反应,达到平衡时,放出的热量为
(4)保持同一温度,在相同的容器中,将起始物质的量改为amol SO2、bmol O2、cmol SO3(g)及固体催化剂,欲使起始时反应表现为向正反应方向进行,且平衡时SO3的体积分数为2/9,a的取值范围是
(5)保持同一温度,在相同容器中,将起始物质的量改为3mol SO2、6mol O2、3mol SO3(g)及固体催化剂,则平衡
(6)某SO2(g)和O2(g)体系,时间t1达到平衡后,改变某一外界条件,反应速率v与时间t的关系如图2所示,若不改变SO2(g)和O2(g)的量,则图中t4时引起平衡移动的条件可能是

(7)各阶段平衡时对应的平衡常数如下表所示:
| t1~t2 | t3~t4 | t5~t6 | t6~t7 |
| K1 | K2 | K3 | K4 |
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
解题方法
【推荐2】中央经济工作会议强调要“加快新能源、绿色低碳等前沿技术研发和应用推广”。 甲烷化是目前研究的热点方向之一,在环境保护方面显示出较大潜力。其主要反应如下:
甲烷化是目前研究的热点方向之一,在环境保护方面显示出较大潜力。其主要反应如下:
反应Ⅰ:

反应Ⅱ:

回答下列问题:
(1)在体积相等的多个恒容密闭容器中。分别充入 和
和 发生上述反应Ⅰ(忽略反应Ⅱ),在不同温度下反应相同时间,测得
发生上述反应Ⅰ(忽略反应Ⅱ),在不同温度下反应相同时间,测得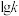 、
、 转化率与温度关系如图所示。已知该反应的速率方程为
转化率与温度关系如图所示。已知该反应的速率方程为 ,
, ,其中
,其中 、
、 为速率常数,只受温度影响。图中信息可知,代表
为速率常数,只受温度影响。图中信息可知,代表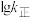 曲线的是
曲线的是_____ (填“MH”或“NG”),反应Ⅰ活化大能 (正)
(正)_____  (逆)(填“>”或“<”);c点的K(平衡常数)与Q(浓度商)的等式关系
(逆)(填“>”或“<”);c点的K(平衡常数)与Q(浓度商)的等式关系_____ (用含 、
、 的代数式表示),
的代数式表示), 温度下反应达到平衡,体系压强为p,则
温度下反应达到平衡,体系压强为p,则 的分压
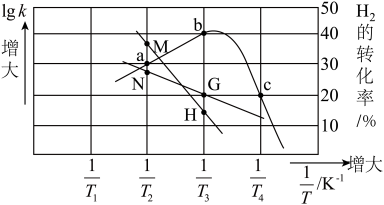
的分压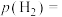
_____ 。
(2)向恒压密闭装置充入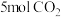 和
和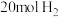 ,不同温度下同时发生反应Ⅰ、Ⅱ,达到平衡时其中两种含碳物质的物质的量
,不同温度下同时发生反应Ⅰ、Ⅱ,达到平衡时其中两种含碳物质的物质的量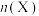 与温度T的关系如图所示:图中缺少
与温度T的关系如图所示:图中缺少_____ (填含碳物质的分子式);物质的量与温度的关系变化曲线,随温度升高该物质的变化趋势为_____ ,800℃时, 的产率为
的产率为_____ 。
 甲烷化是目前研究的热点方向之一,在环境保护方面显示出较大潜力。其主要反应如下:
甲烷化是目前研究的热点方向之一,在环境保护方面显示出较大潜力。其主要反应如下:反应Ⅰ:


反应Ⅱ:


回答下列问题:
(1)在体积相等的多个恒容密闭容器中。分别充入
 和
和 发生上述反应Ⅰ(忽略反应Ⅱ),在不同温度下反应相同时间,测得
发生上述反应Ⅰ(忽略反应Ⅱ),在不同温度下反应相同时间,测得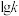 、
、 转化率与温度关系如图所示。已知该反应的速率方程为
转化率与温度关系如图所示。已知该反应的速率方程为 ,
, ,其中
,其中 、
、 为速率常数,只受温度影响。图中信息可知,代表
为速率常数,只受温度影响。图中信息可知,代表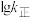 曲线的是
曲线的是 (正)
(正) (逆)(填“>”或“<”);c点的K(平衡常数)与Q(浓度商)的等式关系
(逆)(填“>”或“<”);c点的K(平衡常数)与Q(浓度商)的等式关系 、
、 的代数式表示),
的代数式表示), 温度下反应达到平衡,体系压强为p,则
温度下反应达到平衡,体系压强为p,则 的分压
的分压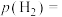

(2)向恒压密闭装置充入
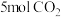 和
和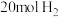 ,不同温度下同时发生反应Ⅰ、Ⅱ,达到平衡时其中两种含碳物质的物质的量
,不同温度下同时发生反应Ⅰ、Ⅱ,达到平衡时其中两种含碳物质的物质的量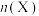 与温度T的关系如图所示:图中缺少
与温度T的关系如图所示:图中缺少 的产率为
的产率为
您最近一年使用:0次
【推荐3】已知T K时,某恒容密闭容器中存在如下反应:2CO2(g)+6H2(g)  CH3OCH3(g)+3H2O(g) ΔH<0,测得容器中不同时刻时各物质的浓度(mol/L)如下表所示:
CH3OCH3(g)+3H2O(g) ΔH<0,测得容器中不同时刻时各物质的浓度(mol/L)如下表所示:
(1)上述反应平衡常数K的表达式为________________ 。
(2)既能提高反应速率,又能提高H2转化率的方法是__________ (填写一条即可)。
(3)若T K时,化学平衡常数K=15,则10s 时v(正)______ v(逆)(填“>”“<”或“=”),此时CO2的转化率=________________ 。
(4)能说明上述可逆反应达到化学平衡的是___________ 。
A. 混合气体的平均摩尔质量不再变化
B. 混合气体的密度不再变化
C. c(H2)/c(CH3OCH3)的比值不再变化
D. 容器内的压强不再变化
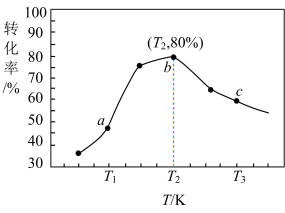
(5)一定条件下,向某恒容密闭容器中充入2 mol CO2和3 mol H2,发生的反应为 CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=−50 kJ·mol−1。测得在相同时间内不同温度下H2的转化率如图所示,则在该时间段内恰好达到化学平衡时,容器内的压强与反应开始时的压强之比为
CH3OH(g)+H2O(g) ΔH=−50 kJ·mol−1。测得在相同时间内不同温度下H2的转化率如图所示,则在该时间段内恰好达到化学平衡时,容器内的压强与反应开始时的压强之比为___________ 。
 CH3OCH3(g)+3H2O(g) ΔH<0,测得容器中不同时刻时各物质的浓度(mol/L)如下表所示:
CH3OCH3(g)+3H2O(g) ΔH<0,测得容器中不同时刻时各物质的浓度(mol/L)如下表所示:| c(CO2) | c(H2) | c(CH3OCH3) | c(H2O) | |
| 开始时 | a | b | 0 | 0 |
| 10 s时 | 3 | 0.5 | c | 1.5 |
(1)上述反应平衡常数K的表达式为
(2)既能提高反应速率,又能提高H2转化率的方法是
(3)若T K时,化学平衡常数K=15,则10s 时v(正)
(4)能说明上述可逆反应达到化学平衡的是
A. 混合气体的平均摩尔质量不再变化
B. 混合气体的密度不再变化
C. c(H2)/c(CH3OCH3)的比值不再变化
D. 容器内的压强不再变化

(5)一定条件下,向某恒容密闭容器中充入2 mol CO2和3 mol H2,发生的反应为 CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH=−50 kJ·mol−1。测得在相同时间内不同温度下H2的转化率如图所示,则在该时间段内恰好达到化学平衡时,容器内的压强与反应开始时的压强之比为
CH3OH(g)+H2O(g) ΔH=−50 kJ·mol−1。测得在相同时间内不同温度下H2的转化率如图所示,则在该时间段内恰好达到化学平衡时,容器内的压强与反应开始时的压强之比为
您最近一年使用:0次



