 2Z(g) ΔH1=-akJ·mol-1(a>0),在一个容积固定的容器中加入2molX2和lmolY2,在500℃时充分反应达平衡后Z的浓度为Wmol·L-1,放出热量bkJ。
2Z(g) ΔH1=-akJ·mol-1(a>0),在一个容积固定的容器中加入2molX2和lmolY2,在500℃时充分反应达平衡后Z的浓度为Wmol·L-1,放出热量bkJ。(1)此反应平衡常数表达式为
(2)能说明反应已达平衡状态的是
A.浓度c(Z)=2c(Y2) B.容器内压强保持不变
C.v逆(X2)=2v正(Y2) D.容器内的密度保持不变
(3)若将上述容器改为恒压容器
 反应器开始体积相同
反应器开始体积相同 ,相同温度下起始加入2molX2和lmolY2达到平衡后,Y2的转化率将
,相同温度下起始加入2molX2和lmolY2达到平衡后,Y2的转化率将相似题推荐
(1)已知2NO(g)+O2(g)⇌2NO2(g)的反应历程分两步:
第一步 2NO(g)⇌N2O2(g) (快速平衡)
第二步 N2O2(g)+O2(g)=2NO2(g) (慢反应)
用O2表示的速率方程为v(O2)=k1∙c2(NO)∙c(O2);NO2表示的速率方程为v(NO2)=k2∙c2(NO) ∙c(O2),k1与k2分别表示速率常数(与温度有关),则
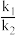 =
=(2)容积均为1L的甲、乙、丙三个容器,其中甲为绝热恒容,乙为恒温恒容,丙为恒温恒压。相同温度下,分别充入0.2mol的NO2,发生反应:2NO2(g)⇌N2O4(g) ΔH<0,甲中NO2的相关量随时间变化如图所示。
①0~3s内,甲容器中NO2的反应速率增大的原因是
②甲达平衡时,温度若为T℃,此温度下的平衡常数K=
③平衡时,平衡常数K甲、K乙、K丙的大小关系是
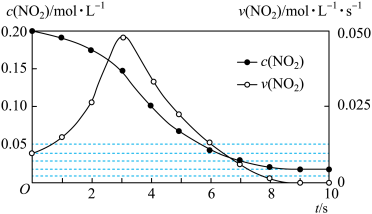
(3)以NH3为还原剂在脱硝装置中消除烟气中的氮氧化物。
主反应:4NH3(g)+4NO(g)+O2(g)=4N2(g)+6H2O(g) ΔH1=-1626.9kJ/mol
副反应:4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ΔH2=-1267.1kJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ΔH3=-907.3kJ/mol
将烟气按一定的流速通过脱硝装置,测得出口NO的浓度与温度的关系如图所示,试分析脱硝的适宜温度范围
 NH3(g)+HI(g) ΔH1=+akJ/mol Kp1;
NH3(g)+HI(g) ΔH1=+akJ/mol Kp1;②2HI(g)
 H2(g)+I2(g) ΔH2=+bkJ/mol Kp2。
H2(g)+I2(g) ΔH2=+bkJ/mol Kp2。在某温度下,向一固定体积密闭容器中,投入足量NH4I固体(忽略体积),达到化学平衡时,测得P(H2)=5Kpa、P(HI)=40Kpa,请填写以下空白:
(1)请写出NH4I(s)分解为H2(g)、I2(g)和NH3(g)的热化学反应方程式
(2)在相同温度下,在如图的装置中达到化学平衡。
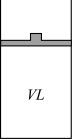
若缓慢将体积扩大至2V,反应②向
 ,体系颜色变化情况
,体系颜色变化情况【推荐3】氮有多种氧化物,它们在生产、科研中有丰富的应用。
(1)某条件下密闭容器中充入了2molN2O4气体,现测得NO2的浓度数据如下:
时间(min) | 1min | 2min | 3min | 4min | 5min |
NO2浓度(mol/L) | 0.8 | 1.4 | 1.8 | 2.0 | 2.0 |
则NO2在2-4min内的反应速率为
(2)碘蒸气存在能大幅度提高N2O的分解速率,反应历程为:
第一步I2(g) 2I(g)(快反应)
2I(g)(快反应)
第二步I(g)+N2O(g)→N2(g)+IO(g)(慢反应)
第三步IO(g)+N2O(g)→N2(g)+O2(g)+I(g(快反应)
实验表明,含碘时N2O分解速率方程v=k·c(N2O)·c0.5(I2)(k为速率常数)。下列表述正确的是
A.第一步反应对总反应速率起决定作用 B. 第二步活化能比第三步大
C.N2O分解反应中,k(含碘)>k(无碘) D.I2浓度与N2O分解速率无关
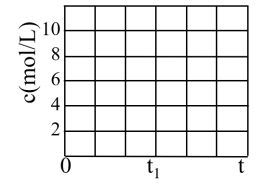
(3)已知N2O(g)+CO(g) CO2(g)+N2(g) △H=-124 kJ/mol,为研究汽车尾气转化为无毒无害物质的有关反应,在密闭容器中充入10 molCO和10 molN2O发生反应,如图所示为平衡时N2O的体积分数与温度、压强的关系。
CO2(g)+N2(g) △H=-124 kJ/mol,为研究汽车尾气转化为无毒无害物质的有关反应,在密闭容器中充入10 molCO和10 molN2O发生反应,如图所示为平衡时N2O的体积分数与温度、压强的关系。
①该反应达平衡后,为了在提高反应速率同时提高N2O的转化率,可采取的措施
a.改用高效催化剂 b.缩小容器的体积 c.升高温度 d.增加CO的浓度
②压强为20 MPa、温度为T2下,若反应进行到20 min达到平衡状态,请计算该温度下平衡常数K=
③若在D点对反应容器升温的同时缩小体积至体系压强增大,重新达到的平衡状态可能是图中A-G点中的
| t℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
(1)该反应的正反应为
(2)在某温度下,能判断该反应是否已经达到化学平衡状态的是:_______
| A.容器中压强不变 | B.混合气体中CO浓度不变 |
| C.v(H2)正 = v(H2O)逆 | D.c(CO2) = c(CO) |
| 时间/min | CO2 (mol/L) | H2 (mol/L) | CO (mol/L) | H2 O ( mol/L) |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
计算:3min—4min达到平衡时CO的平衡浓度c3是
(1)该反应的化学方程式可表示为
(2)反应起始至
 (设t=5),X的平均反应速率是
(设t=5),X的平均反应速率是(3)下列可判断反应已达到该状态的是_______(填字母,下同)
| A.X、Y,Z的反应速率相等 | B.X、Y的反应速率比为2:3 |
| C.混合气体的密度不变 | D.生成 的同时生成 的同时生成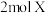 |
(5)一定能使该反应的反应速率增大的措施有
A.其他条件不变,及时分离出产物 B.适当降低温度 C.其他条件不变,增大X的浓度
I.结合下图回答问题
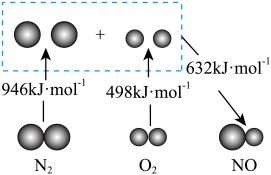
(1)图中三种分子最稳定的是
(2)若反应生成
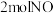 气体
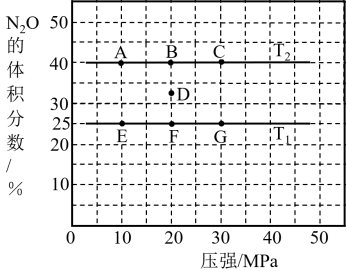
气体Ⅱ.某温度时,在一个
 的密闭容器中,A、B、C三种气体的浓度随时间的变化曲线如下图所示。根据图中数据,回答下列问题:
的密闭容器中,A、B、C三种气体的浓度随时间的变化曲线如下图所示。根据图中数据,回答下列问题:
(3)该反应的化学方程式为
(4)从开始至
 ,B的平均反应速率为
,B的平均反应速率为Ⅲ.已知:“零级反应”是指反应速率与反应物浓度无关的化学反应。某温度下,在
 恒容密闭容器中
恒容密闭容器中 发生反应
发生反应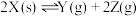 ,有关数据如下表:
,有关数据如下表:时间段 | 产物Z的平均生成速率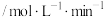 |
| 0~2 | 0.20 |
| 0~4 | 0.15 |
| 0~6 | 0.10 |
①
 时,Z的浓度可能等于
时,Z的浓度可能等于
②
 时,可逆反应可能建立平衡状态
时,可逆反应可能建立平衡状态③
 时,无论反应是否为零级反应,Y的体积分数一定约为
时,无论反应是否为零级反应,Y的体积分数一定约为
④
 时,无论反应是否为零级反应,可逆反应都不可能建立平衡状态
时,无论反应是否为零级反应,可逆反应都不可能建立平衡状态⑤
 时,X的物质的量为
时,X的物质的量为
⑥
 时,可逆反应可能刚刚建立平衡状态
时,可逆反应可能刚刚建立平衡状态
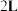 的密闭容器内充入
的密闭容器内充入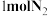 和
和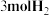 ,加入合适催化剂(体积可以忽略不计)后在一定温度压强下开始反应,并用压力计监测容器内压强的变化如下表:
,加入合适催化剂(体积可以忽略不计)后在一定温度压强下开始反应,并用压力计监测容器内压强的变化如下表:反应时间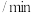 | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
压强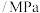 | 16.80 | 14.78 | 13.86 | 13.27 | 12.85 | 12.60 | 12.60 |
2.反应后的气体总物质的量是
3.则从反应开始到
 时,以
时,以 表示的平均反应速率
表示的平均反应速率
4.实验中,
 时向容器中充入一定量
时向容器中充入一定量 ,则正反应速率
,则正反应速率A.增大 B.减小 C.不变
5.实验中,
 时若容器体积减少一半,则平衡
时若容器体积减少一半,则平衡A.正向移动 B.逆向移动 C.不移动
6.改变条件能改变合成氨的反应速率,下列改变的条件中能降低反应物所需能量的是 。
| A.温度 | B.压强 | C.浓度 | D.催化剂 |
 合成甲醇:
合成甲醇: ,在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示。
,在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示。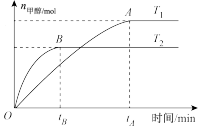
回答下列问题:
(1)从图中可知

 (填“>”“=”或“<”)。
(填“>”“=”或“<”)。(2)该反应的平衡常数表达式为

(3)该反应在
 时的平衡常数大小关系是
时的平衡常数大小关系是
 (填“>”“=”或“<”)。
(填“>”“=”或“<”)。(4)该反应的焓变

(5)处于A点的反应体系从
 变到
变到 ,达到平衡时
,达到平衡时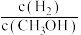 将
将(6)在其他条件不变的情况下,
 时该反应
时该反应 能否自发进行?
能否自发进行?(1)如图是
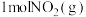 和
和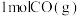 反应生成
反应生成 和
和 过程中的能量变化示意图,若在反应体系中加入催化剂,则
过程中的能量变化示意图,若在反应体系中加入催化剂,则
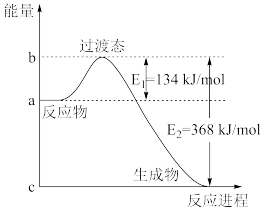
(2)捕碳技术(主要指捕获
 )在降低温室气体排放中具有重要的作用。目前
)在降低温室气体排放中具有重要的作用。目前 和
和 已经被用作工业捕碳剂,它们与
已经被用作工业捕碳剂,它们与 可发生如下可逆反应:
可发生如下可逆反应:①
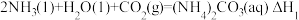
②
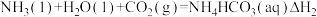
③
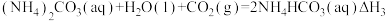
 和
和 、
、 之间的关系是
之间的关系是
如果上述三个反应的平衡常数依次为
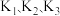 则
则
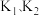 表示)。
表示)。(3)已知在
 时,次氯酸、碳酸的电离常数如下表:
时,次氯酸、碳酸的电离常数如下表:| 次氯酸 | 碳酸 |
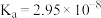 | 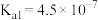 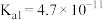 |
请写出少量二氧化碳气体通入次氯酸钠溶液中的离子方程式:
(4)氯化铝水溶液呈酸性,原因是(用离子方程式表示):
 溶液蒸干,灼烧,最后得到的主要固体产物是
溶液蒸干,灼烧,最后得到的主要固体产物是


