部分弱酸的电离平衡常数如下表:
下列说法正确的是( )
| 弱酸 | CH3COOH | HBrO(性质与HClO相仿) | H2S |
| 电离平衡常数(25℃) | Ka=1.75×10-5 | Ka=2.3×10-9 | Ka1=1.3×10-7 Ka2=7.1×10-13 |
| A.中和等体积、等pH的CH3COOH溶液和HBrO溶液消耗NaOH的量前者大于后者 |
| B.等体积、等浓度的CH3COONa和NaBrO溶液中所含离子总数前者等于后者 |
| C.物质的量浓度相等的CH3COONa、NaBrO和NaHS溶液的pH:NaBrO>NaHS>CH3COONa |
| D.Na2S溶液中:2c(Na+)=c(S2-)+c(HS-)+c(H2S) |
更新时间:2020-01-29 10:41:39
|
相似题推荐
单选题
|
适中
(0.65)
【推荐1】下列说法正确的是
| A.常温下,pH=11的Na2CO3溶液中:由水电离出的c(H+)水=10-llmol/L |
| B.向醋酸溶液中加水,醋酸的电离程度增大,c(CH3COOH)/c(H+)增大 |
| C.向氨水中滴加盐酸时,离子浓度大小可能是:c(NH4+)>cOH->c(C1-)>c(H+) |
| D.室温时,若NaHA溶液中的pH<7,则H2A是强酸 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】常温下,向一定浓度的H2X溶液中滴加NaOH溶液,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是


| A.H2X的电离常数Ka1的数量级为10-2 |
| B.水电离的(H+):N点<M点 |
| C.N点时,c(Na+)<3c(X2-) |
| D.当混合溶液呈中性时,c(Na+)>c(X²-)>c(HX-)>c(H+)=c(OH-) |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】下列有关电解质溶液的叙述正确的是( )
| A.常温下,稀释CH3COOH溶液时,CH3COOH的Ka增大,水的离子积Kw不变 |
| B.0.1mol⋅L-1 Na2SO3溶液,加水稀释,c(SO32−)与c(Na+)的比值减小 |
| C.0.01mol⋅L-1 NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) |
| D.常温下,pH=12的氢氧化钠溶液与pH=2的醋酸溶液等体积混合,溶液呈碱性 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】25℃时,在20 mL 0.1 mol·L-1 CH3COOH溶液中逐滴加入0.1 mol·L-1 NaOH溶液,pH变化曲线如下图所示:
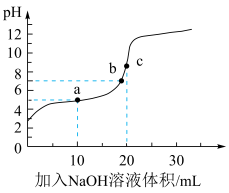
下列说法不正确 的是

下列说法
| A.若用10 mL H2O代替10 mL NaOH溶液,所得溶液pH小于a点 |
| B.b点溶液中微粒浓度:c(Na+) > c(CH3COO-) > c(CH3COOH) |
| C.a点→c点的过程中n(CH3COO-)持续增大 |
| D.若向a点对应的溶液中滴加1滴0.1 mol·L-1 NaOH溶液或1滴0.1 mol·L-1醋酸溶液,pH变化均不大 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐3】下列离子方程式正确的是
| A.氧化铁溶于氢碘酸溶液的反应:Fe2O3+6H+=2Fe3++3H2O |
B.已知电离平衡常数:H2CO3>HClO>HCO ,向NaClO溶液中通入少量CO2:2ClO-+CO2+H2O=2HClO+CO ,向NaClO溶液中通入少量CO2:2ClO-+CO2+H2O=2HClO+CO |
C.硫酸亚铁铵(NH4)2FeSO4溶液与足量Ba(OH)2溶液反应:Fe2++2Ba2++2OH-+2SO =Fe(OH)2↓+2BaSO4↓ =Fe(OH)2↓+2BaSO4↓ |
D.碳酸氢钠溶液与少量澄清石灰水反应:Ca2++2OH-+2HCO =CaCO3↓+2H2O+CO =CaCO3↓+2H2O+CO |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐1】常温下,用0.1 mol/L的HCl滴定10 mL浓度均为0.1 mol/L的NaHCO3和Na2CO3的混合液,下列说法不正确的是
A.在盐酸滴定前,NaHCO3和Na2CO3的混合液中c( )<c( )<c(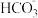 ) ) |
B.当滴入盐酸10 mL时,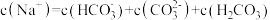 |
C.若用酚酞作指示剂,滴定终点时溶液呈碱性,且 |
| D.若用甲基橙作指示剂,滴定终点时,溶质为NaCl和溶解在溶液中的H2CO3、CO2 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】25℃,a mol·L−1 HCl与b mol·L−1 一元碱MOH等体积混合后,pH为7,则下列关系一定正确的是
| A.a≤b | B.a≥b |
| C.c (Cl−)>c(M+) | D.c (Cl−)< c(M+) |
您最近一年使用:0次

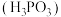 溶液中含磷物种浓度之和为
溶液中含磷物种浓度之和为 ,溶液中所有含磷微粒的
,溶液中所有含磷微粒的 的关系如图所示。已知:
的关系如图所示。已知: 表示
表示 浓度的负对数
浓度的负对数 两点的坐标分别为:
两点的坐标分别为: 。下列说法正确的是
。下列说法正确的是
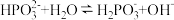 的平衡常数为
的平衡常数为
 点溶液中,
点溶液中,
 点溶液中:
点溶液中:
 的两步水解常数分别为
的两步水解常数分别为 ,则
,则 点的
点的


