1 . 某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂。请填写下列空白:
(1)某学生的操作步骤如下:
A.移取20.00mL待测溶液注入洁净的锥形瓶中,并加入2~3滴酚酞试液。
B.用标准溶液润洗滴定管2~3次。
C.调节滴定管旋塞使尖嘴充满溶液,把盛有标准溶液的酸式滴定管固定好。
D.取标准盐酸溶液注入酸式滴定管至零刻度以上2~3cm。
E.调节液面至零刻度(或以下),记下读数V1。
F.用标准溶液滴定至终点,记下滴定管液面的刻度V2。
请写出操作步骤的正确顺序___________ 。
→___________→___________→___________→A→F。
(2)滴定终点的判断方法:___________ 。
(3)滴定结束时,酸式滴定管中的液面如图所示,则读数为___________ mL。
(5)某学生根据三次实验分别记录有关数据如表:
请选用其中合理数据求出该氢氧化钠溶液物质的量浓度:c(NaOH)=___________ mol/L。(计算结果保留4位有效数字)
(6)由于错误操作,使得上述所测氢氧化钠溶液的浓度偏高的是___________(填字母)。
(1)某学生的操作步骤如下:
A.移取20.00mL待测溶液注入洁净的锥形瓶中,并加入2~3滴酚酞试液。
B.用标准溶液润洗滴定管2~3次。
C.调节滴定管旋塞使尖嘴充满溶液,把盛有标准溶液的酸式滴定管固定好。
D.取标准盐酸溶液注入酸式滴定管至零刻度以上2~3cm。
E.调节液面至零刻度(或以下),记下读数V1。
F.用标准溶液滴定至终点,记下滴定管液面的刻度V2。
请写出操作步骤的正确顺序
→___________→___________→___________→A→F。
(2)滴定终点的判断方法:
(3)滴定结束时,酸式滴定管中的液面如图所示,则读数为

A. | B.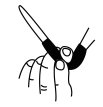 | C. | D. |
(5)某学生根据三次实验分别记录有关数据如表:
| 滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol•L-1盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积 | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
(6)由于错误操作,使得上述所测氢氧化钠溶液的浓度偏高的是___________(填字母)。
| A.中和滴定到达终点时俯视滴定管内液面读数 |
| B.碱式滴定管用蒸馏水洗净后立即取用25.00mL待测碱溶液注入锥形瓶进行滴定 |
| C.酸式滴定管用蒸馏水洗净后立即装标准溶液来滴定 |
| D.锥形瓶用待测液润洗 |
您最近一年使用:0次
解题方法
2 . 用下图装置进行实验,不能达到目的的是
|
|
| A.用盐酸滴定未知浓度的稀氨水 | B.制取NH4HCO3溶液 |
|
|
| C.实验室测定中和热 | D.用pH计测新制氯水的pH |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
3 . 下列玻璃仪器在相应实验中选用不合理的是

A.重结晶法提纯乙酰苯胺(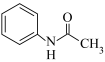 ):⑥⑦⑧ ):⑥⑦⑧ |
B.蒸馏法分离苯(沸点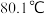 )和甲苯(沸点 )和甲苯(沸点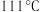 ):①③⑤⑨ ):①③⑤⑨ |
C.用 标准溶液作滴定试剂,酸碱滴定法测定草酸 标准溶液作滴定试剂,酸碱滴定法测定草酸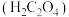 溶液浓度:③④ 溶液浓度:③④ |
D.用 作萃取剂,萃取法提取碘水中的碘:②⑥ 作萃取剂,萃取法提取碘水中的碘:②⑥ |
您最近一年使用:0次
名校
解题方法
4 . 对下列图示实验的描述正确的是
|
|
| A.所示的实验:制取FeCO3 | B.所示的实验:用NaOH溶液滴定盐酸 |
|
|
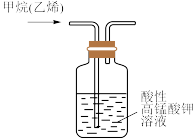
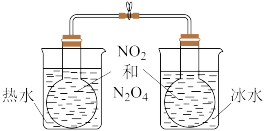
| C.用装置除去甲烷中的乙烯,以得到纯净的甲烷 | D.所示的实验:根据两烧瓶中气体颜色的变化(热水中变深、冰水中变浅)可以判断 的正反应是吸热反应 的正反应是吸热反应 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
5 . 某小组使用用标准0.1000mol/L的NaOH溶液滴定未知浓度的盐酸,选用甲基橙作为指示剂,
滴定时实验数据如下表所示
_______ ml。
(2)标准液达到滴定终点时的现象为_______ 。
(3)用标准的NaOH溶液滴定未知浓度的盐酸,选用酚酞作为指示剂,造成测定结果偏高的原因可能是_______。
(4)计算这种待测稀盐酸的物质的量浓度c(HCl)=_______ mol/L。(写出计算过程)
滴定时实验数据如下表所示
| 实验次数编号 | 待测盐酸体积 | 滴入NaOH体积 |
| 1 | 20.00 mL | 21.90 mL |
| 2 | 20.00 mL | 21.70 mL |
| 3 | 20.00 mL | 见图 |

(2)标准液达到滴定终点时的现象为
(3)用标准的NaOH溶液滴定未知浓度的盐酸,选用酚酞作为指示剂,造成测定结果偏高的原因可能是_______。
| A.滴定终点读数时,俯视滴定管的刻度,其他操作正确 |
| B.盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗 |
| C.滴定到终点读数时,滴定管尖嘴处有气泡 |
| D.配制标准溶液的NaOH固体中混有Na2CO3杂质 |
您最近一年使用:0次
解题方法
6 . 碳酸钠俗称纯碱,是一种重要的化工原料。工业制备的碳酸钠产品中通常含有少量碳酸氢钠,某兴趣小组测定碳酸钠中碳酸氢钠含量的实验步骤如下:
步骤一:称取产品2.500g,用蒸馏水溶解,定容于250mL容量瓶中;
步骤二:移取25.00mL上述溶液于锥形瓶,加入2滴指示剂M,用 盐酸标准溶液滴定至终点(第一滴定终点),消耗盐酸
盐酸标准溶液滴定至终点(第一滴定终点),消耗盐酸 ;
;
步骤三:在上述锥形瓶中再加入2滴指示剂N,继续用 盐酸标准溶液滴定至终点(第二滴定终点),又消耗盐酸
盐酸标准溶液滴定至终点(第二滴定终点),又消耗盐酸 ;
;
平行测定三次, 平均值为22.45,
平均值为22.45, 平均值为23.51。
平均值为23.51。
下列有关实验数据及误差分析错误的是
步骤一:称取产品2.500g,用蒸馏水溶解,定容于250mL容量瓶中;
步骤二:移取25.00mL上述溶液于锥形瓶,加入2滴指示剂M,用
 盐酸标准溶液滴定至终点(第一滴定终点),消耗盐酸
盐酸标准溶液滴定至终点(第一滴定终点),消耗盐酸 ;
;步骤三:在上述锥形瓶中再加入2滴指示剂N,继续用
 盐酸标准溶液滴定至终点(第二滴定终点),又消耗盐酸
盐酸标准溶液滴定至终点(第二滴定终点),又消耗盐酸 ;
;平行测定三次,
 平均值为22.45,
平均值为22.45, 平均值为23.51。
平均值为23.51。下列有关实验数据及误差分析错误的是
| A.该产品中碳酸氢钠的含量约为3.56% |
| B.第一次滴定终点时俯视读数,测得实验数据偏小 |
| C.第二次滴定终点结束后,迅速读数,测得实验数据偏大 |
| D.滴定前滴定管尖嘴处有气泡,第一次滴定结束后气泡消失,测得实验数据偏小 |
您最近一年使用:0次
解题方法
7 . 丙酸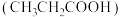 可用作食品防腐剂和防霉剂,能与水、乙醇等混溶。某同学为测定其电离常数做了如下实验:
可用作食品防腐剂和防霉剂,能与水、乙醇等混溶。某同学为测定其电离常数做了如下实验:
【实验一】配制丙酸溶液并用 溶液滴定测定丙酸的浓度。
溶液滴定测定丙酸的浓度。 丙酸溶液,用移液管移取
丙酸溶液,用移液管移取 丙酸溶液于锥形瓶中,加入几
丙酸溶液于锥形瓶中,加入几____________ 滴溶液作指示剂。
(2)取图中的滴定管____________ (填“a”或“b”),检查____________ 后,用蒸馏水洗涤,再用 的
的 标准溶液
标准溶液____________  次,完成后盛装好标准溶液,然后进行滴定,达到滴定终点时的操作和现象为
次,完成后盛装好标准溶液,然后进行滴定,达到滴定终点时的操作和现象为____________ 。
(3)重复滴定操作3次,每次消耗标准溶液的体积如下:
根据表中数据计算,所配丙酸溶液的物质的量浓度为____________  ;若读取滴定终点的数据时仰视读数,则造成所测丙酸溶液的浓度将
;若读取滴定终点的数据时仰视读数,则造成所测丙酸溶液的浓度将____________ (填“偏大”“偏小”或“无影响”)。
【实验二】常温下测定所配丙酸溶液的 。
。
(4)若用 试纸测定丙酸溶液的
试纸测定丙酸溶液的 ,写出简要操作:
,写出简要操作:____________ 。
(5)若用 计测得所配丙酸溶液的
计测得所配丙酸溶液的 为2.94,则常温下,丙酸的电离常数
为2.94,则常温下,丙酸的电离常数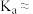
____________ 。
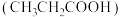 可用作食品防腐剂和防霉剂,能与水、乙醇等混溶。某同学为测定其电离常数做了如下实验:
可用作食品防腐剂和防霉剂,能与水、乙醇等混溶。某同学为测定其电离常数做了如下实验:【实验一】配制丙酸溶液并用
 溶液滴定测定丙酸的浓度。
溶液滴定测定丙酸的浓度。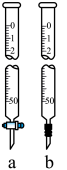
 丙酸溶液,用移液管移取
丙酸溶液,用移液管移取 丙酸溶液于锥形瓶中,加入几
丙酸溶液于锥形瓶中,加入几(2)取图中的滴定管
 的
的 标准溶液
标准溶液 次,完成后盛装好标准溶液,然后进行滴定,达到滴定终点时的操作和现象为
次,完成后盛装好标准溶液,然后进行滴定,达到滴定终点时的操作和现象为(3)重复滴定操作3次,每次消耗标准溶液的体积如下:
实验序号 | 1 | 2 | 3 |
消耗NaOH标准溶液的体积/mL | 24.98 | 25.00 | 25.02 |
 ;若读取滴定终点的数据时仰视读数,则造成所测丙酸溶液的浓度将
;若读取滴定终点的数据时仰视读数,则造成所测丙酸溶液的浓度将【实验二】常温下测定所配丙酸溶液的
 。
。(4)若用
 试纸测定丙酸溶液的
试纸测定丙酸溶液的 ,写出简要操作:
,写出简要操作:(5)若用
 计测得所配丙酸溶液的
计测得所配丙酸溶液的 为2.94,则常温下,丙酸的电离常数
为2.94,则常温下,丙酸的电离常数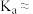
您最近一年使用:0次
8 . 有机物在生产生活中应用广泛,某实验小组以“有机物结构的测定方法”和“配合物结构的测定方法”为研究课题设计了如下实验。
I.有机物结构的确定方法
①取6.8g该有机物A试样通过上述装置完全反应,装置甲增重3.6g,装置乙增重17.6g。
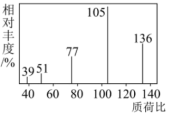
②用质谱仪测定有机物A的相对分子质量,得到如图所示的质谱图。
③用核磁共振仪处理该化合物,所得核磁共振氢谱图中4组峰的面积之比是1:2:2:3。
(1)若没有装置丙,可能带来的影响是___________ 。
(2)由上述已知条件可推出有机物A的分子式为___________ 。
(3)已知有机物A属于芳香族化合物,与乙酸的官能团种类相同,请写出其结构简式:___________ 。
Ⅱ.配合物结构的测定方法
已知:①Co的此类配合物离子较稳定,但加碱再煮沸可促进其内界解离,如: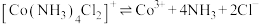 。
。
②下述实验所得样品中的Co元素为+3价,Co3+的配位数为6。
某兴趣小组用Cl-取代 离子中NH3制得配合物
离子中NH3制得配合物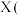 化学式为
化学式为 。该实验小组用以下方法测定所得配合物的组成。
。该实验小组用以下方法测定所得配合物的组成。
实验步骤:取mgX样品加入过量浓NaOH溶液,煮沸,将生成的NH3通入20mL0.20mol/L的稀硫酸(过量)中,再用0.1000mol/LNaOH标准溶液滴定剩余H2SO4溶液。
(4)该配合物中,配体NH3分子中的配位原子为___________ 原子(填原子符号)。
(5)若滴定过程平均消耗NaOH标准溶液20.00mL,则样品中含有NH3的物质的量为___________ mol。
(6)为了减小实验误差,上述中和滴定实验应选择___________ (填“甲基橙”或“酚酞”)做指示剂。
(7)另取mgX样品,加入过量HNO3酸化后,用AgNO3溶液滴定测得n(Cl-)=0.0036mol。请用配合物的形式表示该样品的组成:___________ 。
I.有机物结构的确定方法
①取6.8g该有机物A试样通过上述装置完全反应,装置甲增重3.6g,装置乙增重17.6g。
②用质谱仪测定有机物A的相对分子质量,得到如图所示的质谱图。
③用核磁共振仪处理该化合物,所得核磁共振氢谱图中4组峰的面积之比是1:2:2:3。
(1)若没有装置丙,可能带来的影响是
(2)由上述已知条件可推出有机物A的分子式为
(3)已知有机物A属于芳香族化合物,与乙酸的官能团种类相同,请写出其结构简式:
Ⅱ.配合物结构的测定方法
已知:①Co的此类配合物离子较稳定,但加碱再煮沸可促进其内界解离,如:
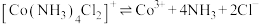 。
。②下述实验所得样品中的Co元素为+3价,Co3+的配位数为6。
某兴趣小组用Cl-取代
 离子中NH3制得配合物
离子中NH3制得配合物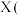 化学式为
化学式为 。该实验小组用以下方法测定所得配合物的组成。
。该实验小组用以下方法测定所得配合物的组成。实验步骤:取mgX样品加入过量浓NaOH溶液,煮沸,将生成的NH3通入20mL0.20mol/L的稀硫酸(过量)中,再用0.1000mol/LNaOH标准溶液滴定剩余H2SO4溶液。
(4)该配合物中,配体NH3分子中的配位原子为
(5)若滴定过程平均消耗NaOH标准溶液20.00mL,则样品中含有NH3的物质的量为
(6)为了减小实验误差,上述中和滴定实验应选择
(7)另取mgX样品,加入过量HNO3酸化后,用AgNO3溶液滴定测得n(Cl-)=0.0036mol。请用配合物的形式表示该样品的组成:
您最近一年使用:0次
2024-05-04更新
|
306次组卷
|
3卷引用:江西省南昌市第二中学2023-2024学年高二下学期月考化学试卷
9 . 使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL)。
实验步骤:
(1)配制100mL待测白醋溶液。量取10.00mL市售白醋,注入烧杯中用水稀释后转移到___________ (填仪器规格及名称)中定容,摇匀即得。
(2)用___________ 量取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴酚酞作指示剂。
(3)读取盛装0.1000mol·L⁻¹NaOH溶液的___________ (填仪器名称)的初始读数。如果液面位置如图所示,则此时的读数为___________ mL。___________ 。滴定终点后记录NaOH溶液的终点读数。再重复滴定3次。
(5)在本实验的滴定过程中,下列操作会使实验结果偏大的是___________(填写序号)。
实验步骤:
(1)配制100mL待测白醋溶液。量取10.00mL市售白醋,注入烧杯中用水稀释后转移到
(2)用
(3)读取盛装0.1000mol·L⁻¹NaOH溶液的

(5)在本实验的滴定过程中,下列操作会使实验结果偏大的是___________(填写序号)。
| A.未用标准NaOH溶液润洗滴定管 |
| B.锥形瓶中加入待测白醋溶液后,再加少量水 |
| C.锥形瓶在滴定时剧烈摇动,有少量液体溅出 |
| D.滴定前有气泡,滴定后气泡消失 |
您最近一年使用:0次
解题方法
10 . 现使用酸碱中和滴定法测定某盐酸的浓度。
Ⅰ.实验步骤
(1)如图,用图中______ (填“甲”或“乙”)量取待测盐酸溶液20.00 mL于锥形瓶中,向其中滴加2滴______ 作指示剂。 NaOH溶液的碱式滴定管的初始读数。如果液面位置如图所示,则此时的读数为:
NaOH溶液的碱式滴定管的初始读数。如果液面位置如图所示,则此时的读数为:______ mL。______ 。当______ 时,停止滴定,并记录NaOH溶液的最终读数。重复滴定3次。
Ⅱ.实验记录
Ⅲ.数据处理与讨论
(4)根据图表数据平均消耗的NaOH溶液的体积
______ mL,数据处理,可得
______  。
。
(5)在本实验的滴定过程中,下列操作会使实验结果偏高的是______(填字母)。
Ⅰ.实验步骤
(1)如图,用图中

 NaOH溶液的碱式滴定管的初始读数。如果液面位置如图所示,则此时的读数为:
NaOH溶液的碱式滴定管的初始读数。如果液面位置如图所示,则此时的读数为:
Ⅱ.实验记录
滴定次数 | 1 | 2 | 3 | 4 |
V(样品)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)/mL | 15.95 | 15.00 | 15.05 | 14.95 |
(4)根据图表数据平均消耗的NaOH溶液的体积


 。
。(5)在本实验的滴定过程中,下列操作会使实验结果偏高的是______(填字母)。
| A.碱式滴定管在滴定时未用NaOH标准溶液润洗 |
| B.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失 |
| C.锥形瓶中加入待测盐酸溶液后,再加少量水 |
| D.锥形瓶在滴定时剧烈摇动,有少量液体溅出 |
您最近一年使用:0次