1 . 某学生用标准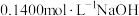 溶液滴定未知浓度硫酸的实验操作如下(正确的操作顺序自行判断):
溶液滴定未知浓度硫酸的实验操作如下(正确的操作顺序自行判断):
A.用酸式滴定管取稀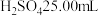 ,注入锥形瓶中,加入酚酞
,注入锥形瓶中,加入酚酞
B.用待测定的溶液润洗酸式滴定管
C.用蒸馏水洗干净滴定管
D.取下碱式滴定管用标准的 溶液润洗后,将标准液注入碱式滴定管刻度“0”以上
溶液润洗后,将标准液注入碱式滴定管刻度“0”以上 处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下
处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下
E.检查滴定管是否漏水
F.另取锥形瓶,再重复操作一次
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度,用去 溶液
溶液
(1)在G操作中如何确定终点___________ 。
(2)碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果___________ (填“偏小”、“偏大”或“恰好合适”)。
(3)配制 标准溶液,除了烧杯、玻璃棒,必须使用到的玻璃仪器是
标准溶液,除了烧杯、玻璃棒,必须使用到的玻璃仪器是___________ 。
(4)观察碱式滴定管读数时,若滴定前仰视,滴定后俯视,会导致测得的稀 溶液浓度测定值
溶液浓度测定值___________ (选填“偏大”“偏小”或“无影响”)。
(5)计算待测硫酸溶液的物质的量浓度___________ 。
(6)利用 燃料电池电解制备
燃料电池电解制备 并得到副产物
并得到副产物 、
、 、
、 ,装置如图所示
,装置如图所示
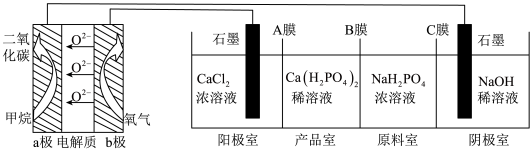
①a极的电极方程式:___________ 。
②A膜为___________ 、B膜为___________ (阳离子交换膜或阴离子交换膜)。
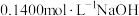 溶液滴定未知浓度硫酸的实验操作如下(正确的操作顺序自行判断):
溶液滴定未知浓度硫酸的实验操作如下(正确的操作顺序自行判断):A.用酸式滴定管取稀
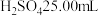 ,注入锥形瓶中,加入酚酞
,注入锥形瓶中,加入酚酞B.用待测定的溶液润洗酸式滴定管
C.用蒸馏水洗干净滴定管
D.取下碱式滴定管用标准的
 溶液润洗后,将标准液注入碱式滴定管刻度“0”以上
溶液润洗后,将标准液注入碱式滴定管刻度“0”以上 处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下
处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下E.检查滴定管是否漏水
F.另取锥形瓶,再重复操作一次
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度,用去
 溶液
溶液
(1)在G操作中如何确定终点
(2)碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果
(3)配制
 标准溶液,除了烧杯、玻璃棒,必须使用到的玻璃仪器是
标准溶液,除了烧杯、玻璃棒,必须使用到的玻璃仪器是(4)观察碱式滴定管读数时,若滴定前仰视,滴定后俯视,会导致测得的稀
 溶液浓度测定值
溶液浓度测定值(5)计算待测硫酸溶液的物质的量浓度
(6)利用
 燃料电池电解制备
燃料电池电解制备 并得到副产物
并得到副产物 、
、 、
、 ,装置如图所示
,装置如图所示
①a极的电极方程式:
②A膜为
您最近一年使用:0次
解题方法
2 . 电离是电解质在水溶液中的主要行为之一。回答下列问题:
(1)室温下,现有a.盐酸,b.硫酸,c.醋酸三种酸。
①这三种酸溶液中存在两种电离平衡的是_____ (填名称);当这三种酸体积相同,物质的量浓度相同时,使其恰好完全反应所需NaOH的物质的量由大到小的顺序是_____ (用a、b、c表示,下同)。
②当这三种酸中的 均为
均为 且体积相同时,分别放入足量的锌,相同状况下产生
且体积相同时,分别放入足量的锌,相同状况下产生 的体积由大到小的顺序是
的体积由大到小的顺序是_____ 。
(2)现用中和滴定法测定某NaOH溶液的浓度,有关数据记录如表:
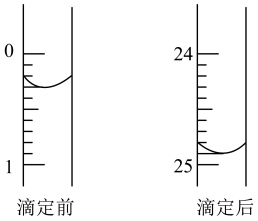
①用_____ 式滴定管盛装 盐酸标准液。如图表示第3次滴定前后50mL滴定管中液面的位置。该次滴定所用标准盐酸体积为
盐酸标准液。如图表示第3次滴定前后50mL滴定管中液面的位置。该次滴定所用标准盐酸体积为_____ mL。
②实验室中有石蕊和酚酞两种指示剂,该实验应选用_____ 作指示剂。
③根据实验1、2所给数据计算,该NaOH试样的物质的量浓度为_____ 。
④若操作过程中滴加盐酸速度过快,未充分振荡,刚看到溶液变色,就立刻停止滴定,则会造成测定结果_____ (填“偏低”“偏高”或“无影响”)。
(1)室温下,现有a.盐酸,b.硫酸,c.醋酸三种酸。
①这三种酸溶液中存在两种电离平衡的是
②当这三种酸中的
 均为
均为 且体积相同时,分别放入足量的锌,相同状况下产生
且体积相同时,分别放入足量的锌,相同状况下产生 的体积由大到小的顺序是
的体积由大到小的顺序是(2)现用中和滴定法测定某NaOH溶液的浓度,有关数据记录如表:
| 实验序号 | 待测液体积/mL | 所消耗盐酸标准液的体积/mL | ||
| 滴定前读数 | 滴定后读数 | 消耗的体积 | ||
| 1 | 20.00 | 0.50 | 26.80 | 26.30 |
| 2 | 20.00 | 5.00 | 31.34 | 26.34 |
| 3 | 20.00 | - | - | - |
 盐酸标准液。如图表示第3次滴定前后50mL滴定管中液面的位置。该次滴定所用标准盐酸体积为
盐酸标准液。如图表示第3次滴定前后50mL滴定管中液面的位置。该次滴定所用标准盐酸体积为
②实验室中有石蕊和酚酞两种指示剂,该实验应选用
③根据实验1、2所给数据计算,该NaOH试样的物质的量浓度为
④若操作过程中滴加盐酸速度过快,未充分振荡,刚看到溶液变色,就立刻停止滴定,则会造成测定结果
您最近一年使用:0次
2024-03-14更新
|
12次组卷
|
2卷引用:湖北省鄂州市部分高中教科研协作体2023-2024学年高二上学期11月期中考试化学试题
名校
解题方法
3 . 用0.1000mol•L-1的盐酸滴定某未知浓度的NaOH溶液,下列说法正确的是
| A.可用甲基橙做指示剂 |
| B.酸式滴定管用盐酸润洗后,润洗液全部从上口倒出 |
| C.滴定开始到终点,滴定管的尖嘴不能碰触锥形瓶内壁 |
| D.滴定前未驱赶滴定管尖嘴部分气泡,滴定后气泡消失,则所测浓度偏低 |
您最近一年使用:0次
2024-03-13更新
|
39次组卷
|
2卷引用:湖南省岳阳市岳阳县第一中学2023-2024学年高二下学期开学化学试题
4 . 糠酸和糠醇均为重要的化工中间体,工业上可利用糠醛发生歧化反应制取这两种物质(该反应为强放热反应),反应原理如下:
2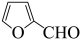 +OH-
+OH-
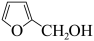 +
+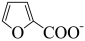 ΔH<0
ΔH<0
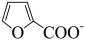 +H+
+H+
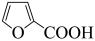
已知:①糠酸在热水中溶解度较大,微溶于冷水
②相关物质的熔点、沸点
实验步骤:
Ⅰ.向三颈烧瓶中加入8.2 mL密度为1.16 g/cm3新蒸馏的糠醛,通过仪器B向三颈烧瓶中缓慢滴加8 mL36%的NaOH溶液。
Ⅱ.通冷凝水,开启搅拌器,打开B的活塞,缓慢滴入8 mLNaOH溶液,保持反应温度8-12℃,回流20 min,得到粗产品。
Ⅲ.将粗产品倒入盛有10 mL水的烧杯中,然后将液体转移至分液漏斗中,用乙醚萃取3次,分液得到水层和醚层。
Ⅳ.向醚层中加入无水碳酸钾干燥,过滤除掉碳酸钾后,分离乙醚和糠醇。
Ⅴ.向水层中分批滴加25%的盐酸,调至溶液的pH=3,冷却、结晶、抽滤、冷水洗涤、干燥,得到糠酸粗品。
回答下列问题:
(1)仪器A的名称为___________ 。b管的作用是___________ 。
(2)该反应必须严格控制反应温度为8-12℃,实验中采用了哪些保障措施?___________ 、___________ 。
(3)步骤Ⅳ中分离乙醚和糠醇的实验操作为___________ 。
(4)步骤Ⅴ中洗涤粗糠酸用冷水的原因是___________ 。
(5)测定糠酸样品的纯度。准确称取1.120 g样品,配制成250 mL溶液,用移液管移取25.00 mL溶液于锥形瓶中,加入几滴酚酞作指示剂,用0.0800 mol/LNaOH标准溶液滴定,平行测定3次,平均消耗标准溶液12.40 mL。
①滴定管需要用标准溶液润洗,润洗滴定管的具体操作为___________ 。
②产品的质量分数为___________ (保留4位有效数字)。
③该中和滴定实验中,若其他实验操作均正确,则下列实验操作造成测得的糠酸的纯度比实际偏高的是___________ (填标号)。
A.蒸馏水洗净后,未用NaOH标准溶液润洗碱式滴定管
B.锥形瓶内壁用蒸馏水洗净后,又用配制好的糠酸样品溶液润洗
C.在达到滴定终点时碱式滴定管出现了气泡
2
 +OH-
+OH-
 +
+ ΔH<0
ΔH<0 +H+
+H+

已知:①糠酸在热水中溶解度较大,微溶于冷水
②相关物质的熔点、沸点
| 糠酸 | 糠醛 | 糠醇 | 乙醚 | |
| 熔点(℃) | 133 | -38.7 | -29 | -116.2 |
| 沸点(℃) | 231 | 161.7 | 171 | -34.6 |
Ⅰ.向三颈烧瓶中加入8.2 mL密度为1.16 g/cm3新蒸馏的糠醛,通过仪器B向三颈烧瓶中缓慢滴加8 mL36%的NaOH溶液。
Ⅱ.通冷凝水,开启搅拌器,打开B的活塞,缓慢滴入8 mLNaOH溶液,保持反应温度8-12℃,回流20 min,得到粗产品。
Ⅲ.将粗产品倒入盛有10 mL水的烧杯中,然后将液体转移至分液漏斗中,用乙醚萃取3次,分液得到水层和醚层。
Ⅳ.向醚层中加入无水碳酸钾干燥,过滤除掉碳酸钾后,分离乙醚和糠醇。
Ⅴ.向水层中分批滴加25%的盐酸,调至溶液的pH=3,冷却、结晶、抽滤、冷水洗涤、干燥,得到糠酸粗品。

回答下列问题:
(1)仪器A的名称为
(2)该反应必须严格控制反应温度为8-12℃,实验中采用了哪些保障措施?
(3)步骤Ⅳ中分离乙醚和糠醇的实验操作为
(4)步骤Ⅴ中洗涤粗糠酸用冷水的原因是
(5)测定糠酸样品的纯度。准确称取1.120 g样品,配制成250 mL溶液,用移液管移取25.00 mL溶液于锥形瓶中,加入几滴酚酞作指示剂,用0.0800 mol/LNaOH标准溶液滴定,平行测定3次,平均消耗标准溶液12.40 mL。
①滴定管需要用标准溶液润洗,润洗滴定管的具体操作为
②产品的质量分数为
③该中和滴定实验中,若其他实验操作均正确,则下列实验操作造成测得的糠酸的纯度比实际偏高的是
A.蒸馏水洗净后,未用NaOH标准溶液润洗碱式滴定管
B.锥形瓶内壁用蒸馏水洗净后,又用配制好的糠酸样品溶液润洗
C.在达到滴定终点时碱式滴定管出现了气泡
您最近一年使用:0次
5 . 下列实验操作(如图)正确且能达到实验目的的是


A.图甲模拟侯氏制碱法获得 |
| B.图乙用NaOH溶液滴定未知浓度的醋酸溶液 |
| C.图丙装置用于干燥高锰酸钾 |
D.图丁用于除去 中的 中的 |
您最近一年使用:0次
解题方法
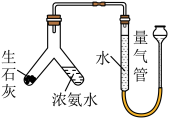
6 . 硫酸四氨合铜晶体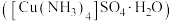 常用作杀虫剂、媒染剂。该物质为深蓝色固体,受热易失氨,常温下在空气中易与水和
常用作杀虫剂、媒染剂。该物质为深蓝色固体,受热易失氨,常温下在空气中易与水和 反应生成铜的碱式盐,变成绿色粉末。某学习小组在实验室中用如图的装置制备硫酸四氨合铜晶体并测定其纯度,请回答下列问题:
反应生成铜的碱式盐,变成绿色粉末。某学习小组在实验室中用如图的装置制备硫酸四氨合铜晶体并测定其纯度,请回答下列问题:
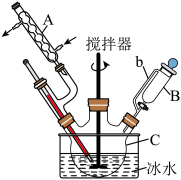
一、硫酸四氨合铜的制备
(1)仪器 的名称是
的名称是_____________ ;球泡 的作用是
的作用是_____________ ; 中的
中的 液体可以为
液体可以为_________ (填化学式)。
(2)装置 中得到深蓝色溶液的总反应的离子方程式为
中得到深蓝色溶液的总反应的离子方程式为______________________ 。
(3)反应后取下仪器甲,向其中缓缓加入 乙醇、抽滤、洗涤得到
乙醇、抽滤、洗涤得到 晶体,采用抽滤的原因是
晶体,采用抽滤的原因是______________________ 。
二、测定制备样品中氨的含量
步骤:按如图所示装置进行实验(药品及用量已标出;加热、夹持等装置已略去;硼酸极弱,仅作吸收剂,不影响盐酸标定氨的实验结果),维持沸腾一小时,取下锥形瓶,加入指示剂进行滴定操作,到达滴定终点时,消耗 的盐酸溶液
的盐酸溶液 。
。
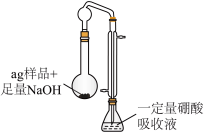
(4)指示剂为_____________ 。
(5)该晶体的纯度为_____________________  。
。
(6)下列实验操作可能使氨含量测定结果偏低的原因是 。
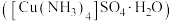 常用作杀虫剂、媒染剂。该物质为深蓝色固体,受热易失氨,常温下在空气中易与水和
常用作杀虫剂、媒染剂。该物质为深蓝色固体,受热易失氨,常温下在空气中易与水和 反应生成铜的碱式盐,变成绿色粉末。某学习小组在实验室中用如图的装置制备硫酸四氨合铜晶体并测定其纯度,请回答下列问题:
反应生成铜的碱式盐,变成绿色粉末。某学习小组在实验室中用如图的装置制备硫酸四氨合铜晶体并测定其纯度,请回答下列问题:一、硫酸四氨合铜的制备

(1)仪器
 的名称是
的名称是 的作用是
的作用是 中的
中的 液体可以为
液体可以为(2)装置
 中得到深蓝色溶液的总反应的离子方程式为
中得到深蓝色溶液的总反应的离子方程式为(3)反应后取下仪器甲,向其中缓缓加入
 乙醇、抽滤、洗涤得到
乙醇、抽滤、洗涤得到 晶体,采用抽滤的原因是
晶体,采用抽滤的原因是二、测定制备样品中氨的含量
步骤:按如图所示装置进行实验(药品及用量已标出;加热、夹持等装置已略去;硼酸极弱,仅作吸收剂,不影响盐酸标定氨的实验结果),维持沸腾一小时,取下锥形瓶,加入指示剂进行滴定操作,到达滴定终点时,消耗
 的盐酸溶液
的盐酸溶液 。
。
(4)指示剂为
(5)该晶体的纯度为
 。
。(6)下列实验操作可能使氨含量测定结果偏低的原因是 。
A.滴定时未用 标准溶液润洗滴定管 标准溶液润洗滴定管 | B.滴定前滴定管内无气泡,滴定后有气泡 |
| C.读数时,滴定前俯视,滴定后仰视 | D.刚看到指示剂局部的颜色变化就停止滴定 |
您最近一年使用:0次
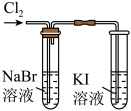
7 . 下列实验设计能达成对应的实验目的的是
选项 | A |
| C | D |
实验设计 |
|
|
|
|
实验目的 | 除去 中的少量 中的少量 | 比较 氧化性强弱 氧化性强弱 | 制备 测量其体积 测量其体积 | 测定醋酸的浓度 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
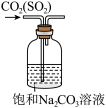
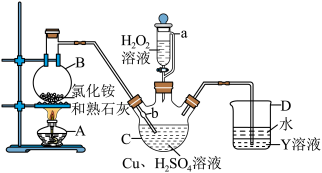
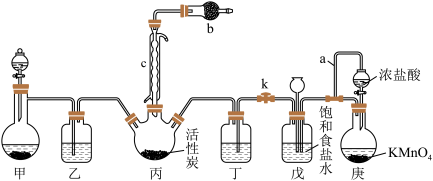
8 . 磺酰氯(SO2Cl2)是一种重要的有机合成试剂,实验室可利用SO2与Cl2在活性炭作用下反应制取SO2Cl2,装置如图所示(部分夹持装置省略)。已知:SO2Cl2的熔点为-54.1℃,沸点为69.1℃,遇水能发生剧烈的水解反应,产生白雾。
(1)甲装置用于实验室制SO2,则下列试剂组合中合适的是______ 。
A.18.4mol•L-1的硫酸和Cu
B.1mol•L-1的硝酸和Na2SO3
C.70%的硫酸和Na2SO3
(2)仪器c的名称是_______ ,乙和丁可以使用同样的试剂,该试剂为______ 。
(3)导管a的作用是______ ,装置b的作用是_____ 。
(4)请从平衡移动原理的角度解释戊中选择饱和食盐水的原因______ 。
(5)实验结束后关闭分液漏斗的活塞和止水夹k,此时装置戊的作用是______ 。
(6)滴定法测定工业磺酰氯的纯度
取1.8g样品(杂质不参与反应),加入100mL0.50mol•L-1NaOH溶液充分水解,冷却后加蒸馏水稀释至250mL,取25mL溶液于锥形瓶中,滴加2滴酚酞,用0.10mol•L-1的盐酸滴定。
①滴定前,需要将装有标准液的滴定管中的气泡排尽,应选择图中_______ 。_______ 。
(1)甲装置用于实验室制SO2,则下列试剂组合中合适的是
A.18.4mol•L-1的硫酸和Cu
B.1mol•L-1的硝酸和Na2SO3
C.70%的硫酸和Na2SO3
(2)仪器c的名称是
(3)导管a的作用是
(4)请从平衡移动原理的角度解释戊中选择饱和食盐水的原因
(5)实验结束后关闭分液漏斗的活塞和止水夹k,此时装置戊的作用是
(6)滴定法测定工业磺酰氯的纯度
取1.8g样品(杂质不参与反应),加入100mL0.50mol•L-1NaOH溶液充分水解,冷却后加蒸馏水稀释至250mL,取25mL溶液于锥形瓶中,滴加2滴酚酞,用0.10mol•L-1的盐酸滴定。
①滴定前,需要将装有标准液的滴定管中的气泡排尽,应选择图中
a. b.
b.  c.
c. d.
d.
| 第一次 | 第二次 | 第三次 | 第四次 | |
| 滴定前读数/mL | 0.10 | 1.10 | 1.45 | 0.00 |
| 滴定后读数/mL | 10.12 | 11.08 | 15.45 | 10.00 |
您最近一年使用:0次
名校
解题方法
9 . 某学生用已知物质的量浓度的硫酸来测定未知物质的量浓度的 溶液时,选择用酚酞作指示剂。请填空:
溶液时,选择用酚酞作指示剂。请填空:
(1)用标准的硫酸滴定待测的 溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛
溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛_______ 。
(2)某学生3次实验有关数据记录如表:
根据表中数据该 溶液的物质的量浓度为
溶液的物质的量浓度为_______  (保留四位有效数字)
(保留四位有效数字)
(3)该滴定终点实验现象为_______ 。
(4)以下操作会导致测得的 溶液浓度偏高的是_______
溶液浓度偏高的是_______
(5)氧化还原滴定实验的原理与中和滴定相似。水合肼( )作为一种化工原料,可合成发泡剂,现以
)作为一种化工原料,可合成发泡剂,现以 、
、 混合溶液制备水合肼,并测定其含量。
混合溶液制备水合肼,并测定其含量。
称取反应后的粗产品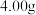 ,加水配成
,加水配成 溶液,取出
溶液,取出 ,用
,用 的
的 溶液滴定,发生反应的化学方程式为:
溶液滴定,发生反应的化学方程式为: ,实验测得消耗
,实验测得消耗 溶液的平均值为
溶液的平均值为 ,产品中水合肼的质量分数为
,产品中水合肼的质量分数为_______ 。(保留小数点后一位)
 溶液时,选择用酚酞作指示剂。请填空:
溶液时,选择用酚酞作指示剂。请填空:(1)用标准的硫酸滴定待测的
 溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛
溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛(2)某学生3次实验有关数据记录如表:
| 测定次数 | 待测 溶液的体积 溶液的体积 |  硫酸的体积 硫酸的体积 | |
| 滴定前刻度 | 滴定后刻度 | ||
| 第一次 | 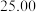 |  | 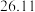 |
| 第二次 | 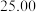 |  | 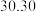 |
| 第三次 | 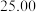 | 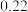 | 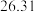 |
 溶液的物质的量浓度为
溶液的物质的量浓度为 (保留四位有效数字)
(保留四位有效数字)(3)该滴定终点实验现象为
(4)以下操作会导致测得的
 溶液浓度偏高的是_______
溶液浓度偏高的是_______| A.酸式滴定管未用标准液润洗 |
B.滴定前盛放 溶液的锥形瓶用蒸馏水洗净后没有干燥 溶液的锥形瓶用蒸馏水洗净后没有干燥 |
| C.量取碱液的碱式滴定管开始俯视读数,后来仰视读数 |
| D.碱式滴定管在取液前有气泡,之后气泡消失 |
 )作为一种化工原料,可合成发泡剂,现以
)作为一种化工原料,可合成发泡剂,现以 、
、 混合溶液制备水合肼,并测定其含量。
混合溶液制备水合肼,并测定其含量。称取反应后的粗产品
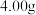 ,加水配成
,加水配成 溶液,取出
溶液,取出 ,用
,用 的
的 溶液滴定,发生反应的化学方程式为:
溶液滴定,发生反应的化学方程式为: ,实验测得消耗
,实验测得消耗 溶液的平均值为
溶液的平均值为 ,产品中水合肼的质量分数为
,产品中水合肼的质量分数为
您最近一年使用:0次
解题方法
10 . 25℃, 的HCl溶液滴定等浓度的一元碱MOH溶液的滴定曲线如图所示(“滴定分数”:所加滴定剂与被滴定组分的物质的量之比)。下列说法不正确的是
的HCl溶液滴定等浓度的一元碱MOH溶液的滴定曲线如图所示(“滴定分数”:所加滴定剂与被滴定组分的物质的量之比)。下列说法不正确的是
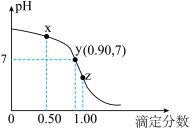
 的HCl溶液滴定等浓度的一元碱MOH溶液的滴定曲线如图所示(“滴定分数”:所加滴定剂与被滴定组分的物质的量之比)。下列说法不正确的是
的HCl溶液滴定等浓度的一元碱MOH溶液的滴定曲线如图所示(“滴定分数”:所加滴定剂与被滴定组分的物质的量之比)。下列说法不正确的是
| A.滴定操作时,可选用甲基橙做指示剂 |
| B.从x点到z点的滴定过程中,水的电离程度先增大后减小 |
C.x点处的溶液中满足: |
D.根据y点坐标可以得到 |
您最近一年使用:0次