解题方法
1 . 室温下,向 浓度均为
浓度均为 的
的 和
和 的混合溶液中逐滴加入
的混合溶液中逐滴加入 的
的 溶液。已知:
溶液。已知: 的
的 ,
,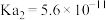 ,
,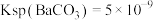 ,
, ,
,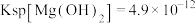 。下列说法
。下列说法不正确 的是
 浓度均为
浓度均为 的
的 和
和 的混合溶液中逐滴加入
的混合溶液中逐滴加入 的
的 溶液。已知:
溶液。已知: 的
的 ,
,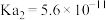 ,
,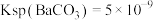 ,
, ,
,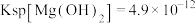 。下列说法
。下列说法A.加入 的 的 溶液后,在上层清液中滴加 溶液后,在上层清液中滴加 溶液无明显现象 溶液无明显现象 |
B. 溶液中存在关系, 溶液中存在关系,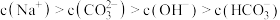 |
C.在 和 和 的混合溶液加几滴稀盐酸, 的混合溶液加几滴稀盐酸, 几乎不变 几乎不变 |
D.向 和 和 混合溶液加入 混合溶液加入 溶液,可能生成碱式碳酸镁 溶液,可能生成碱式碳酸镁 |
您最近半年使用:0次
名校
解题方法
2 . 常温下,下列关于电解质溶液的说法正确的是
| A.pH=12的氨水和氢氧化钠溶液按体积比1∶9混合后,pH值增大 |
B.等体积、等浓度的Na2CO3和NaHCO3溶液混合后,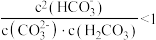 |
C.0.2mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合后存在: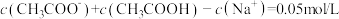 |
D.等浓度的氨水和硫酸按体积比3∶1混合后溶液显碱性,则混合溶液中存在: |
您最近半年使用:0次
名校
解题方法
3 . 甲胺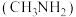 是一种弱碱
是一种弱碱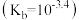 ,可与盐酸反应生成盐酸盐(用
,可与盐酸反应生成盐酸盐(用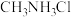 表示)。下列叙述不正确的是
表示)。下列叙述不正确的是
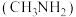 是一种弱碱
是一种弱碱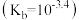 ,可与盐酸反应生成盐酸盐(用
,可与盐酸反应生成盐酸盐(用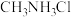 表示)。下列叙述不正确的是
表示)。下列叙述不正确的是A.甲胺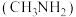 中氮原子采用 中氮原子采用 杂化 杂化 |
B. 水溶液的 水溶液的 |
C.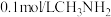 水溶液加水稀释, 水溶液加水稀释, 降低 降低 |
D.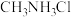 水溶液中: 水溶液中: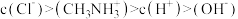 |
您最近半年使用:0次
4 . 25℃时,向20mL0.1 mol∙L-1HA溶液中逐滴加入0.1 mol∙L-1NaOH溶液,pH变化曲线如下图所示。下列说法不正确的

| A.HA电离平衡常数的数量级为10-5 |
| B.a点→c点的过程中水的电离度持续增大 |
| C.b点溶液中c(Na+)=c(A-) |
D.a点溶液中微粒浓度: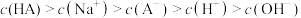 |
您最近半年使用:0次
名校
解题方法
5 . CO2的过量排放会产生一系列生态和环境问题,CO2主要通过如下平衡过程对水体钙循环和海洋生态产生影响。
CaCO3+CO2+H2O Ca2++2
Ca2++2
(1)碳酸盐的溶解是水体中Ca2+的主要来源。CO2过量排放会导致水体中c(Ca2+)_____ (填“增大”“减小”或“不变”)。
(2)下列关于CO2的说法中,正确的有_____ (填字母序号)
a、CO2能溶于水,跟CO2能与水发生反应有关
b、CO2不助燃,在活泼金属发生火灾时可用来灭火
c、CO2分子中,C原子采取sp杂化,与O原子形成σ键和π键
(3)海水中含有的离子主要有Na+、Ca2+、K+、Cl-、 ,海水呈弱碱性,用化学用语解释原因:
,海水呈弱碱性,用化学用语解释原因:_____ 。
(4)珊瑚藻是一种对海水酸化极为敏感的藻类,其可通过光合作用和钙化作用促进珊瑚礁(主要成分为CaCO3)的形成,过程如下图所示。
①珊瑚藻能促进珊瑚礁的形成,原因是_____ 。
②CO2排放导致海水酸化,对珊瑚藻的影响有_____ (填字母)。
a.阻碍了钙化作用 b.阻碍了光合作用 c.增强了呼吸作用,消耗有机物
(5)水体中 、
、 浓度的监测对生态研究具有重要意义,测定方法如下:
浓度的监测对生态研究具有重要意义,测定方法如下:
ⅰ.取50mL待测水样,滴加4~6滴酚酞溶液,摇匀。
ⅱ.溶液变为红色,用cmol/L盐酸滴定至红色刚好消失(pH约8.3),消耗盐酸体积为V1mL。
ⅲ.滴加4~6滴甲基橙溶液,摇匀,用cmol/L盐酸滴定至溶液从黄色变为橙色(pH约3.8),消耗盐酸体积为V2mL。
①ⅱ中发生反应的离子方程式为_____ 。
②该水体中c( )为
)为_____ (用计算式表示)。
CaCO3+CO2+H2O
 Ca2++2
Ca2++2
(1)碳酸盐的溶解是水体中Ca2+的主要来源。CO2过量排放会导致水体中c(Ca2+)
(2)下列关于CO2的说法中,正确的有
a、CO2能溶于水,跟CO2能与水发生反应有关
b、CO2不助燃,在活泼金属发生火灾时可用来灭火
c、CO2分子中,C原子采取sp杂化,与O原子形成σ键和π键
(3)海水中含有的离子主要有Na+、Ca2+、K+、Cl-、
 ,海水呈弱碱性,用化学用语解释原因:
,海水呈弱碱性,用化学用语解释原因:(4)珊瑚藻是一种对海水酸化极为敏感的藻类,其可通过光合作用和钙化作用促进珊瑚礁(主要成分为CaCO3)的形成,过程如下图所示。
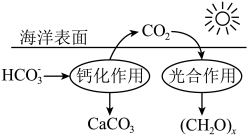
①珊瑚藻能促进珊瑚礁的形成,原因是
②CO2排放导致海水酸化,对珊瑚藻的影响有
a.阻碍了钙化作用 b.阻碍了光合作用 c.增强了呼吸作用,消耗有机物
(5)水体中
 、
、 浓度的监测对生态研究具有重要意义,测定方法如下:
浓度的监测对生态研究具有重要意义,测定方法如下:ⅰ.取50mL待测水样,滴加4~6滴酚酞溶液,摇匀。
ⅱ.溶液变为红色,用cmol/L盐酸滴定至红色刚好消失(pH约8.3),消耗盐酸体积为V1mL。
ⅲ.滴加4~6滴甲基橙溶液,摇匀,用cmol/L盐酸滴定至溶液从黄色变为橙色(pH约3.8),消耗盐酸体积为V2mL。
①ⅱ中发生反应的离子方程式为
②该水体中c(
 )为
)为
您最近半年使用:0次
解题方法
6 . 已知:常温下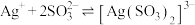 ,
,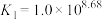 ,
,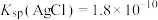 ,某实验小组利用AgCl与Na2SO3反应生成
,某实验小组利用AgCl与Na2SO3反应生成 来“分银”,“分银”时,
来“分银”,“分银”时, 的浓度与溶液pH的关系如图1;
的浓度与溶液pH的关系如图1; 与H+形成的微粒的浓度分数
与H+形成的微粒的浓度分数 随溶液pH变化的关系如图2,下列叙述错误的是
随溶液pH变化的关系如图2,下列叙述错误的是
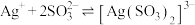 ,
,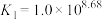 ,
,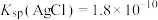 ,某实验小组利用AgCl与Na2SO3反应生成
,某实验小组利用AgCl与Na2SO3反应生成 来“分银”,“分银”时,
来“分银”,“分银”时, 的浓度与溶液pH的关系如图1;
的浓度与溶液pH的关系如图1; 与H+形成的微粒的浓度分数
与H+形成的微粒的浓度分数 随溶液pH变化的关系如图2,下列叙述错误的是
随溶液pH变化的关系如图2,下列叙述错误的是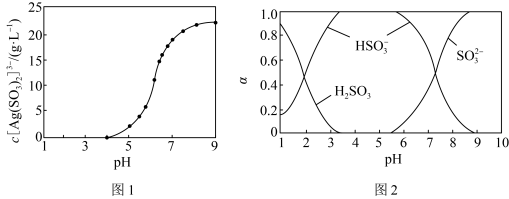
A. 中的∠O—S—O小于 中的∠O—S—O小于 中的∠O—S—O 中的∠O—S—O |
| B.“分银”时,pH需控制的范围大约是8~9 |
C. 溶液中存在 溶液中存在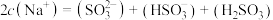 |
D.AgCl与 反应生成 反应生成 和 和 ,该反应的平衡常数 ,该反应的平衡常数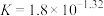 |
您最近半年使用:0次
解题方法
7 . 氯化铁是一种重要的盐,下列说法正确的是
A. FeCl3在水中的电离方程式: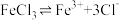 |
B.常温下,FeCl3溶液中水电离出的OH-浓度小于 |
C. FeCl3溶液呈酸性的原因: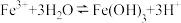 |
D.用FeCl3溶液脱除废气中的 |
您最近半年使用:0次
8 . 常温下,向0.40mol/LH2SO3(不考虑H2SO3不稳定分解生成SO2)溶液中逐滴滴加一定浓度的NaOH溶液,所得溶液中H2SO3、 、
、 三种微粒的物质的量分数(
三种微粒的物质的量分数( )与溶液pH的关系如图所示。用Ka1、Ka2分别表示H2SO3一级与二级电离平衡常数。已知
)与溶液pH的关系如图所示。用Ka1、Ka2分别表示H2SO3一级与二级电离平衡常数。已知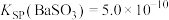 。下列说法
。下列说法不正确 的是
 、
、 三种微粒的物质的量分数(
三种微粒的物质的量分数( )与溶液pH的关系如图所示。用Ka1、Ka2分别表示H2SO3一级与二级电离平衡常数。已知
)与溶液pH的关系如图所示。用Ka1、Ka2分别表示H2SO3一级与二级电离平衡常数。已知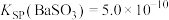 。下列说法
。下列说法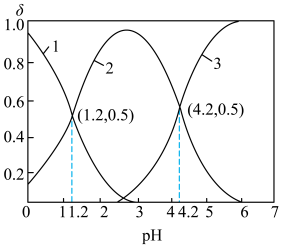
A.曲线2表示的微粒是 , ,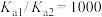 |
B.当 时,溶液中 时,溶液中 , , 时,溶液中 时,溶液中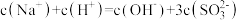 |
C.将0.40mol/LH2SO3溶液稀释至0.20mol/L,溶液中 几乎不变 几乎不变 |
D.0.40mol/LH2SO3溶液与0.40mol/LBaCl2溶液等体积混合,不会出现 沉淀 沉淀 |
您最近半年使用:0次
名校
9 . 类比法是一种学习化学的重要方法。下列“类比”不合理的是
A.由 可推出非金属性 可推出非金属性 ,则由 ,则由 可推出非金属性 可推出非金属性 |
B. 水溶液显碱性,则 水溶液显碱性,则 水溶液显碱性。 水溶液显碱性。 |
C. 与HCl反应生成 与HCl反应生成 ,则 ,则 也可与HCl反应生成 也可与HCl反应生成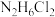 |
D.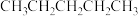 的沸点比 的沸点比 的高,则 的高,则 的沸点比 的沸点比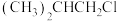 的高 的高 |
您最近半年使用:0次
名校
10 . 电离平衡常数和电离度(电离度是指已电离的电解质分子数占原来总分子数的百分比)均可衡量弱电解质的电离,下表是常温下几种弱酸的电离平衡常数( )和弱碱的电离平衡常数(
)和弱碱的电离平衡常数( ),回答下列问题∶
),回答下列问题∶
(1) 的水溶液呈
的水溶液呈______ (填“酸性”、“中性”或“碱性”),理由是______ 。
(2)现测得溶解了 的某盐酸的pH=4,则该溶液中
的某盐酸的pH=4,则该溶液中 的电离度约为
的电离度约为______ 。
(3)常温下,浓度相同的三种溶液NaF、 、
、 ,pH由大到小的顺序是
,pH由大到小的顺序是______ 。
(4)将过量 通入
通入 溶液中,反应的离子方程式为
溶液中,反应的离子方程式为______ 。
 )和弱碱的电离平衡常数(
)和弱碱的电离平衡常数( ),回答下列问题∶
),回答下列问题∶| 弱酸或弱碱 | HF |  |  |  |  |
| 电离平衡常数 | 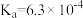 |  | 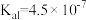 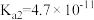 |  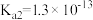 | 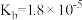 |
 的水溶液呈
的水溶液呈(2)现测得溶解了
 的某盐酸的pH=4,则该溶液中
的某盐酸的pH=4,则该溶液中 的电离度约为
的电离度约为(3)常温下,浓度相同的三种溶液NaF、
 、
、 ,pH由大到小的顺序是
,pH由大到小的顺序是(4)将过量
 通入
通入 溶液中,反应的离子方程式为
溶液中,反应的离子方程式为
您最近半年使用:0次



