1 . 向200mL稀 与稀
与稀 的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况下)之间的关系如图所示,且曲线中每一段只对应一个反应。下列说法错误的是
的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况下)之间的关系如图所示,且曲线中每一段只对应一个反应。下列说法错误的是
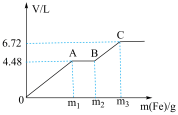
 与稀
与稀 的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况下)之间的关系如图所示,且曲线中每一段只对应一个反应。下列说法错误的是
的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况下)之间的关系如图所示,且曲线中每一段只对应一个反应。下列说法错误的是
A.混合溶液中 的物质的量浓度为1 mol/L 的物质的量浓度为1 mol/L |
| B.若向铜粉中加入100mL上述混合溶液,最多能溶解19.2g铜 |
C.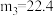 |
D.每一阶段反应转移电子数目之比为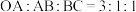 |
您最近一年使用:0次
名校
解题方法
2 . 白磷(P4)有毒,实验时若皮肤接触到白磷,应立即用稀CuSO4溶液清洗,发生两个反应:
反应①为P4和CuSO4反应的主要生成物为Cu、H3PO4和H2SO4;
反应②为11P4+60CuSO4+96H2O=20Cu3P+24H3PO4+60H2SO4。
下列说法正确的是
反应①为P4和CuSO4反应的主要生成物为Cu、H3PO4和H2SO4;
反应②为11P4+60CuSO4+96H2O=20Cu3P+24H3PO4+60H2SO4。
下列说法正确的是
| A.在反应①和②中,P4只作还原剂 |
| B.反应①中氧化产物与还原产物的个数之比为5∶2 |
| C.皮肤接触到白磷,用稀CuSO4溶液清洗后,应再使用NaOH溶液清洗 |
| D.若P4反应完全且转化为H3PO4的转化率是80%,理论上反应①和②消耗P4的个数之比为14∶11 |
您最近一年使用:0次
2022-11-09更新
|
1318次组卷
|
4卷引用:山西省实验中学2023-2024学年高一上学期第一次月考化学试题
名校
解题方法
3 . 氧化铁是一种红棕色粉末俗称铁红,是常见的铁的氧化物。
Ⅰ.请列举氧化铁一种用途;_______ 。
Ⅱ.氧化亚铜 也是红色粉末,有类似于氧化铁的用途。查阅资料可知:
也是红色粉末,有类似于氧化铁的用途。查阅资料可知: 是一种碱性氧化物,溶于稀硫酸生成
是一种碱性氧化物,溶于稀硫酸生成 和
和 ,在空气中加热生成
,在空气中加热生成 .实验室有一些红色粉末,根据来源,只知其成分可能含有氧化铁或氧化亚铜.某化学小组欲一探究竟,提出如下假设:
.实验室有一些红色粉末,根据来源,只知其成分可能含有氧化铁或氧化亚铜.某化学小组欲一探究竟,提出如下假设:
假设1:红色粉末是 ;假设2:红色粉末是
;假设2:红色粉末是 ;假设3:
;假设3:_______ 。
他们取少量粉末,欲向其中加入足量稀硫酸,并滴加 溶液,通过现象推断其成分。请回答下列问题:
溶液,通过现象推断其成分。请回答下列问题:
(1)若假设1成立,则实验现象是_______ 。
(2)有人认为,若滴加 试剂后溶液不变红色,则证明原固体粉末中一定不含氧化铁。你认为这种说法是否合理?
试剂后溶液不变红色,则证明原固体粉末中一定不含氧化铁。你认为这种说法是否合理?_______ (填“合理”或“不合理”).请简述你的理由(不需写出反应的方程式):_______ 。
(3)按照他们的设计加入足量稀硫酸充分反应后,滴加 溶液,溶液先变为红色,然后红色逐渐变浅直至消失,同时生成一种白色沉淀。为了探究白色沉淀产生的原因,同学们首先查阅资料,得知:
溶液,溶液先变为红色,然后红色逐渐变浅直至消失,同时生成一种白色沉淀。为了探究白色沉淀产生的原因,同学们首先查阅资料,得知:
ⅰ. 是难溶于水的白色固体; ⅱ.
是难溶于水的白色固体; ⅱ. 的化学性质与
的化学性质与 的相似 ⅲ.
的相似 ⅲ.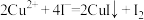 。
。
同学们按照如表方案进行实验,证明了白色沉淀的成分为 .请你补全表格中相关内容:
.请你补全表格中相关内容:
 与
与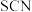 -反应的离子方程式为
-反应的离子方程式为_______ .由此可以证明,实验室中红色粉末的成分是_______ 。
(4)同学们认为,通过加热法测定 的质量分数,也可以判断红色粉末的成分.他们取ag固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg,则混合物中
的质量分数,也可以判断红色粉末的成分.他们取ag固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg,则混合物中 质量分数为
质量分数为_______ 。
Ⅰ.请列举氧化铁一种用途;
Ⅱ.氧化亚铜
 也是红色粉末,有类似于氧化铁的用途。查阅资料可知:
也是红色粉末,有类似于氧化铁的用途。查阅资料可知: 是一种碱性氧化物,溶于稀硫酸生成
是一种碱性氧化物,溶于稀硫酸生成 和
和 ,在空气中加热生成
,在空气中加热生成 .实验室有一些红色粉末,根据来源,只知其成分可能含有氧化铁或氧化亚铜.某化学小组欲一探究竟,提出如下假设:
.实验室有一些红色粉末,根据来源,只知其成分可能含有氧化铁或氧化亚铜.某化学小组欲一探究竟,提出如下假设:假设1:红色粉末是
 ;假设2:红色粉末是
;假设2:红色粉末是 ;假设3:
;假设3:他们取少量粉末,欲向其中加入足量稀硫酸,并滴加
 溶液,通过现象推断其成分。请回答下列问题:
溶液,通过现象推断其成分。请回答下列问题:(1)若假设1成立,则实验现象是
(2)有人认为,若滴加
 试剂后溶液不变红色,则证明原固体粉末中一定不含氧化铁。你认为这种说法是否合理?
试剂后溶液不变红色,则证明原固体粉末中一定不含氧化铁。你认为这种说法是否合理?(3)按照他们的设计加入足量稀硫酸充分反应后,滴加
 溶液,溶液先变为红色,然后红色逐渐变浅直至消失,同时生成一种白色沉淀。为了探究白色沉淀产生的原因,同学们首先查阅资料,得知:
溶液,溶液先变为红色,然后红色逐渐变浅直至消失,同时生成一种白色沉淀。为了探究白色沉淀产生的原因,同学们首先查阅资料,得知:ⅰ.
 是难溶于水的白色固体; ⅱ.
是难溶于水的白色固体; ⅱ. 的化学性质与
的化学性质与 的相似 ⅲ.
的相似 ⅲ.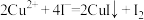 。
。同学们按照如表方案进行实验,证明了白色沉淀的成分为
 .请你补全表格中相关内容:
.请你补全表格中相关内容:| 实验方案 | 实验现象 |
步骤1:取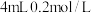 的 的 ,溶液于试管中,向其中滴加3滴 ,溶液于试管中,向其中滴加3滴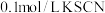 溶液 溶液 | |
步骤2:取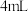  的 的 溶液于试管中,向其中滴加3滴 溶液于试管中,向其中滴加3滴 溶液 溶液 |
 与
与 -反应的离子方程式为
-反应的离子方程式为(4)同学们认为,通过加热法测定
 的质量分数,也可以判断红色粉末的成分.他们取ag固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg,则混合物中
的质量分数,也可以判断红色粉末的成分.他们取ag固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg,则混合物中 质量分数为
质量分数为
您最近一年使用:0次
2021-01-28更新
|
1164次组卷
|
2卷引用:山西省2020-2021学年高一上学期期末考试化学试题
名校
解题方法
4 . 将过氧化钠投入到下列物质的溶液中,溶液的质量不会减轻的是( )
| A.NaCl | B.Fe2(SO4)3 |
| C.饱和烧碱溶液 | D.Ba(HCO3)2 |
您最近一年使用:0次
2020-03-14更新
|
2130次组卷
|
4卷引用:山西省大同市第一中学2019-2020学年高一下学期3月网上考试化学试题
5 . 某稀溶液中含有4 mol KNO3和2.5 mol H2SO4,向其中加入1.5 mol Fe,充分反应(已知 被还原为NO),最终溶液体积为1L。下列说法正确的是
被还原为NO),最终溶液体积为1L。下列说法正确的是
 被还原为NO),最终溶液体积为1L。下列说法正确的是
被还原为NO),最终溶液体积为1L。下列说法正确的是A.所得溶液中c( )=2.75 mol·L-1 )=2.75 mol·L-1 |
| B.所得溶液中c(Fe2+):c(Fe3+)=1:2 |
| C.反应后生成NO的体积为33.6 L(标准状况下) |
| D.所得溶液中的溶质只有FeSO4 |
您最近一年使用:0次
2019-02-20更新
|
4954次组卷
|
16卷引用:山西省太原市山西现代双语学校2021-2022学年高一下学期5月月考化学试题
山西省太原市山西现代双语学校2021-2022学年高一下学期5月月考化学试题【全国百强校】江西省南昌市第二中学2017-2018学年高一下学期第二次月考化学试题【校级联考】天津市六校(静海一中、宝坻一中、杨村一中等)2018-2019学年高一上学期期末考试化学试题福建省莆田第六中学2018-2019学年高一(实验班)下学期期中考试化学试题福建省莆田第六中学2018-2019学年高一下学期期中考试化学试题江西省新余市第一中学2019-2020学年高一下学期第一次月考化学试题湖南省衡阳市第一中学2019-2020学年高一下学期入学考试化学试题黑龙江省鸡西市第一中学2019-2020学年高一下学期期中考试化学试题浙江省温州市瑞安市上海新纪元高级中学2021-2022学年高一9月份月考(5-6班)化学试题广东省大联考2021-2022学年高一下学期期中检测化学试题浙江省湖州中学2022-2023学年高一下学期3月第一次检测化学试题湖北省武汉市第二中学2023-2024学年高一下学期化学周练A卷(1)试卷 湖北省武汉市第十二中学2023-2024学年高一下学期3月月考化学试题河北省石家庄市河北正定中学2023-2024学年高一下学期第一次月考(3月)化学试题安徽省淮南市第二中2023-2024学年高一下学期第一次月考化学试题【全国百强校】湖南省长沙市雅礼中学2017-2018学年高二下学期期末考试化学试题
6 . 铝是地壳中含量最多的金属元素,其单质和化合物广泛应用于日常生活中。
(1)铝粉和铁的氧化物(FeO-Fe2O3)可配成铝热剂用于焊接钢轨,反应的化学方程式是_______ 。
(2)以铝土矿(主要成分为Al2O3。含SiO2和Fe2O3等杂质)为原料生产铝和铵明矾晶体[NH4Al(SO4)2·12H2O]的一种工艺流程如下【已知:SiO2在“碱溶”时转化为铝硅酸钠(NaAlSiO4·nH2O)沉淀】。

①实验前,要将铝土矿粉碎的目的是_______ 。
②用氧化物的形式表示铝硅酸钠的化学式_______ 。
③步骤②涉及到的离子方程式是:_______ 。
④写出利用Al2O3制备金属Al的化学方程式:_______ 。
⑤若同时制取铵明矾和硫酸铝,通过控制硫酸的用量调节两种产品的产量。若欲使制得的铵明矾和硫酸铝的物质的量之比为1:1,则投料时铝土矿中的Al2O3和H2SO4的物质的量之比为_______ 。
(1)铝粉和铁的氧化物(FeO-Fe2O3)可配成铝热剂用于焊接钢轨,反应的化学方程式是
(2)以铝土矿(主要成分为Al2O3。含SiO2和Fe2O3等杂质)为原料生产铝和铵明矾晶体[NH4Al(SO4)2·12H2O]的一种工艺流程如下【已知:SiO2在“碱溶”时转化为铝硅酸钠(NaAlSiO4·nH2O)沉淀】。

①实验前,要将铝土矿粉碎的目的是
②用氧化物的形式表示铝硅酸钠的化学式
③步骤②涉及到的离子方程式是:
④写出利用Al2O3制备金属Al的化学方程式:
⑤若同时制取铵明矾和硫酸铝,通过控制硫酸的用量调节两种产品的产量。若欲使制得的铵明矾和硫酸铝的物质的量之比为1:1,则投料时铝土矿中的Al2O3和H2SO4的物质的量之比为
您最近一年使用:0次
2018-07-16更新
|
1314次组卷
|
2卷引用:【全国百强校】山西省临汾第一中学2017-2018学年高一下学期期末考试化学试题
名校
7 . 从定性分析到定量研究是高中生化学学习的重要发展历程。请你根据所学知识对以下化学问题进行定量分析。
(1)高锰酸钾是一种典型的强氧化剂。在用KMnO4酸性溶液处理CuS的混合物时,发生的反应如下:6 MnO4-+5 CuS + 28H+ = 5Cu2+ + 5SO2↑ +6 Mn2++ 14H2O,请用单线桥法标出该反应中电子转移的方向和数目:
6 MnO4-+5 CuS + 28H+ = 5Cu2+ + 5SO2↑ +6 Mn2++ 14H2O________________
(2)汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3=K2O+5Na2O+16N2↑。若氧化产物比还原产物多1.75 mol, 则转移的电子数为__________ , 被氧化的N原子的物质的量为__________ 。
(3)实验室需要为无土栽培配制1 L内含0.24 mol K2SO4、0.5 mol NH4Cl、0.16 mol KCl的某营养液。某小组计划用(NH4)2SO4、KCl、NH4Cl配制,则需这三种固体的物质的量分别为_________ 、_________ 、_________ 。
(1)高锰酸钾是一种典型的强氧化剂。在用KMnO4酸性溶液处理CuS的混合物时,发生的反应如下:6 MnO4-+5 CuS + 28H+ = 5Cu2+ + 5SO2↑ +6 Mn2++ 14H2O,请用单线桥法标出该反应中电子转移的方向和数目:
6 MnO4-+5 CuS + 28H+ = 5Cu2+ + 5SO2↑ +6 Mn2++ 14H2O
(2)汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3=K2O+5Na2O+16N2↑。若氧化产物比还原产物多1.75 mol, 则转移的电子数为
(3)实验室需要为无土栽培配制1 L内含0.24 mol K2SO4、0.5 mol NH4Cl、0.16 mol KCl的某营养液。某小组计划用(NH4)2SO4、KCl、NH4Cl配制,则需这三种固体的物质的量分别为
您最近一年使用:0次
2017-12-06更新
|
1327次组卷
|
2卷引用:山西大学附属中学2017-2018学年高一上学期11月期中考试化学试题
名校
8 . A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等。
(1)E元素在周期表中的位置为__________________ 。写出E的最高价氧化物的水化物与D的最高价氧化物的水化物反应的离子方程式____________________________________ 。
(2)由A、B、W三种元素组成的18电子微粒的分子式为____________________ 。
(3)经测定A2W2为二元弱酸,常用硫酸处理BaO2来制备A2W2,写出该反应的化学方程式_________________________________________ 。
(4)向含有Fe2+和淀粉KI的酸性溶液中滴入A2W2,观察到溶液呈蓝色并有红褐色沉淀生成。当消耗2mol I-时,共转移3mol电子,该反应的离子方程式是___________________________________ 。
(5)元素D的单质在一定条件下,能与A单质化合生成一种化合物DA,熔点为800℃,能与水反应放氢气,若将1molDA和1molE单质混合加入足量的水,充分反应后生成气体的体积是_________ L(标准状况下)。
(1)E元素在周期表中的位置为
(2)由A、B、W三种元素组成的18电子微粒的分子式为
(3)经测定A2W2为二元弱酸,常用硫酸处理BaO2来制备A2W2,写出该反应的化学方程式
(4)向含有Fe2+和淀粉KI的酸性溶液中滴入A2W2,观察到溶液呈蓝色并有红褐色沉淀生成。当消耗2mol I-时,共转移3mol电子,该反应的离子方程式是
(5)元素D的单质在一定条件下,能与A单质化合生成一种化合物DA,熔点为800℃,能与水反应放氢气,若将1molDA和1molE单质混合加入足量的水,充分反应后生成气体的体积是
您最近一年使用:0次
2016-12-09更新
|
1335次组卷
|
4卷引用:山西省沁县中学2018-2019学年高一下学期第一次月考化学试题
解题方法
9 . 某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置。
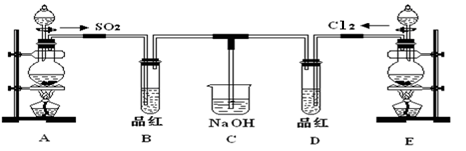
(1)实验室用装置A制备SO2。从物质类别看,SO2属于____________ (填“酸性”、“两性”或“碱性”)氧化物;
(2)实验室用装置E制备Cl2,写出该反应的化学方程式:___________________ 。反应中的液体反应物在反应中所表现出的性质为:_________________ ;
(3)反应开始一段时间后,观察到B、D两个试管中的品红溶液均褪色。停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为B:________________ ,D:_________________ 。
(4)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强,他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象那样。请你分析该现象的原因(用化学方程式表示)_______________________ 。
(5)C装置是尾气处理装置,写出C装置处理氯气的离子方程式_________________ 。

(1)实验室用装置A制备SO2。从物质类别看,SO2属于
(2)实验室用装置E制备Cl2,写出该反应的化学方程式:
(3)反应开始一段时间后,观察到B、D两个试管中的品红溶液均褪色。停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为B:
(4)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强,他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象那样。请你分析该现象的原因(用化学方程式表示)
(5)C装置是尾气处理装置,写出C装置处理氯气的离子方程式
您最近一年使用:0次
名校
解题方法
10 . 我校高一化学兴趣小组的同学们为探究铁与浓硫酸的反应,设计了如图所示装置进行实验。
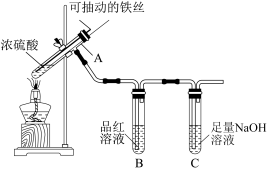
(1)实验过程中,观察到B中的实验现象是_______________ ;写出C中发生反应的离子方程式_________________________ 。
(2)浓硫酸与足量的铁丝反应一段时间后,若观察到从C中有少量的气泡冒出,此气泡的成分是___________ 。试分析产生该气体的原因____________________ 。
(3)用“可抽动的铁丝”代替“直接投入铁片”的优点是_____________________ ;
(4)反应一段时间后,他们对A中溶液的金属阳离子进行了探究
①提出假设:
假设1:_____________ ;
假设2:_____________ ;
假设3:溶液中存在Fe2+和Fe3+。
②已知假设3是正确的,选择合适的试剂,设计实验验证上述假设3,写出实验操作步骤、实验现象及结论。限选试剂:稀HNO3、氯水、酸性KMnO4溶液、NaOH溶液、KSCN溶液。

(1)实验过程中,观察到B中的实验现象是
(2)浓硫酸与足量的铁丝反应一段时间后,若观察到从C中有少量的气泡冒出,此气泡的成分是
(3)用“可抽动的铁丝”代替“直接投入铁片”的优点是
(4)反应一段时间后,他们对A中溶液的金属阳离子进行了探究
①提出假设:
假设1:
假设2:
假设3:溶液中存在Fe2+和Fe3+。
②已知假设3是正确的,选择合适的试剂,设计实验验证上述假设3,写出实验操作步骤、实验现象及结论。限选试剂:稀HNO3、氯水、酸性KMnO4溶液、NaOH溶液、KSCN溶液。
| 实验操作步骤 | 实验现象 | 结论 |
| Ⅰ | 溶液中存在Fe3+; | |
| Ⅱ |
您最近一年使用:0次
2016-12-09更新
|
889次组卷
|
2卷引用:2015-2016学年山西省太原五中高一上学期期末化学试卷



