解题方法
1 . 苯甲酸可用作食品防腐剂。实验室可通过甲苯(密度为0.87g·mL-1) 氧化制苯甲酸,其反应原理、制备装置如下:
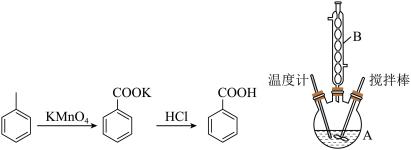
实验步骤:
I.向仪器A 中加入1.5mL甲苯、100mL水和4.8g(约0.03mol)高锰酸钾(被还原为MnO2),慢慢搅拌,并加热回流约30min后停止加热并继续搅拌1 min。
Ⅱ.将反应液与适量饱和亚硫酸氢钠溶液混合振荡,过滤、洗涤,将滤液、洗涤液合并放在置于冰水浴中的烧杯内,再用浓盐酸酸化至苯甲酸完全析出。将析出的苯甲酸过滤,用适量X洗涤、然后干燥,称量,得到1.0g粗产品。
Ⅲ.纯度测定:称取0.150g 粗产品(杂质不与NaOH反应),配成乙醇溶液并置于100 mL容量瓶中定容。每次移取25.00mL溶液,用0.01000mol·L-¹的NaOH标准溶液滴定,三次滴定平均消耗22.50mL的NaOH标准溶液。
回答下列问题:
(1)仪器 A 的名称是___________ ,其最适宜规格为___________ (填字母)。
a.100mL b.250mL c.500mL d.1000mL
(2)步骤Ⅱ中的适量饱和亚硫酸氢钠溶液的作用是___________ 。使用冰水浴的目的是___________ ,X是___________ 。
(3)装置中仪器B的作用是___________
(4)本实验制备的苯甲酸的纯度为___________ %(保留1位小数)。
(5)若要得到纯度更高的苯甲酸,可通过___________ 的方法提纯。

| 名称 | 相对分子质量 | 熔点/℃ | 沸点/℃ | 溶解性 |
| 甲苯 | 92 | -95 | 110.6 | 不溶于水,易溶于乙醇 |
| 苯甲酸 | 122 | 122.4 | 248 | 微溶于冷水,易溶于乙醇、热水 |
I.向仪器A 中加入1.5mL甲苯、100mL水和4.8g(约0.03mol)高锰酸钾(被还原为MnO2),慢慢搅拌,并加热回流约30min后停止加热并继续搅拌1 min。
Ⅱ.将反应液与适量饱和亚硫酸氢钠溶液混合振荡,过滤、洗涤,将滤液、洗涤液合并放在置于冰水浴中的烧杯内,再用浓盐酸酸化至苯甲酸完全析出。将析出的苯甲酸过滤,用适量X洗涤、然后干燥,称量,得到1.0g粗产品。
Ⅲ.纯度测定:称取0.150g 粗产品(杂质不与NaOH反应),配成乙醇溶液并置于100 mL容量瓶中定容。每次移取25.00mL溶液,用0.01000mol·L-¹的NaOH标准溶液滴定,三次滴定平均消耗22.50mL的NaOH标准溶液。
回答下列问题:
(1)仪器 A 的名称是
a.100mL b.250mL c.500mL d.1000mL
(2)步骤Ⅱ中的适量饱和亚硫酸氢钠溶液的作用是
(3)装置中仪器B的作用是
(4)本实验制备的苯甲酸的纯度为
(5)若要得到纯度更高的苯甲酸,可通过
您最近一年使用:0次
名校
解题方法
2 . 下列实验过程能达到实验目的的是
| 编号 | 实验目的 | 实验过程 |
| A | 配制0.4000mol·L−1的NaOH溶液 | 称取4.0g固体NaOH于烧杯中,加入少量蒸馏水溶解,转移至250mL容量瓶中定容 |
| B | 鉴别NaHCO3溶液与Na2CO3溶液 | 用小试管分别取少量待测溶液,然后滴加澄清石灰水 |
| C | 检验Na2SO3样品未变质 | 用取样于试管加入水溶解,滴加几滴硝酸,再加少量BaCl2溶液,观察现象 |
| D | 探究维生素C的还原性 | 向盛有2mL黄色氯化铁溶液的试管中滴加浓的维生素C溶液,观察颜色变化 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
3 . 海水中主要含有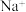 、
、 、
、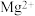 、
、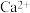 、
、 、
、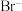 、
、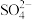 、
、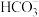 、
、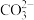 等离子,火力发电时排放的烟气可用海水脱硫,其工艺流程如下所示:
等离子,火力发电时排放的烟气可用海水脱硫,其工艺流程如下所示:

下列说法错误的是
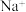 、
、 、
、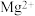 、
、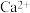 、
、 、
、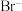 、
、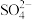 、
、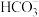 、
、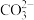 等离子,火力发电时排放的烟气可用海水脱硫,其工艺流程如下所示:
等离子,火力发电时排放的烟气可用海水脱硫,其工艺流程如下所示:
下列说法错误的是
A.工业上用电解熔融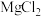 的方法制取镁 的方法制取镁 |
B.吸收塔中发生的反应有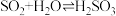 |
C.氧化主要是氧气将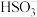 、 、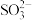 、 、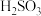 氧化为 氧化为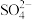 |
D.经稀释“排放”出的废水中,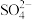 浓度与海水相同 浓度与海水相同 |
您最近一年使用:0次
名校
4 . 氯化亚铜(CuCl)在工业生产中有着广泛的应用,它不溶于H2SO4、HNO3和醇,微溶于水,可溶于浓盐酸和氨水,在潮湿空气中易水解,被氧化成绿色的碱式氯化铜[Cu2(OH)3Cl]。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuCl的工艺过程如图:
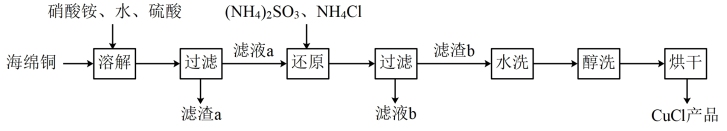
(1)写出溶解过程中发生的氧化还原反应的离子方程式____ ,为加快溶解速率可以采取的措施是____ (回答一条即可)。
(2)还原过程中发生的主要反应的离子方程式是____ 。
(3)析出的CuCl晶体水洗后要立即用无水乙醇洗涤,在真空干燥机内于70℃干燥2h,冷却密封包装。70℃真空干燥、密封包装的原因是____ 。
(4)滤液b中存在的主要物质是____ (填化学式)。
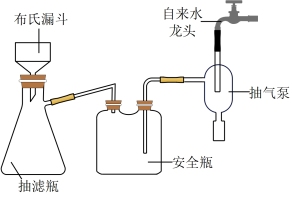
(5)实验室为了加快过滤速率,可以采用抽滤的操作(如图),有关抽滤的说法正确的是____ (填字母)。
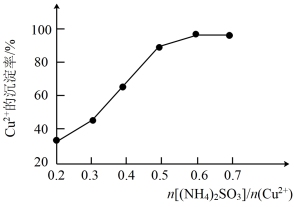
(6)(NH4)2SO3的用量与Cu2+沉淀率的关系如图所示,工业上采用 =0.6最为适宜,此时(NH4)2SO3略过量,其原因是
=0.6最为适宜,此时(NH4)2SO3略过量,其原因是___ 。

(1)写出溶解过程中发生的氧化还原反应的离子方程式
(2)还原过程中发生的主要反应的离子方程式是
(3)析出的CuCl晶体水洗后要立即用无水乙醇洗涤,在真空干燥机内于70℃干燥2h,冷却密封包装。70℃真空干燥、密封包装的原因是
(4)滤液b中存在的主要物质是
(5)实验室为了加快过滤速率,可以采用抽滤的操作(如图),有关抽滤的说法正确的是

| A.抽滤完毕,应先拆下连接抽气泵和吸滤瓶的橡胶管,再关闭水龙头,最后将滤液从抽滤瓶上口倒出 |
| B.在布氏漏斗中放入滤纸后,直接用倾析法转移溶液和沉淀,再打开水龙头抽滤 |
| C.在抽滤装置中洗涤沉淀时,为减少晶体溶解损失,应将洗涤剂快速通过滤纸 |
| D.减压过滤不宜用于过滤胶状或颗粒太小的沉淀 |
 =0.6最为适宜,此时(NH4)2SO3略过量,其原因是
=0.6最为适宜,此时(NH4)2SO3略过量,其原因是
您最近一年使用:0次
名校
解题方法
5 . 某化学兴趣小组的同学进行Cl2、NH3的制备,性质等实验的流程和部分装置如图:
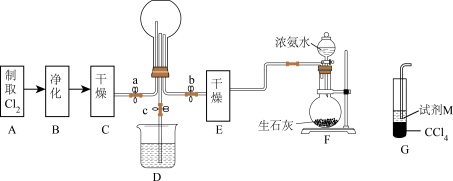
(1)①请利用A、G装置设计一个简单的实验验证Cl2、Fe3+、Br2的氧化性强弱为Cl2>Br2>Fe3+(实验中不断小心振荡G装置中的试管)。请写出A装置中发生反应的离子方程式:____ ,试剂M为____ 溶液,证明氧化性为Cl2>Br2>Fe3+的实验现象是____ 。
②已知3Cl2+2NH3=6HCl+N2,当D装置中的烧瓶充满黄绿色气体后,关闭a、c,打开b,烧瓶中的现象为____ ,反应一段时间后,关闭b打开c,观察到的现象为____ 。
③写出F装置中的发生反应的化学方程式____ 。
(2)某废水中含有一定量的Na+、SO ,可能含有CO
,可能含有CO ,某研究小组欲测定其中SO
,某研究小组欲测定其中SO 的浓度,设计如图实验方案:
的浓度,设计如图实验方案:
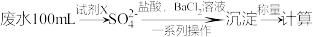
①从下列试剂中选择试剂X为___ (填字母)。
A.0.1mol·L-1KMnO4(H2SO4酸化)溶液 B.0.5mol·L-1NaOH溶液
C.新制氯水 D.H2O2
②方案中“一系列操作”包含的操作名称为____ 。
③证明该废水中是否含有CO 的实验方案为
的实验方案为____ 。

(1)①请利用A、G装置设计一个简单的实验验证Cl2、Fe3+、Br2的氧化性强弱为Cl2>Br2>Fe3+(实验中不断小心振荡G装置中的试管)。请写出A装置中发生反应的离子方程式:
②已知3Cl2+2NH3=6HCl+N2,当D装置中的烧瓶充满黄绿色气体后,关闭a、c,打开b,烧瓶中的现象为
③写出F装置中的发生反应的化学方程式
(2)某废水中含有一定量的Na+、SO
 ,可能含有CO
,可能含有CO ,某研究小组欲测定其中SO
,某研究小组欲测定其中SO 的浓度,设计如图实验方案:
的浓度,设计如图实验方案: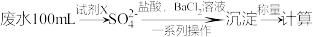
①从下列试剂中选择试剂X为
A.0.1mol·L-1KMnO4(H2SO4酸化)溶液 B.0.5mol·L-1NaOH溶液
C.新制氯水 D.H2O2
②方案中“一系列操作”包含的操作名称为
③证明该废水中是否含有CO
 的实验方案为
的实验方案为
您最近一年使用:0次
名校
解题方法
6 . 如图表示硫元素的化合价与物质类别图。下列有关说法错误的是
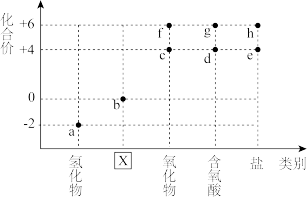

| A.X对应的物质类别是单质 | B.气体a与气体c不能大量共存 |
| C.d溶液久置会生成g,pH减小 | D.e溶液与h溶液不可能发生反应 |
您最近一年使用:0次
2022-04-29更新
|
148次组卷
|
2卷引用:广西南宁市宾阳中学2021-2022学年高一下学期期末考试化学试题
名校
解题方法
7 . 下列溶液在空气中因发生化学反应而质量增大的是
| A.Na2SO3溶液 | B.盐酸 | C.浓硫酸 | D.稀硫酸 |
您最近一年使用:0次
2021-04-21更新
|
200次组卷
|
4卷引用:广西桂林市兴安县第三中学2021-2022学年高一下学期期中考试化学试题
11-12高三上·广西桂林·阶段练习
名校
解题方法
8 . 某学生做如下实验:第一步,在淀粉KI溶液中滴入少量NaClO溶液,并加入少量稀硫酸,溶液立即变蓝:第二步,在上述蓝色溶液中,滴加足量的Na2SO3溶液、蓝色逐渐消失,并检测到有硫酸钠生成。下列叙述中该同学对实验原理的解释和所得结论不正确 的是
A.氧化性:HClO>I2>SO |
| B.若将足量Na2SO3溶液加入氯水中,氯水褪色 |
| C.蓝色消失的原因是Na2SO3溶液具有漂白性 |
| D.淀粉KI溶液变蓝是因为I-被HClO氧化为I2,I2遇淀粉变蓝 |
您最近一年使用:0次
2021-04-12更新
|
547次组卷
|
26卷引用:2012届广西桂林十八中高三上学期第三次月考化学试卷
(已下线)2012届广西桂林十八中高三上学期第三次月考化学试卷广西钦州市2022-2023学年高一上学期第2次教学质量监测化学试卷(已下线)2011-2012学年山东省济宁汶上一中高一下学期3月月考化学试卷(已下线)2013届山东省德州市跃华学校高三12月月考化学试卷(已下线)2012-2013学年江西省南昌市第二中学高一下学期期中考试化学试卷2015届山东省枣庄二中高三元月模拟测试化学试卷2015-2016学年河北省正定中学高一上学期期末化学试卷黑龙江省哈尔滨市122中学2017-2018学年高一上学期期末考试化学试题【全国百强校】黑龙江省哈尔滨市第三中学校2019届高三上学期第一次调研考试化学试题河北省隆化县存瑞中学2019届高三上学期第一次质检化学试题贵州省遵义育新高级中学2018-2019学年高一上学期11月考试化学试题2020年春季人教版高中化学必修1第二章《化学物质及其变化》测试卷(已下线)【新东方】2020--98安徽省怀宁县新安中学2019-2020学年高二下学期期末考试化学试题安徽省合肥市肥东县第二中学2020-2021学年高一上学期期末考试化学试题(已下线)【浙江新东方】【2020】【高一上】【期中】【HD-LP404】【化学】(已下线)【浙江新东方】89.福建省莆田第一中学2020-2021学年高一上学期期末考试化学试题浙江省之江教育评价2020-2021学年高一下学期返校联考化学试题广东省梅州市(梅州、蕉中、虎中)三校2020-2021学年高一下学期4月联考化学试题(已下线)【浙江新东方】在线化学61高一下广东省广州越秀三校2021-2022学年高一下学期期中联考化学试题福建省莆田第四中学2021-2022学年高一上学期期末考试化学试题河南省郑州市第七高级中学2022-2023 学年高一上学期期末考试化学试题广东省汕头市实验学校2022-2023 学年高—下学期第一阶段质量检测化学试题山东省枣庄市第三中学2023-2024学年高一上学期1月期末模拟化学试题
解题方法
9 . 下列离子方程式书写正确的是
A.碳酸钙和盐酸反应: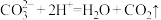 |
B.向稀硝酸中加入少量亚硫酸钠: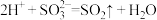 |
C.向 溶液中滴加稀盐酸: 溶液中滴加稀盐酸: |
D.向氯化亚铁溶液中通入氯气: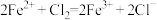 |
您最近一年使用:0次
2021-02-10更新
|
198次组卷
|
3卷引用:广西贵港市2020-2021学年高一上学期期末监测化学试题
10 . 酸雨的危害很大,能直接破坏农作物、腐蚀建筑物,还会危害人体健康。SO2、NOx是形成酸雨的主要物质,研究SO2、NOx等对减少酸雨,改善空气质量具有重要意义。请回答下列问题:
(1)酸雨是指pH_______ 的雨水。
(2)NOx主要来源于汽车尾气。硝酸型酸雨的形成过程中涉及的化学方程式有:① ;②
;②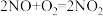 ;③
;③_______ 。
(3)SO2主要是煤、石油等燃烧产生,为减少SO2的排放,可采取下列有效措施:
①在含硫煤中加入生石灰可以起到固硫的作用,燃烧过程中,硫元素转化成其最高价态的化合物,该化合物的化学式是_______ 。
②在一定条件下用CO还原SO2得到单质硫的方法来除去SO2,该反应的化学方程式为_______ 。
③用氨水将SO2转化为NH4HSO3,再氧化成 来脱除烟气中的SO2,原理是
来脱除烟气中的SO2,原理是_______ 、_______ (用离子方程式表示)。
(1)酸雨是指pH
(2)NOx主要来源于汽车尾气。硝酸型酸雨的形成过程中涉及的化学方程式有:①
 ;②
;②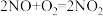 ;③
;③(3)SO2主要是煤、石油等燃烧产生,为减少SO2的排放,可采取下列有效措施:
①在含硫煤中加入生石灰可以起到固硫的作用,燃烧过程中,硫元素转化成其最高价态的化合物,该化合物的化学式是
②在一定条件下用CO还原SO2得到单质硫的方法来除去SO2,该反应的化学方程式为
③用氨水将SO2转化为NH4HSO3,再氧化成
 来脱除烟气中的SO2,原理是
来脱除烟气中的SO2,原理是
您最近一年使用:0次
2021-02-07更新
|
171次组卷
|
2卷引用:广西河池市2020-2021学年高一上学期期末教学质量检测化学试题



