解题方法
1 . 化合物 有助于更好地理解磁性与非常规超导性之间的联系。回答下列问题:
有助于更好地理解磁性与非常规超导性之间的联系。回答下列问题:
(1)Ca2+的焰色试验呈砖红色,金属元素能产生焰色试验的微观原因为____________ 。
(2)与Ni同周期且基态原子最外层电子数相同的Zn元素位于元素周期表的________ 区。
(3)Fe能与CO、 等形成配合物,如
等形成配合物,如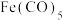 (结构如图1)、
(结构如图1)、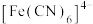 (结构如图2),其中1mol
(结构如图2),其中1mol 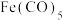 中含有
中含有________ mol配位原子,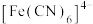 中含有
中含有 键与
键与 键的数目之比为
键的数目之比为_________ 。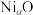 晶体结构为NaCl型,由于晶体存在缺陷,a的值为0.88,且晶体中的Ni分别为
晶体结构为NaCl型,由于晶体存在缺陷,a的值为0.88,且晶体中的Ni分别为 、
、 ,则晶体中
,则晶体中 与
与 的最简整数比为
的最简整数比为________ 。
(5)P与As同主族,磷化硼(BP,结构如图3)是一种超硬耐磨涂层材料,磷化硼晶体属于_________ (填“共价”“离子”或“分子”)晶体,_________ (填“是”或“否”)含有配位键,晶体中P原子的配位数为__________ 。 ,配位数为6的晶体有两种:X和Y。化学式为
,配位数为6的晶体有两种:X和Y。化学式为 的X呈绿色,定量实验表明,1mol X恰好与2mol
的X呈绿色,定量实验表明,1mol X恰好与2mol  反应生成沉淀。Y呈紫色,且1molY恰好与3mol
反应生成沉淀。Y呈紫色,且1molY恰好与3mol  反应生成沉淀,则Y的化学式为
反应生成沉淀,则Y的化学式为___________ 。
 有助于更好地理解磁性与非常规超导性之间的联系。回答下列问题:
有助于更好地理解磁性与非常规超导性之间的联系。回答下列问题:(1)Ca2+的焰色试验呈砖红色,金属元素能产生焰色试验的微观原因为
(2)与Ni同周期且基态原子最外层电子数相同的Zn元素位于元素周期表的
(3)Fe能与CO、
 等形成配合物,如
等形成配合物,如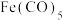 (结构如图1)、
(结构如图1)、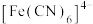 (结构如图2),其中1mol
(结构如图2),其中1mol 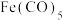 中含有
中含有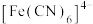 中含有
中含有 键与
键与 键的数目之比为
键的数目之比为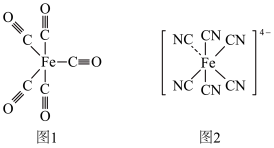
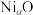 晶体结构为NaCl型,由于晶体存在缺陷,a的值为0.88,且晶体中的Ni分别为
晶体结构为NaCl型,由于晶体存在缺陷,a的值为0.88,且晶体中的Ni分别为 、
、 ,则晶体中
,则晶体中 与
与 的最简整数比为
的最简整数比为(5)P与As同主族,磷化硼(BP,结构如图3)是一种超硬耐磨涂层材料,磷化硼晶体属于

 ,配位数为6的晶体有两种:X和Y。化学式为
,配位数为6的晶体有两种:X和Y。化学式为 的X呈绿色,定量实验表明,1mol X恰好与2mol
的X呈绿色,定量实验表明,1mol X恰好与2mol  反应生成沉淀。Y呈紫色,且1molY恰好与3mol
反应生成沉淀。Y呈紫色,且1molY恰好与3mol  反应生成沉淀,则Y的化学式为
反应生成沉淀,则Y的化学式为
您最近半年使用:0次
名校
解题方法
2 . 我国科学家开发的 催化剂可实现
催化剂可实现 还原制
还原制 ,为资源回收利用提供新思路。请回答下列问题:
,为资源回收利用提供新思路。请回答下列问题:
(1)基态N原子的价层电子的轨道表示式为_______ 。
(2)题述物质所含的第二周期元素中,第一电离能由大到小的顺序为_______ (填元素符号,下同);电负性由小到大的顺序为_______ 。
(3)氨硼烷 是一种新型储氢材料。
是一种新型储氢材料。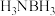 分子中B原子的杂化方式为
分子中B原子的杂化方式为_______ 。
(4)已知: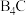 (碳化硼)、
(碳化硼)、 (氮化硼)的熔点依次为
(氮化硼)的熔点依次为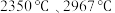 ,这两种物质的熔点存在差异的主要原因是
,这两种物质的熔点存在差异的主要原因是_______ 。
(5)已知 的晶胞结构如图1所示,该晶胞中含有的阳离子数为
的晶胞结构如图1所示,该晶胞中含有的阳离子数为_______ ,阳离子的配位数为_______ 。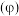 为
为_______ (用含π的式子表示);
②图3中晶胞的空间利用率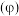 为
为_______ (用含%表示,保留2位有效数字,已知 =3.14,
=3.14, =1.414,
=1.414,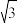 =1.732);
=1.732);
③已知图3中晶胞底边长为 ,高为
,高为 ,
, 代表阿伏加德罗常数的值,则该晶胞的密度为
代表阿伏加德罗常数的值,则该晶胞的密度为_______  (用含
(用含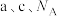 的式子表示)。
的式子表示)。
 催化剂可实现
催化剂可实现 还原制
还原制 ,为资源回收利用提供新思路。请回答下列问题:
,为资源回收利用提供新思路。请回答下列问题:(1)基态N原子的价层电子的轨道表示式为
(2)题述物质所含的第二周期元素中,第一电离能由大到小的顺序为
(3)氨硼烷
 是一种新型储氢材料。
是一种新型储氢材料。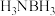 分子中B原子的杂化方式为
分子中B原子的杂化方式为(4)已知:
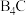 (碳化硼)、
(碳化硼)、 (氮化硼)的熔点依次为
(氮化硼)的熔点依次为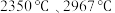 ,这两种物质的熔点存在差异的主要原因是
,这两种物质的熔点存在差异的主要原因是(5)已知
 的晶胞结构如图1所示,该晶胞中含有的阳离子数为
的晶胞结构如图1所示,该晶胞中含有的阳离子数为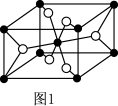
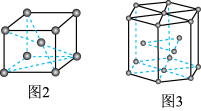
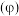 为
为②图3中晶胞的空间利用率
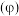 为
为 =3.14,
=3.14, =1.414,
=1.414,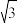 =1.732);
=1.732);③已知图3中晶胞底边长为
 ,高为
,高为 ,
, 代表阿伏加德罗常数的值,则该晶胞的密度为
代表阿伏加德罗常数的值,则该晶胞的密度为 (用含
(用含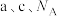 的式子表示)。
的式子表示)。
您最近半年使用:0次
解题方法
3 . 太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置。
Ⅰ.第一代电池的光电转换材料是单晶硅。某单晶硅制备工艺中涉及的主要物质转化如下:________ (填字母)。
a.ⅰ中,C做还原剂 b.碳酸的酸性强于硅酸
c.碳酸的热稳定性弱于硅酸 d.元素的电负性C>Si
(2)ⅱ中,1molSi与3molHCl反应转移4mole-。
①SiHCl3中,H的化合价为________ ,电负性Si________ H(填“>”或“<”)。
②该反应的化学方程式为________ 。
(3)ⅲ中,利用物质沸点差异,可直接实现高纯硅与SiHCl3的分离,从晶体类型角度解释其原因:________ 。
Ⅱ.第二代电池的光电转换材料是一种无机物薄膜,其光电转化率高于单晶硅。
科学家在元素周期表中Si的附近寻找到元素Ga和As(它们在周期表中的位置如图),并制成它们的化合物薄膜,其晶体结构类似单晶硅。
(4)写出基态Ga原子价层电子排布式________ 。
(5)As的第一电离能比Se大的主要原因是:________________ 。
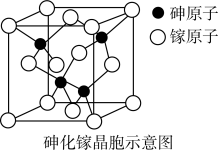
(6)下图为砷化镓晶胞示意图,写出其化学式________ 。
Ⅰ.第一代电池的光电转换材料是单晶硅。某单晶硅制备工艺中涉及的主要物质转化如下:
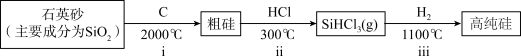
a.ⅰ中,C做还原剂 b.碳酸的酸性强于硅酸
c.碳酸的热稳定性弱于硅酸 d.元素的电负性C>Si
(2)ⅱ中,1molSi与3molHCl反应转移4mole-。
①SiHCl3中,H的化合价为
②该反应的化学方程式为
(3)ⅲ中,利用物质沸点差异,可直接实现高纯硅与SiHCl3的分离,从晶体类型角度解释其原因:
Ⅱ.第二代电池的光电转换材料是一种无机物薄膜,其光电转化率高于单晶硅。
科学家在元素周期表中Si的附近寻找到元素Ga和As(它们在周期表中的位置如图),并制成它们的化合物薄膜,其晶体结构类似单晶硅。
| Si | |||
| Ga | As | Se |
(4)写出基态Ga原子价层电子排布式
(5)As的第一电离能比Se大的主要原因是:
(6)下图为砷化镓晶胞示意图,写出其化学式
您最近半年使用:0次
名校
解题方法
4 . 中医药学认为,雄黄(As4S4),外用可以治疗疥癣恶疮、蛇虫咬伤等;微量内服,可治惊痫、疮毒等症。雄黄遇热易氧化为As2O3(俗称砒霜),虽在古时常用做毒药,但科学家却发现它对治疗白血病有明显的作用。砷的其它化合物也在研究和生产中有着许多重要用途。____ ,核外电子占据的最高能级的电子云轮廓图形状为____ 。
(2)雄黄(As4S4)的结构如上图1所示,As原子的杂化形式为_____ 。
(3)Na3AsO4常用作杀虫剂、防腐剂,它含有的化学键类型包括____ ;AsO43-的空间构型为_____ 。
(4)砷化镓是优良的半导体材料,其晶胞结构如图2所示。立方砷化镓晶体与立方氮化硼晶体结构类似,两种晶体中熔点较高的是____ ;砷化镓密度为 ,Ga和As原子半径分别为r1pm和r2pm,阿伏加德罗常数值为
,Ga和As原子半径分别为r1pm和r2pm,阿伏加德罗常数值为 ,则砷化镓晶体的空间利用率为
,则砷化镓晶体的空间利用率为_____ 。
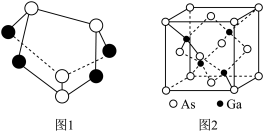
(2)雄黄(As4S4)的结构如上图1所示,As原子的杂化形式为
(3)Na3AsO4常用作杀虫剂、防腐剂,它含有的化学键类型包括
(4)砷化镓是优良的半导体材料,其晶胞结构如图2所示。立方砷化镓晶体与立方氮化硼晶体结构类似,两种晶体中熔点较高的是
 ,Ga和As原子半径分别为r1pm和r2pm,阿伏加德罗常数值为
,Ga和As原子半径分别为r1pm和r2pm,阿伏加德罗常数值为 ,则砷化镓晶体的空间利用率为
,则砷化镓晶体的空间利用率为
您最近半年使用:0次
5 . 铁及其化合物在生产生活中有重要应用。Fe的某种硫化物的晶胞如图所示,该晶胞为立方体,晶胞棱长为a nm。___________ 。
(2)下列说法正确的是___________。
(3)冰、金刚石、 、干冰4种晶体的熔点由高到低的顺序为
、干冰4种晶体的熔点由高到低的顺序为___________ 。
(4)已知阿伏加德罗常数的值为 ,该晶胞密度为
,该晶胞密度为___________ 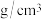 。(列出算式即可)
。(列出算式即可)
(5)在该晶胞中,每个 周围与它最近且等距的
周围与它最近且等距的 有
有___________ 个,下列属于从该晶体结构中分割出的部分结构图的是___________ 。(白球、黑球分别代表题中阴、阳离子)

(2)下列说法正确的是___________。
| A.该晶胞与NaCl晶胞结构相似 |
B.该晶体结构中存在 和 和 |
C. 之间最短距离为 之间最短距离为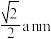 |
| D.该物质中含有离子键、共价键和分子间作用力 |
(3)冰、金刚石、
 、干冰4种晶体的熔点由高到低的顺序为
、干冰4种晶体的熔点由高到低的顺序为(4)已知阿伏加德罗常数的值为
 ,该晶胞密度为
,该晶胞密度为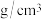 。(列出算式即可)
。(列出算式即可)(5)在该晶胞中,每个
 周围与它最近且等距的
周围与它最近且等距的 有
有
您最近半年使用:0次
解题方法
6 . 氮元素能与金属或者非金属元素形成种类繁多、应用广泛的化合物。
(1)基态N原子的价层电子轨道表示式是___________ 。
(2)与碳氢化合物类似,N、H两元素之间也可以形成氮烷、氮烯。
①在最简单的氮烯分子中,N的杂化方式是___________ 。
② 具有很强的还原性,是常用的火箭推进剂,它在常温常压下为无色液体。判断
具有很强的还原性,是常用的火箭推进剂,它在常温常压下为无色液体。判断 是否溶于水并说明理由
是否溶于水并说明理由___________ 。
(3)配合物 可用作广谱杀菌剂,其中Cu属于
可用作广谱杀菌剂,其中Cu属于___________ 区元素,该配合物中的配位原子是___________ ,配位数是___________ 。
(4) 的某种晶体结构中,原子间均以单键结合,其硬度比金刚石大,原因是
的某种晶体结构中,原子间均以单键结合,其硬度比金刚石大,原因是___________ 。
(5) 和
和 形成的化合物是一种重要的半导体材料。其某种晶胞形状为立方体,边长为
形成的化合物是一种重要的半导体材料。其某种晶胞形状为立方体,边长为 ,结构如图所示。
,结构如图所示。 最近的
最近的 有
有___________ 个。
②已知阿伏加德罗常数为 ,氮化镓(GaN)的摩尔质量为
,氮化镓(GaN)的摩尔质量为 ,该晶体的密度表达式为
,该晶体的密度表达式为___________  (
(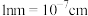 )。
)。
(1)基态N原子的价层电子轨道表示式是
(2)与碳氢化合物类似,N、H两元素之间也可以形成氮烷、氮烯。
①在最简单的氮烯分子中,N的杂化方式是
②
 具有很强的还原性,是常用的火箭推进剂,它在常温常压下为无色液体。判断
具有很强的还原性,是常用的火箭推进剂,它在常温常压下为无色液体。判断 是否溶于水并说明理由
是否溶于水并说明理由(3)配合物
 可用作广谱杀菌剂,其中Cu属于
可用作广谱杀菌剂,其中Cu属于(4)
 的某种晶体结构中,原子间均以单键结合,其硬度比金刚石大,原因是
的某种晶体结构中,原子间均以单键结合,其硬度比金刚石大,原因是(5)
 和
和 形成的化合物是一种重要的半导体材料。其某种晶胞形状为立方体,边长为
形成的化合物是一种重要的半导体材料。其某种晶胞形状为立方体,边长为 ,结构如图所示。
,结构如图所示。
 最近的
最近的 有
有②已知阿伏加德罗常数为
 ,氮化镓(GaN)的摩尔质量为
,氮化镓(GaN)的摩尔质量为 ,该晶体的密度表达式为
,该晶体的密度表达式为 (
( )。
)。
您最近半年使用:0次
23-24高三上·上海浦东新·阶段练习
名校
解题方法
7 . 华为Mate 60 Pro手机于2023年8月底发售,它使用了高性能的国产芯片,体现了我国的芯片技术的飞速发展。
Ⅰ.硅在自然界中有三种稳定的核素,相关信息如下:
(1)硅元素的相对原子量为___________ (保留两位小数),12 g SiO2中29Si的质量为___________ (保留两位小数)。
(2)硅与碳化硅(SiC)均可以作为芯片的材料,比较硅与碳化硅的熔点高低,并说明理由___________ 。
(3)下列能说明碳的非金属大于硅的是___________。
Ⅱ.华为Mate 60 Pro手机利用石墨烯薄片液冷散热系统,是全球最强散热手机系统。石墨烯可以看成单层的石墨,它的结构如下:

(4)在石墨烯晶体中,碳原子所形成的六元环数、碳原子数、C-C键数之比为___________ 。
(5)下列关于石墨烯的说法错误的是___________。
Ⅲ.废弃的手机主板中可以提取出Au、Ag等贵金属。主板中的Ag用硝酸溶解后,过滤得到AgNO3溶液,加入NaCl溶液,过滤,向得到固体的加入氨水,得到无色溶液A,A用水合肼( )还原得到银单质,同时生成一种空气中常见的单质。
)还原得到银单质,同时生成一种空气中常见的单质。
已知:水合肼是一种二元弱碱,其电离常数为: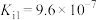 ,
, 。
。
(6)溶液A中含量最高的阳离子的化学式为___________ ,写出水合肼与溶液A反应的离子方程式___________ 。
(7)水合肼在工业上常用作还原剂,广泛用于纳米材料的制备,指出无机制备时水合肼作为还原剂的两个优点___________ 。
(8)写出水合肼一级电离的方程式___________ 。
(9)常温下,向水合肼溶液中加入盐酸,使溶液中的含氮微粒浓度: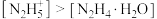 ,需调节的pH范围为
,需调节的pH范围为___________ 。
Ⅰ.硅在自然界中有三种稳定的核素,相关信息如下:
| 核素符号 | 相对原子量 | 丰度(%) |
| 28Si | 27.977 | 92.23 |
| 29Si | 28.976 | 4.67 |
| 30Si | 29.974 | 3.10 |
(2)硅与碳化硅(SiC)均可以作为芯片的材料,比较硅与碳化硅的熔点高低,并说明理由
(3)下列能说明碳的非金属大于硅的是___________。
| A.甲烷的分解温度高于SiH4 | B.碳与SiO2高温下置换出硅 |
| C.二氧化碳通入硅酸钠溶液得到白色沉淀 | D.CH4中氢为+1价,SiH4中氢为-1价 |
Ⅱ.华为Mate 60 Pro手机利用石墨烯薄片液冷散热系统,是全球最强散热手机系统。石墨烯可以看成单层的石墨,它的结构如下:

(4)在石墨烯晶体中,碳原子所形成的六元环数、碳原子数、C-C键数之比为
(5)下列关于石墨烯的说法错误的是___________。
| A.石墨烯是一种多烯烃 |
| B.石墨烯中碳原子与苯环中碳原子杂化类型相同 |
| C.石墨烯与金刚石互为同分异构体 |
| D.石墨烯只存在非极性键 |
Ⅲ.废弃的手机主板中可以提取出Au、Ag等贵金属。主板中的Ag用硝酸溶解后,过滤得到AgNO3溶液,加入NaCl溶液,过滤,向得到固体的加入氨水,得到无色溶液A,A用水合肼(
 )还原得到银单质,同时生成一种空气中常见的单质。
)还原得到银单质,同时生成一种空气中常见的单质。已知:水合肼是一种二元弱碱,其电离常数为:
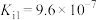 ,
, 。
。(6)溶液A中含量最高的阳离子的化学式为
(7)水合肼在工业上常用作还原剂,广泛用于纳米材料的制备,指出无机制备时水合肼作为还原剂的两个优点
(8)写出水合肼一级电离的方程式
(9)常温下,向水合肼溶液中加入盐酸,使溶液中的含氮微粒浓度:
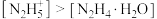 ,需调节的pH范围为
,需调节的pH范围为
您最近半年使用:0次
解题方法
8 . 我国科学家研发的全球首套“液态阳光”项目使双碳目标更近一步。该项目通过太阳能发电电解水制氢,再将CO2加氢合成CH2OH。
(1)太阳能电池板的主要材料为单晶硅。
①单晶硅属于___________ 晶体。
②熔点比较:单晶硅___________ 金刚石。(选填>、<、=)
(2)在催化剂作用下,CO2与H2反应得到CH3OH。
①CO2分子的空间结构为___________ ,在干冰晶体中每个CO2周围等距且紧邻的CO2有___________ 个。

②CH3OH和CO2分子中σ键数目之比为___________ 。
③CH3OH比CO2在水中的溶解度大,这是因为___________ 。
(3)ZrO2催化剂可实现CO2高选择性加氢合成CH3OH,ZrO2晶胞结构如图所示。
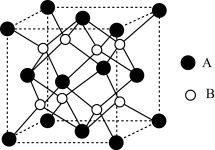
①B代表___________ (填“ ”或“
”或“ ”)。
”)。
②ZrO2晶胞的棱长分别为anm、anm、cnm,其晶体密度为___________  (列算式用
(列算式用 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
(1)太阳能电池板的主要材料为单晶硅。
①单晶硅属于
②熔点比较:单晶硅
(2)在催化剂作用下,CO2与H2反应得到CH3OH。
①CO2分子的空间结构为

②CH3OH和CO2分子中σ键数目之比为
③CH3OH比CO2在水中的溶解度大,这是因为
(3)ZrO2催化剂可实现CO2高选择性加氢合成CH3OH,ZrO2晶胞结构如图所示。

①B代表
 ”或“
”或“ ”)。
”)。②ZrO2晶胞的棱长分别为anm、anm、cnm,其晶体密度为
 (列算式用
(列算式用 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
您最近半年使用:0次
名校
解题方法
9 . 完成下列问题
Ⅰ.氨是重要的化工原料,已知NH3(g)在纯氧中燃烧的能量变化如图。

(1)已知: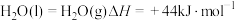 ,则NH3(g)的燃烧热的热化学方程式为
,则NH3(g)的燃烧热的热化学方程式为_______ 。
Ⅱ.火箭推进器中装有肼(N2H4)和过氧化氢。已知下列各物质反应的热化学方程式:
①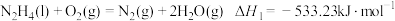
②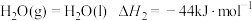
③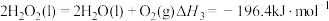
(2)以下选项中,是氮原子激发态的电子排布式,且其中能量较高的是_______ 。(填标号)
a.1s22s22p23s1 b.ls22s22p43d2 c.1s22s12p5 d.1s22s22p13p2
(3)N2H4晶体的晶胞结构_______ (填“是”或者“不”)符合分子密堆积,原因是_______ 。
(4)16g液态联氨与足量过氧化氢反应生成氮气和水蒸气,放出热量为:_______ (保留小数点后一位有效数字)。
(5)在高温下,N2H4可完全分解为NH3、N2及H2,实验测得分解产物中N2与H2的物质的量之比为3∶2,则该分解反应的化学方程式为_______ 。
(6)有以下物质:①碘、②金刚砂、③氨气、④氯化钠、⑤水晶、⑥肼,它们的熔点由高到低的顺序为_______ (用序号表示)。
Ⅰ.氨是重要的化工原料,已知NH3(g)在纯氧中燃烧的能量变化如图。

(1)已知:
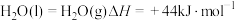 ,则NH3(g)的燃烧热的热化学方程式为
,则NH3(g)的燃烧热的热化学方程式为Ⅱ.火箭推进器中装有肼(N2H4)和过氧化氢。已知下列各物质反应的热化学方程式:
①
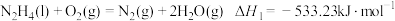
②
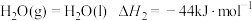
③
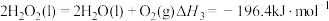
(2)以下选项中,是氮原子激发态的电子排布式,且其中能量较高的是
a.1s22s22p23s1 b.ls22s22p43d2 c.1s22s12p5 d.1s22s22p13p2
(3)N2H4晶体的晶胞结构
(4)16g液态联氨与足量过氧化氢反应生成氮气和水蒸气,放出热量为:
(5)在高温下,N2H4可完全分解为NH3、N2及H2,实验测得分解产物中N2与H2的物质的量之比为3∶2,则该分解反应的化学方程式为
(6)有以下物质:①碘、②金刚砂、③氨气、④氯化钠、⑤水晶、⑥肼,它们的熔点由高到低的顺序为
您最近半年使用:0次
名校
解题方法
10 . 航天领域充斥着新材料的身影——外层的热控保温材料核心成分为石墨烯,太阳能电池板中大量使用氮化镓、砷化镓作为半导体材料。回答下列问题:
(1)石墨烯是通过剥离得到的单层石墨(如图所示),其中的碳原子采取_______ 杂化,12g石墨烯中含有C—C的个数为_______ NA。

(2)氮化镓(GaN)和砷化镓(GaAs)同为第三代半导体材料的代表,两者均为共价晶体。GaN的熔点为1700℃,GaAs的熔点为1238℃,其原因是_______ 。
(3)GaAs的晶胞结构如图所示,已知A原子的分数坐标为 (0,0,0),B原子的分数坐标为( ,
,  ,
,  ),则C原子的分数坐标为
),则C原子的分数坐标为_______ 。每个晶胞中有_______ 个As原子,每个As原子周围等距离且最近的As原子有_______ 个。

(4)已知Ga和As的摩尔质量分别为M1g·mol-1和M2 g·mol-1,原子半径分别为r1pm和r2pm,阿伏加德罗常数值为NA,该晶胞的空间利用率为w,则GaAs晶体的密度为_______ g·cm-3。
(1)石墨烯是通过剥离得到的单层石墨(如图所示),其中的碳原子采取

(2)氮化镓(GaN)和砷化镓(GaAs)同为第三代半导体材料的代表,两者均为共价晶体。GaN的熔点为1700℃,GaAs的熔点为1238℃,其原因是
(3)GaAs的晶胞结构如图所示,已知A原子的分数坐标为 (0,0,0),B原子的分数坐标为(
 ,
,  ,
,  ),则C原子的分数坐标为
),则C原子的分数坐标为
(4)已知Ga和As的摩尔质量分别为M1g·mol-1和M2 g·mol-1,原子半径分别为r1pm和r2pm,阿伏加德罗常数值为NA,该晶胞的空间利用率为w,则GaAs晶体的密度为
您最近半年使用:0次



