名校
1 . 请完成下列填空。
(1)写出下列物质的电子式: :
:________ ,
_________ 。
(2)磷能形成多种具有独特性质的物质。
①磷在元素周期表中的位置_____ 。
②磷能形成红磷、白磷、黑磷等多种单质,它们互为_____ 。
③磷的一种组成为 的盐,能与盐酸反应但不能与NaOH溶液反应,下列有关
的盐,能与盐酸反应但不能与NaOH溶液反应,下列有关 、
、 的分析中正确的是
的分析中正确的是_____ (填字母)。
A. 是酸式盐 B.
是酸式盐 B. 是正盐
是正盐
C.均具有较强的还原性 D. 是三元弱酸
是三元弱酸
(3)实验室制氨气的原理_____ 。
(4)自然界中Cr主要以+3价和+6价形式存在。 中的Cr能引起细胞的突变,在酸性条件下可用亚硫酸钠将
中的Cr能引起细胞的突变,在酸性条件下可用亚硫酸钠将 还原,其离子方程式为
还原,其离子方程式为______ 。
(1)写出下列物质的电子式:
 :
:
(2)磷能形成多种具有独特性质的物质。
①磷在元素周期表中的位置
②磷能形成红磷、白磷、黑磷等多种单质,它们互为
③磷的一种组成为
 的盐,能与盐酸反应但不能与NaOH溶液反应,下列有关
的盐,能与盐酸反应但不能与NaOH溶液反应,下列有关 、
、 的分析中正确的是
的分析中正确的是A.
 是酸式盐 B.
是酸式盐 B. 是正盐
是正盐C.均具有较强的还原性 D.
 是三元弱酸
是三元弱酸(3)实验室制氨气的原理
(4)自然界中Cr主要以+3价和+6价形式存在。
 中的Cr能引起细胞的突变,在酸性条件下可用亚硫酸钠将
中的Cr能引起细胞的突变,在酸性条件下可用亚硫酸钠将 还原,其离子方程式为
还原,其离子方程式为
您最近一年使用:0次
名校
解题方法
2 . 下列反应的化学或离子方程式错误的是
A. 制 制 的离子方程式: 的离子方程式: |
B.白磷与 溶液反应: 溶液反应: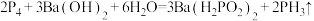 |
C. 与足量的 与足量的 溶液反应的离子方程式: 溶液反应的离子方程式: |
D.雌黄制备雄黄的方程式: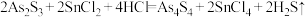 |
您最近一年使用:0次
3 . P2O5常用作气体的干燥剂,易吸水转化为H3PO4。下列说法不正确的是
| A.P2O5中P元素化合价为+5价 | B.P2O5属于碱性氧化物 |
| C.P2O5能与CaO反应 | D.P2O5能与NaOH反应 |
您最近一年使用:0次
4 . 次磷酸钠(NaH2PO2)在食品工业中用作防腐剂、抗氧化剂,也是一种很好的化学镀剂。
(1)NaH2PO2中P的化合价为___________ 价。
(2)将待镀零件浸泡在NiSO4和NaH2PO2的混合溶液中,可达到化学镀镍(在待镀零件表面形成一层金属镍)的目的,该过程中 被氧化为二元弱酸H3PO3,写出该反应的离子方程式
被氧化为二元弱酸H3PO3,写出该反应的离子方程式___________ 。
(3)次磷酸钠的制备
将黄磷(P4)和过量烧碱溶液混合加热,生成NaH2PO2和PH3(气体),PH3与NaClO溶液反应可生成次磷酸(H3PO2),实验装置如图:

①装置A中盛放烧碱溶液的仪器名称为___________ 。
②由装置A中发生化学反应可知,次磷酸(H3PO2)属于___________ 元弱酸。
③装置C中发生反应的化学方程式为___________ 。
④已知相关物质的溶解度如表:
充分反应后,将A、C中溶液混合,再将混合液(含极少量NaOH)加热浓缩,有大量杂质晶体析出,然后___________ (填操作名称),得到含NaH2PO2的溶液,进一步处理得到粗产品。
⑤反应结束后,向装置内通入N2的目的是___________ 。
(4)次磷酸钠的纯度测定
先取1.0g粗产品配成100mL溶液,再取25.00mL所配溶液于锥形瓶中,酸化后加入过量的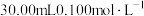 碘水。充分反应后,剩余碘水恰好可消耗
碘水。充分反应后,剩余碘水恰好可消耗 溶液(相关反应方程式为:
溶液(相关反应方程式为: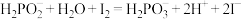 ,
, ),则产品纯度为
),则产品纯度为___________ 。(已知:NaH2PO2相对分子质量为88)
(1)NaH2PO2中P的化合价为
(2)将待镀零件浸泡在NiSO4和NaH2PO2的混合溶液中,可达到化学镀镍(在待镀零件表面形成一层金属镍)的目的,该过程中
 被氧化为二元弱酸H3PO3,写出该反应的离子方程式
被氧化为二元弱酸H3PO3,写出该反应的离子方程式(3)次磷酸钠的制备
将黄磷(P4)和过量烧碱溶液混合加热,生成NaH2PO2和PH3(气体),PH3与NaClO溶液反应可生成次磷酸(H3PO2),实验装置如图:

①装置A中盛放烧碱溶液的仪器名称为
②由装置A中发生化学反应可知,次磷酸(H3PO2)属于
③装置C中发生反应的化学方程式为
④已知相关物质的溶解度如表:
| 25℃ | 100℃ | |
| NaCl | 37g | 39g |
| NaH2PO2 | 100g | 667g |
⑤反应结束后,向装置内通入N2的目的是
(4)次磷酸钠的纯度测定
先取1.0g粗产品配成100mL溶液,再取25.00mL所配溶液于锥形瓶中,酸化后加入过量的
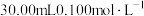 碘水。充分反应后,剩余碘水恰好可消耗
碘水。充分反应后,剩余碘水恰好可消耗 溶液(相关反应方程式为:
溶液(相关反应方程式为: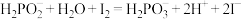 ,
, ),则产品纯度为
),则产品纯度为
您最近一年使用:0次
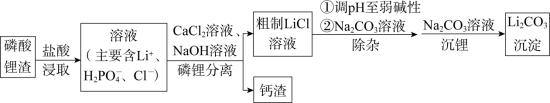
5 . 碳酸锂是制备各种锂化合物的关键原料。一种以磷酸锂渣(主要成分Li3PO4)为原料制备碳酸锂的工艺流程示意图如下。
已知:部分物质的溶解性表(20℃)
(1)写出浸取时Li3PO4与盐酸反应的化学方程式:_______ 。
(2)加入盐酸的量不宜过多的原因是_______ 。
(3)钙渣的主要成分是_______ 。
(4)磷锂分离时,需要不断加入适量NaOH溶液以维持溶液的pH基本不变。结合离子方程式解释其原因是_______ 。
(5)沉锂时,反应的离子方程式是_______ 。

已知:部分物质的溶解性表(20℃)
| 阳离子 | 阴离子 | ||
 |  | 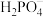 | |
| Li+ | 难溶 | 可溶 | 易溶 |
| Ca2+ | 难溶 | 难溶 | 可溶 |
(2)加入盐酸的量不宜过多的原因是
(3)钙渣的主要成分是
(4)磷锂分离时,需要不断加入适量NaOH溶液以维持溶液的pH基本不变。结合离子方程式解释其原因是
(5)沉锂时,反应的离子方程式是
您最近一年使用:0次
6 .  为正盐,能将溶液中的
为正盐,能将溶液中的 还原为
还原为 ,可用于化学镀银。反应的离子方程式为
,可用于化学镀银。反应的离子方程式为 。下列说法正确的是
。下列说法正确的是
 为正盐,能将溶液中的
为正盐,能将溶液中的 还原为
还原为 ,可用于化学镀银。反应的离子方程式为
,可用于化学镀银。反应的离子方程式为 。下列说法正确的是
。下列说法正确的是A.上述反应中,氧化产物是 |
| B.该反应氧化剂与还原剂的物质的量之比为1∶4 |
C. 中含有离子键、极性共价键和非极性共价键 中含有离子键、极性共价键和非极性共价键 |
D. 是三元酸,与 是三元酸,与 反应可生成三种盐 反应可生成三种盐 |
您最近一年使用:0次
名校
解题方法
7 .  为正盐,其中P为
为正盐,其中P为 价O为
价O为 价,能将溶液中的
价,能将溶液中的 还原为
还原为 ,可用于化学镀银。反应的离子方程式为
,可用于化学镀银。反应的离子方程式为 。下列说法正确的是
。下列说法正确的是
 为正盐,其中P为
为正盐,其中P为 价O为
价O为 价,能将溶液中的
价,能将溶液中的 还原为
还原为 ,可用于化学镀银。反应的离子方程式为
,可用于化学镀银。反应的离子方程式为 。下列说法正确的是
。下列说法正确的是A.上述反应中,氧化产物是 |
| B.该反应氧化剂与还原剂的物质的量之比为1∶4 |
C. 溶于水破坏离子键、极性共价键和非极性共价键 溶于水破坏离子键、极性共价键和非极性共价键 |
D. 是三元酸,与 是三元酸,与 反应可生成三种盐 反应可生成三种盐 |
您最近一年使用:0次
2023-03-23更新
|
204次组卷
|
3卷引用: 山东省青岛第五十八中学2022-2023学年高一下学期3月月考化学试题
名校
8 . 根据物质类别预测物质性质是常用的方法之一,下列预测正确的是
| 选项 | 已知性质 | 性质预测 |
| A | Fe能置换出 溶液中的Cu 溶液中的Cu | Na也能置换出 溶液中的Cu 溶液中的Cu |
| B | 氮气与氧气不容易化合 | 磷单质与氧气也不容易化合 |
| C |  能使澄清石灰水变浑浊 能使澄清石灰水变浑浊 |  也能使澄清石灰水变浑浊 也能使澄清石灰水变浑浊 |
| D |  通入氯化钡溶液,溶液不变浑浊 通入氯化钡溶液,溶液不变浑浊 |  通入硝酸钡溶液,溶液也不变浑浊 通入硝酸钡溶液,溶液也不变浑浊 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-02-18更新
|
222次组卷
|
2卷引用:广东省汕尾市2022-2023学年高一上学期期末考试化学试题
22-23高一·全国·课后作业
解题方法
9 . 某班同学就施用化肥的“利与弊”为题进行辩论,正方观点是施用化肥有利,正方的下列观点中不科学的是
| A.施用化肥可使农作物增产 |
| B.化肥的肥效快 |
| C.施用化肥不会造成环境污染 |
| D.复合肥能给农作物提供几种营养元素 |
您最近一年使用:0次
2023-01-31更新
|
363次组卷
|
4卷引用:8.2 化学品的合理使用——同步学习必备知识
(已下线)8.2 化学品的合理使用——同步学习必备知识化学与可持续发展——课时3化肥、农药的合理施用(已下线)8.2.1 化肥、农药的合理施用和合理用药8.2.1化肥、农药的合理施用 合理用药 随堂练习
名校
10 . I、高铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,它的氧化性比高锰酸钾、次氯酸等还强。工业上制取高铁酸钠的化学方程式是(未配平):Fe(NO3)3+ NaOH + Cl2→ Na2FeO4+ NaNO3+ NaCl + H2O
(1)高铁酸钠中,铁元素的化合价是_______ ;上述制取铁酸钠的反应中,铁元素被_______ (填“还原”或“氧化”)。
(2)高铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂原因铁元素转化为Fe(OH)3胶体。用饱和氯化铁溶液制备Fe(OH)3胶体方法_______ 。
(3)电子工业常用30%的FeCl3溶液腐蚀覆在绝缘板上的铜箔,制造印刷电路板。
①少量的铜可以完全溶解在FeCl3溶液中,所发生反应的离子方程式为_______ 。
②除去FeCl3溶液中混有的FeCl2可加入或通入_______ 。
A、硝酸 B、稀硫酸 C、氯气 D、氢氧化钠
II、次磷酸(H3PO2)是一种精细磷化工产品,是一元中强酸,具有较强还原性。回答下列问题:
(4)H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银。
①利用H3PO2进行化学镀银反应中,氧化剂(Ag+)与还原剂(H3PO2)的物质的量之比为4∶1,则氧化产物为_______ (填化学式)。
②从分类来看,NaH2PO2属于_______ 。
a.正盐 b.酸式盐 c.钠盐 d.氧化物
(5)H3PO2的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应。配平白磷与Ba(OH)2溶液反应的化学方程式_______ 。
_______P4 +_______Ba(OH)2 + _______H2O —— _______Ba(H2PO2)2+_______PH3↑
(1)高铁酸钠中,铁元素的化合价是
(2)高铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂原因铁元素转化为Fe(OH)3胶体。用饱和氯化铁溶液制备Fe(OH)3胶体方法
(3)电子工业常用30%的FeCl3溶液腐蚀覆在绝缘板上的铜箔,制造印刷电路板。
①少量的铜可以完全溶解在FeCl3溶液中,所发生反应的离子方程式为
②除去FeCl3溶液中混有的FeCl2可加入或通入
A、硝酸 B、稀硫酸 C、氯气 D、氢氧化钠
II、次磷酸(H3PO2)是一种精细磷化工产品,是一元中强酸,具有较强还原性。回答下列问题:
(4)H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银。
①利用H3PO2进行化学镀银反应中,氧化剂(Ag+)与还原剂(H3PO2)的物质的量之比为4∶1,则氧化产物为
②从分类来看,NaH2PO2属于
a.正盐 b.酸式盐 c.钠盐 d.氧化物
(5)H3PO2的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应。配平白磷与Ba(OH)2溶液反应的化学方程式
_______P4 +_______Ba(OH)2 + _______H2O —— _______Ba(H2PO2)2+_______PH3↑
您最近一年使用:0次
2022-10-31更新
|
145次组卷
|
2卷引用:湖南省邵阳市第二中学2021-2022学年高一上学期第一次月考化学试题



