名校
解题方法
1 . 一定条件下, 与
与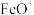 反应合成
反应合成 的反应历程如图所示。已知其他条件不变时,反应物中的元素被质量数更大的同位素替换时,反应速率会变慢。说明:过渡态中“- -”表示化学键未完全断裂或形成。下列说法正确的是
的反应历程如图所示。已知其他条件不变时,反应物中的元素被质量数更大的同位素替换时,反应速率会变慢。说明:过渡态中“- -”表示化学键未完全断裂或形成。下列说法正确的是
 与
与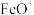 反应合成
反应合成 的反应历程如图所示。已知其他条件不变时,反应物中的元素被质量数更大的同位素替换时,反应速率会变慢。说明:过渡态中“- -”表示化学键未完全断裂或形成。下列说法正确的是
的反应历程如图所示。已知其他条件不变时,反应物中的元素被质量数更大的同位素替换时,反应速率会变慢。说明:过渡态中“- -”表示化学键未完全断裂或形成。下列说法正确的是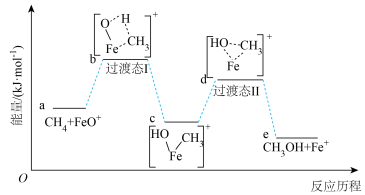
| A.反应历程中的两个反应均涉及氢原子的成键 |
B.相同条件下, 与 与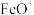 发生上述反应,则其过渡态 发生上述反应,则其过渡态 的能量比 的能量比 高 高 |
C.该反应的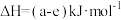 |
D.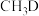 与 与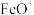 发生上述反应,只能获得1种相对分子质量的有机产物 发生上述反应,只能获得1种相对分子质量的有机产物 |
您最近一年使用:0次
昨日更新
|
51次组卷
|
4卷引用:化学(天津卷02)-2024年高考化学押题预测卷
(已下线)化学(天津卷02)-2024年高考化学押题预测卷广东省2024届高三下学期二模考试化学试题贵州省贵阳市清华中学2024届高三下5月模拟预测考前考(二)化学试题江苏省无锡市锡东高级中学2023-2024学年高二下学期5月月考化学试题
名校
2 . 下列方程式不能准确解释相应实验现象的是
A.MnO2和浓盐酸共热产生黄绿色气体:MnO2+4H++2Cl- Mn2++Cl2↑+2H2O Mn2++Cl2↑+2H2O |
| B.二氧化硫通入硝酸钡溶液中,产生白色沉淀:SO2+Ba2++H2O=BaSO3↓+2H+ |
| C.用FeCl3溶液清洗银镜:Fe3++Ag+Cl-=Fe2++AgCl |
D.[Cu(H2O)4]2+(aq)(蓝色)+4Cl-(ag)=[CuCl4]2-(ag)(黄色)+4H2O(l)  H>0,升温,溶液变为黄绿色 H>0,升温,溶液变为黄绿色 |
您最近一年使用:0次
昨日更新
|
86次组卷
|
2卷引用:天津市新华中学2024届高三下学期统练11化学 试题
名校
3 . 硫脲 在药物制备、金属矿物浮选等方面有广泛应用。实验室中先制备
在药物制备、金属矿物浮选等方面有广泛应用。实验室中先制备 ,然后
,然后 再与CaCN2合成
再与CaCN2合成 ,实验装置(夹持及加热装置略)如图所示。
,实验装置(夹持及加热装置略)如图所示。 易溶于水,易被氧化,受热时部分发生异构化生成NH4SCN。
易溶于水,易被氧化,受热时部分发生异构化生成NH4SCN。
回答下列问题:
(1)实验前先检查装置气密性,操作为:①在E中加水至浸没导管末端,……;②微热A处三颈烧瓶,观察到E处导管末端有气泡冒出,移走酒精灯;③一段时间后,E处导管末端形成一段水柱,且高度不变。将操作①补充完整_______ 。
(2)检查气密性后加入药品,装置A中的试剂最佳组合是_______ (填字母),打开K2。
A.FeS固体+浓硫酸 B.FeS固体+稀硝酸 C.FeS固体+稀盐酸
装置B中盛装的试剂为_______ 。待A中反应结束后关闭K2,打开K1通N2一段时间,目的是_______ 。
(3)撤走搅拌器,打开K3,水浴加热D处三颈烧瓶,在80℃时合成硫脲,同时生成一种常见的碱。控制温度在80℃的原因是_______ ,D处合成硫脲的化学方程式为_______ 。
(4)将装置D中液体过滤后,结晶得到粗产品。测定粗产品中硫脲纯度:称取mg产品,加水溶解配成500mL溶液,量取25mL于锥形瓶中,滴加一定量的稀硫酸使溶液显酸性,用cmol⋅L-1KMnO4标准溶液滴定,滴定至终点时消耗KMnO4标准溶液VmL。
①硫脲 中硫元素的化合价为
中硫元素的化合价为_______ 价。
②滴定时,硫脲转化为CO2、N2、 的离子方程式为
的离子方程式为_______ 。
③样品中硫脲的质量分数为_______ (用含“m,c、V”的式子表示)。
 在药物制备、金属矿物浮选等方面有广泛应用。实验室中先制备
在药物制备、金属矿物浮选等方面有广泛应用。实验室中先制备 ,然后
,然后 再与CaCN2合成
再与CaCN2合成 ,实验装置(夹持及加热装置略)如图所示。
,实验装置(夹持及加热装置略)如图所示。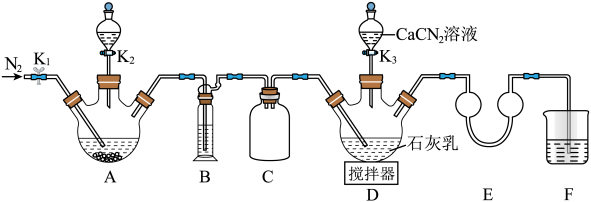
 易溶于水,易被氧化,受热时部分发生异构化生成NH4SCN。
易溶于水,易被氧化,受热时部分发生异构化生成NH4SCN。回答下列问题:
(1)实验前先检查装置气密性,操作为:①在E中加水至浸没导管末端,……;②微热A处三颈烧瓶,观察到E处导管末端有气泡冒出,移走酒精灯;③一段时间后,E处导管末端形成一段水柱,且高度不变。将操作①补充完整
(2)检查气密性后加入药品,装置A中的试剂最佳组合是
A.FeS固体+浓硫酸 B.FeS固体+稀硝酸 C.FeS固体+稀盐酸
装置B中盛装的试剂为
(3)撤走搅拌器,打开K3,水浴加热D处三颈烧瓶,在80℃时合成硫脲,同时生成一种常见的碱。控制温度在80℃的原因是
(4)将装置D中液体过滤后,结晶得到粗产品。测定粗产品中硫脲纯度:称取mg产品,加水溶解配成500mL溶液,量取25mL于锥形瓶中,滴加一定量的稀硫酸使溶液显酸性,用cmol⋅L-1KMnO4标准溶液滴定,滴定至终点时消耗KMnO4标准溶液VmL。
①硫脲
 中硫元素的化合价为
中硫元素的化合价为②滴定时,硫脲转化为CO2、N2、
 的离子方程式为
的离子方程式为③样品中硫脲的质量分数为
您最近一年使用:0次
名校
4 . 硫酸亚铁是重要的化工原料
Ⅰ.
(1)由 溶液制备硫酸亚铁晶体的方法是
溶液制备硫酸亚铁晶体的方法是___________ 。检验晶体中 是否完全变质,将晶体溶于水,加
是否完全变质,将晶体溶于水,加___________ (填试剂)。
(2) 溶液与过量的
溶液与过量的 溶液混合,可以得到含
溶液混合,可以得到含 的浊液,离子方程式是
的浊液,离子方程式是___________ 。
Ⅱ.氧化铁黄(FeOOH)是一种黄色颜料,具有非常好的耐光性和耐碱性,是氧化铁的一水合物。以 为原料制备FeOOH的流程如下:
为原料制备FeOOH的流程如下:
(3)若在实验室完成上述制备,不需要使用的仪器是___________ 。 时段,pH快速下降的原因是反应生成了FeOOH和
时段,pH快速下降的原因是反应生成了FeOOH和 ,该反应的化学方程式为
,该反应的化学方程式为___________ 。
② 时段,经历的反应为
时段,经历的反应为 ,该过程pH继续平缓下降的原因可能是
,该过程pH继续平缓下降的原因可能是___________ 。
(5)判断流程中产品洗涤干净的方法是___________ 。
(6)氧化铁黄(FeOOH)纯度可以通过产品的耗酸量确定,如下图所示。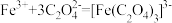 ,
,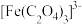 不与稀碱液反应。
不与稀碱液反应。
①在溶液c中滴加NaOH标准溶液,使用的指示剂为___________ 。
②若实验时加入了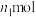 的
的 ,消耗
,消耗 ,设氧化铁黄的摩尔质量为
,设氧化铁黄的摩尔质量为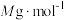 ,则氧化铁黄样品纯度为
,则氧化铁黄样品纯度为___________ (用含w、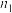 、
、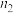 、M的代数式表示)。
、M的代数式表示)。
③测定时,若滴入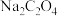 不足量,会使实验结果
不足量,会使实验结果___________ (选填“偏大”“偏小”或“无影响”)。
Ⅰ.
(1)由
 溶液制备硫酸亚铁晶体的方法是
溶液制备硫酸亚铁晶体的方法是 是否完全变质,将晶体溶于水,加
是否完全变质,将晶体溶于水,加(2)
 溶液与过量的
溶液与过量的 溶液混合,可以得到含
溶液混合,可以得到含 的浊液,离子方程式是
的浊液,离子方程式是Ⅱ.氧化铁黄(FeOOH)是一种黄色颜料,具有非常好的耐光性和耐碱性,是氧化铁的一水合物。以
 为原料制备FeOOH的流程如下:
为原料制备FeOOH的流程如下: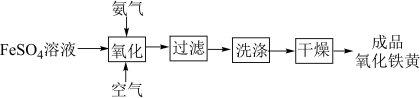
(3)若在实验室完成上述制备,不需要使用的仪器是
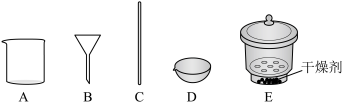
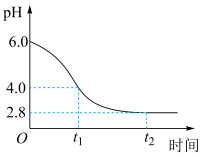
 时段,pH快速下降的原因是反应生成了FeOOH和
时段,pH快速下降的原因是反应生成了FeOOH和 ,该反应的化学方程式为
,该反应的化学方程式为②
 时段,经历的反应为
时段,经历的反应为 ,该过程pH继续平缓下降的原因可能是
,该过程pH继续平缓下降的原因可能是(5)判断流程中产品洗涤干净的方法是
(6)氧化铁黄(FeOOH)纯度可以通过产品的耗酸量确定,如下图所示。
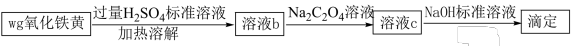
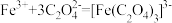 ,
,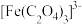 不与稀碱液反应。
不与稀碱液反应。①在溶液c中滴加NaOH标准溶液,使用的指示剂为
②若实验时加入了
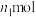 的
的 ,消耗
,消耗 ,设氧化铁黄的摩尔质量为
,设氧化铁黄的摩尔质量为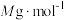 ,则氧化铁黄样品纯度为
,则氧化铁黄样品纯度为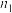 、
、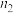 、M的代数式表示)。
、M的代数式表示)。③测定时,若滴入
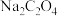 不足量,会使实验结果
不足量,会使实验结果
您最近一年使用:0次
名校
解题方法
5 . 铁元素在人体健康和新材料研发中有重要的应用。
I.在血液中,以 为中心的配位化合物铁卟啉是血红蛋白的重要组成部分,可用于输送
为中心的配位化合物铁卟啉是血红蛋白的重要组成部分,可用于输送 。图为载氧后的血红蛋白分子示意图。
。图为载氧后的血红蛋白分子示意图。___________ 。
(2)载氧时,血红蛋白分子中 脱去配位的
脱去配位的 并与
并与 配位;若人体吸入CO,则CO占据配位点,血红蛋白失去携氧功能。由此推测,与
配位;若人体吸入CO,则CO占据配位点,血红蛋白失去携氧功能。由此推测,与 配位能力最强的是
配位能力最强的是___________ (填字母)。
a. b.
b. c.CO
c.CO
(3)一种最简单的卟啉环结构如图。___________ 。
②比较C和N的电负性大小,并从原子结构角度说明理由:___________ 。
③该卟啉分子在酸性环境中配位能力会减弱,原因是___________ 。
Ⅱ. 可用于制备优良铁磁体材料。下图是一种铁磁体化合物的立方晶胞,其边长为apm。
可用于制备优良铁磁体材料。下图是一种铁磁体化合物的立方晶胞,其边长为apm。 ,阿伏伽德罗常数的值为
,阿伏伽德罗常数的值为 。
。
(4)该晶体的密度是___________  。
。
(5)距离F最近的Cs的个数为___________ 。
Ⅲ.磷酸铁锂-石墨电池的总反应: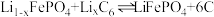 (
(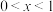 )。
)。
(6)放电时负极的电极反应式是___________ 。
I.在血液中,以
 为中心的配位化合物铁卟啉是血红蛋白的重要组成部分,可用于输送
为中心的配位化合物铁卟啉是血红蛋白的重要组成部分,可用于输送 。图为载氧后的血红蛋白分子示意图。
。图为载氧后的血红蛋白分子示意图。
(2)载氧时,血红蛋白分子中
 脱去配位的
脱去配位的 并与
并与 配位;若人体吸入CO,则CO占据配位点,血红蛋白失去携氧功能。由此推测,与
配位;若人体吸入CO,则CO占据配位点,血红蛋白失去携氧功能。由此推测,与 配位能力最强的是
配位能力最强的是a.
 b.
b. c.CO
c.CO(3)一种最简单的卟啉环结构如图。
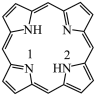
②比较C和N的电负性大小,并从原子结构角度说明理由:
③该卟啉分子在酸性环境中配位能力会减弱,原因是
Ⅱ.
 可用于制备优良铁磁体材料。下图是一种铁磁体化合物的立方晶胞,其边长为apm。
可用于制备优良铁磁体材料。下图是一种铁磁体化合物的立方晶胞,其边长为apm。
 ,阿伏伽德罗常数的值为
,阿伏伽德罗常数的值为 。
。(4)该晶体的密度是
 。
。(5)距离F最近的Cs的个数为
Ⅲ.磷酸铁锂-石墨电池的总反应:
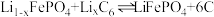 (
( )。
)。(6)放电时负极的电极反应式是
您最近一年使用:0次
解题方法
6 . 碲 被誉为尖端技术等工业的维生素。工业上常以粗铜精炼的阳极泥(主要成分是
被誉为尖端技术等工业的维生素。工业上常以粗铜精炼的阳极泥(主要成分是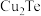 ,含
,含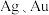 等杂质)为原料提取碲并回收金属,其工艺流程如下图所示:
等杂质)为原料提取碲并回收金属,其工艺流程如下图所示: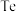 与S同一主族,比S原子多2个电子层;
与S同一主族,比S原子多2个电子层;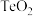 是两性氧化物,微溶于水。请按要求回答下列问题:
是两性氧化物,微溶于水。请按要求回答下列问题:
(1)碲在元素周期表中的位置_______ ;其最高价氧化物对应的水化物化学式为_______ 。
(2)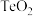 与稀
与稀 反应的离子方程式为
反应的离子方程式为_______ 。
(3)步骤①中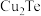 发生了(填“氧化”或“还原”或“非氧化还原”)
发生了(填“氧化”或“还原”或“非氧化还原”)_______ 反应;此过程控制 不宜过低的原因是
不宜过低的原因是_______ ;“加压”的目的是_______ 。
(4)步骤②当温度过高时,会导致碲的浸出率降低,原因是_______ 。为提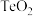 等滤渣酸浸速率,除适当升温外,还可采取的措施是
等滤渣酸浸速率,除适当升温外,还可采取的措施是_______ (写出1条)。
(5)步骤③铜从(填“阳”或“阴”)_______ 极得到。写出步骤④的离子方程式:_______ 。
(6)常温下,往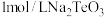 溶液中滴加盐酸,当溶液
溶液中滴加盐酸,当溶液 时,溶液中
时,溶液中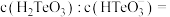
_______ (已知: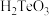 的
的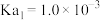 ,
,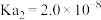 )。
)。
 被誉为尖端技术等工业的维生素。工业上常以粗铜精炼的阳极泥(主要成分是
被誉为尖端技术等工业的维生素。工业上常以粗铜精炼的阳极泥(主要成分是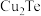 ,含
,含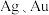 等杂质)为原料提取碲并回收金属,其工艺流程如下图所示:
等杂质)为原料提取碲并回收金属,其工艺流程如下图所示:
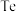 与S同一主族,比S原子多2个电子层;
与S同一主族,比S原子多2个电子层;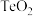 是两性氧化物,微溶于水。请按要求回答下列问题:
是两性氧化物,微溶于水。请按要求回答下列问题:(1)碲在元素周期表中的位置
(2)
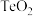 与稀
与稀 反应的离子方程式为
反应的离子方程式为(3)步骤①中
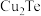 发生了(填“氧化”或“还原”或“非氧化还原”)
发生了(填“氧化”或“还原”或“非氧化还原”) 不宜过低的原因是
不宜过低的原因是(4)步骤②当温度过高时,会导致碲的浸出率降低,原因是
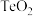 等滤渣酸浸速率,除适当升温外,还可采取的措施是
等滤渣酸浸速率,除适当升温外,还可采取的措施是(5)步骤③铜从(填“阳”或“阴”)
(6)常温下,往
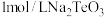 溶液中滴加盐酸,当溶液
溶液中滴加盐酸,当溶液 时,溶液中
时,溶液中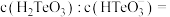
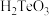 的
的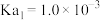 ,
,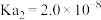 )。
)。
您最近一年使用:0次
名校
7 . 利用丙炔和苯甲醛研究碘代化合物与苯甲醛在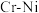 催化下可以发生偶联反应和合成重要的高分子化合物Y的路线如下
催化下可以发生偶联反应和合成重要的高分子化合物Y的路线如下
(1)A的化学名称为___________ 。
(2)B中含氧官能团的名称是___________
(3)X的分子式为___________ 。
(4)反应①的反应类型是___________ 。
(5)反应②的化学方程式是___________ 。
(6)L是D的同分异构体,属于芳香族化合物,与D具有相同官能团,其核磁共振氢谱为5组峰,峰面积比为3:2:2:2:1,则L的结构简式可能为___________ 。
(7)多环化合物是有机研究的重要方向,请设计由 、
、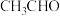 、
、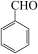 合成多环化合物
合成多环化合物 的路线(无机试剂任选)
的路线(无机试剂任选)___________ 。
 催化下可以发生偶联反应和合成重要的高分子化合物Y的路线如下
催化下可以发生偶联反应和合成重要的高分子化合物Y的路线如下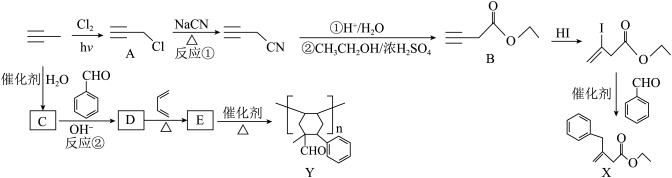
已知:①R1CHO+R2CH2CHO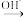
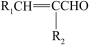 +H2O
+H2O
②
(1)A的化学名称为
(2)B中含氧官能团的名称是
(3)X的分子式为
(4)反应①的反应类型是
(5)反应②的化学方程式是
(6)L是D的同分异构体,属于芳香族化合物,与D具有相同官能团,其核磁共振氢谱为5组峰,峰面积比为3:2:2:2:1,则L的结构简式可能为
(7)多环化合物是有机研究的重要方向,请设计由
 、
、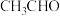 、
、 合成多环化合物
合成多环化合物 的路线(无机试剂任选)
的路线(无机试剂任选)
您最近一年使用:0次
名校
解题方法
8 . 工业上制备高纯硅,一般需要先制得98%左右的粗硅,再以粗硅为原料制备高纯硅,工艺流程如下:工业上还以粗硅为原料采用熔融盐电解法制取甲硅烷(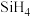 ),电解装置如图所示:
),电解装置如图所示:
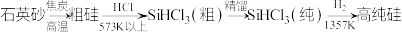
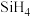 ),电解装置如图所示:
),电解装置如图所示: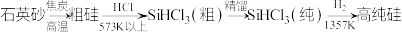

A.制备粗硅的化学方程式: |
B.制备高纯硅的工艺中可循环使用的物质只有 |
C.阴极发生的电极反应: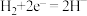 |
D.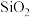 、 、 、 、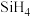 都属于共价晶体 都属于共价晶体 |
您最近一年使用:0次
名校
9 . 化学与人类的生活密切相关,下列叙述错误 的是
| A.食品中添加适量的二氧化硫可以起到漂白、防腐和抗氧化等作用。 |
| B.阿司匹林是一种合成药物,具有解热镇痛作用 |
| C.亚硝酸钠是一种防腐剂和护色剂,可以用于一些肉制品如腊肠、香肠等的生产 |
| D.碳酸钠可用做抗酸药剂 |
您最近一年使用:0次
名校
10 . 化学在人类发展中起着非常重要的作用,下列对化学家贡献描述错误 的是
| A.英国化学家波义耳1661年提出元素的概念,标志着近代化学的诞生 |
| B.法国化学家拉瓦锡1774年提出燃烧的氧化学说,使近代化学取得了革命性的进展 |
| C.英国科学家波尔1803年提出原子学说,为近代化学的发展奠定了坚实的基础 |
| D.意大利科学家阿伏加德罗1811年提出分子学说,使人们对物质结构的认识发展到一个新的阶段 |
您最近一年使用:0次



