名校
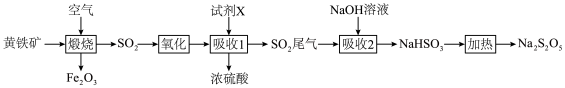
1 . 以黄铁矿(主要成分FeS2)为原料生产硫酸,并把尾气进行资源化综合利用,生产常用作食品漂白剂的焦亚硫酸钠(Na2S2O5),流程如下图所示。
(1)Na2S2O5中S的化合价为___________ 。
(2)煅烧前,黄铁矿需要研磨,目的是___________ 。
(3)煅烧黄铁矿的化学方程式是___________ 。
(4)试剂X是___________ 。
(5)Na2S2O5易被氧化生成Na2SO4而变质,选用下列试剂设计实验方案,检验焦亚硫酸钠样品氧化变质的程度。
限选试剂:稀盐酸、稀 、稀
、稀 、
、 溶液、酸性
溶液、酸性 溶液、
溶液、 溶液
溶液
(6) 可用作食品的抗氧化剂。在测定某葡萄酒中
可用作食品的抗氧化剂。在测定某葡萄酒中 残留量时,取
残留量时,取 葡萄酒样品,用
葡萄酒样品,用 的碘标准液滴定至终点,消耗
的碘标准液滴定至终点,消耗 。滴定反应的离子方程式为
。滴定反应的离子方程式为 ,该样品中
,该样品中 的残留量为
的残留量为___________ 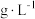 。(
。( 的相对分子质量为190)
的相对分子质量为190)
(1)Na2S2O5中S的化合价为
(2)煅烧前,黄铁矿需要研磨,目的是
(3)煅烧黄铁矿的化学方程式是
(4)试剂X是
(5)Na2S2O5易被氧化生成Na2SO4而变质,选用下列试剂设计实验方案,检验焦亚硫酸钠样品氧化变质的程度。
限选试剂:稀盐酸、稀
 、稀
、稀 、
、 溶液、酸性
溶液、酸性 溶液、
溶液、 溶液
溶液| 实验步骤 | 现象 | 结论 | |
 | 取少量样品,加入除氧蒸馏水 | 固体完全溶解得到无色溶液 | |
 | 取实验 的溶液,① 的溶液,① | 最终有白色沉淀生成 | 样品已被氧化 |
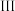 | 另取实验 的溶液,② 的溶液,② | ③ | 样品未完全变质 |
(6)
 可用作食品的抗氧化剂。在测定某葡萄酒中
可用作食品的抗氧化剂。在测定某葡萄酒中 残留量时,取
残留量时,取 葡萄酒样品,用
葡萄酒样品,用 的碘标准液滴定至终点,消耗
的碘标准液滴定至终点,消耗 。滴定反应的离子方程式为
。滴定反应的离子方程式为 ,该样品中
,该样品中 的残留量为
的残留量为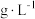 。(
。( 的相对分子质量为190)
的相对分子质量为190)
您最近一年使用:0次
名校
2 . 下列生产或实验事实引出的相应结论正确的是
| 选项 | 事实 | 结论 |
| A | 在容积可变的密闭容器中发生反应:2NH3(g) N2H4 (g)+H2 (g),把容器体积缩小一半 N2H4 (g)+H2 (g),把容器体积缩小一半 | 正反应速率加快,逆反应速率也加快 |
| B | 将少量Na2S2O3样品溶于水,滴入过量的稀硝酸后,再滴入BaCl2溶液,有白色沉淀产生 | 说明Na2S2O3已变质 |
| C | 向盛有某溶液的试管中滴加稀NaOH溶液,将湿润的红色石蕊试纸置于试管口,试纸不变蓝 | 与氨溶液中无铵根离子 |
| D | 向鸡蛋清溶液中滴加饱和硫酸铵溶液,振荡,有固体析出 | 硫酸铵溶液能使蛋白质变性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
3 . 过氧化钙(CaO2)广泛应用于水产养殖、污水处理,是优良的供氧剂。
实验探究一:过氧化钙与水反应除生成氧气外,还生成什么物质?
(1)进行实验:取适量过氧化钙放入试管中加适量水,向试管中滴加酚酞溶液,液体变成红色,说明生成了Ca(OH)2,写出该反应的化学方程式:______________ 。
(2)此供氧剂长期暴露在空气中,会变质生成CaCO3,为检验此供氧剂是否变质,可向其中加入稀盐酸,若观察到有气泡生成,则判断此供氧剂已变质。有同学不认同上述方案的理由是_______________________ 。
实验探究二:测定久置过氧化钙纯度。
方案一:通过测定产生氧气的体积,最终计算出供氧剂中过氧化钙的含量。
(3)取一定质量的供氧剂溶于水,按照图1装置进行装配。读出体积时要注意:①该反应为放热反应,待气体恢复至室温再读数;②____________________________ ;③视线和凹液面最低处保持水平再读数。
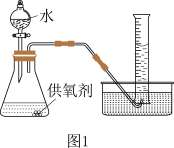
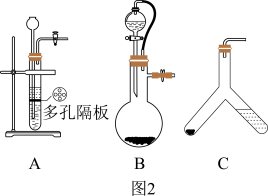
(4)用此装置测得的含量会偏大,原因是________________ ,为了避免此误差可将发生装置换成图2中的装置B或C。
方案二:把样品中的过氧化钙转化为碳酸钙,通过测定碳酸钙沉淀的质量,根据钙元素守恒,求得过氧化钙的质量,具体流程如图3。
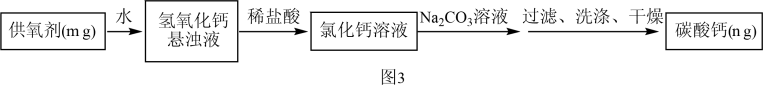
(5)滴加的Na2CO3溶液要过量的原因是_________________________ 。
实验探究一:过氧化钙与水反应除生成氧气外,还生成什么物质?
(1)进行实验:取适量过氧化钙放入试管中加适量水,向试管中滴加酚酞溶液,液体变成红色,说明生成了Ca(OH)2,写出该反应的化学方程式:
(2)此供氧剂长期暴露在空气中,会变质生成CaCO3,为检验此供氧剂是否变质,可向其中加入稀盐酸,若观察到有气泡生成,则判断此供氧剂已变质。有同学不认同上述方案的理由是
实验探究二:测定久置过氧化钙纯度。
方案一:通过测定产生氧气的体积,最终计算出供氧剂中过氧化钙的含量。
(3)取一定质量的供氧剂溶于水,按照图1装置进行装配。读出体积时要注意:①该反应为放热反应,待气体恢复至室温再读数;②

(4)用此装置测得的含量会偏大,原因是

方案二:把样品中的过氧化钙转化为碳酸钙,通过测定碳酸钙沉淀的质量,根据钙元素守恒,求得过氧化钙的质量,具体流程如图3。

(5)滴加的Na2CO3溶液要过量的原因是
您最近一年使用:0次
2023-08-17更新
|
397次组卷
|
2卷引用:广东省珠海市斗门区第一中学2023-2024学年高三上学期阶段性考试化学试题
名校
解题方法
4 . 以硫铁矿(主要成分为FeS2,还有少量CuS、SiO2等杂质)为原料制备绿矾晶体FeSO4•7H2O的工艺流程如图:______ 。
(2)由滤液得到绿矾晶体的操作是______ 、______ 、过滤、洗涤、干燥。
(3)烟气中的SO2会污染环境,可用足量氨水吸收,写出该反应的离子方程式______ 。
(4)铁粉还原过滤,滤渣中除了铁和铜外还有的成分是______ (写化学式)。
(5)燃料细菌脱硫法是用氧化亚铁硫杆菌对硫铁矿进行催化脱硫,同时得到FeSO4溶液。其过程如图所示: +15Fe2++16H+。写出过程Ⅱ反应的离子方程式
+15Fe2++16H+。写出过程Ⅱ反应的离子方程式______ 。
(6)绿矾晶体在空气中易被氧化变质。取xg样品,加水完全溶解,滴加硫酸酸化的amol/LK2Cr2O7溶液至恰好完全反应,消耗K2Cr2O7溶液bmL。反应原理:6Fe2++Cr2O +14H+=6Fe3++2Cr3++7H2O。则绿矾晶体纯度的计算式为
+14H+=6Fe3++2Cr3++7H2O。则绿矾晶体纯度的计算式为______ 。
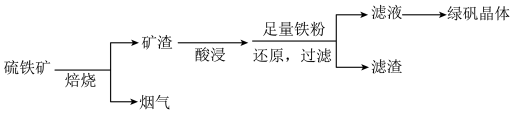
(2)由滤液得到绿矾晶体的操作是
(3)烟气中的SO2会污染环境,可用足量氨水吸收,写出该反应的离子方程式
(4)铁粉还原过滤,滤渣中除了铁和铜外还有的成分是
(5)燃料细菌脱硫法是用氧化亚铁硫杆菌对硫铁矿进行催化脱硫,同时得到FeSO4溶液。其过程如图所示:

 +15Fe2++16H+。写出过程Ⅱ反应的离子方程式
+15Fe2++16H+。写出过程Ⅱ反应的离子方程式(6)绿矾晶体在空气中易被氧化变质。取xg样品,加水完全溶解,滴加硫酸酸化的amol/LK2Cr2O7溶液至恰好完全反应,消耗K2Cr2O7溶液bmL。反应原理:6Fe2++Cr2O
 +14H+=6Fe3++2Cr3++7H2O。则绿矾晶体纯度的计算式为
+14H+=6Fe3++2Cr3++7H2O。则绿矾晶体纯度的计算式为
您最近一年使用:0次
2023-05-21更新
|
197次组卷
|
2卷引用:广东省东莞市东华高级中学东华松山湖高级中学2022-2023学年高一下学期5月期中考试化学试题
5 . 为探究某食品包装袋内一小包脱氧剂中的还原铁粉是否变质,分别取少量样品溶于盐酸,再进行下列实验,其中结论正确的是
| A.若滴加KSCN溶液,溶液变红,说明铁粉变质 |
| B.若滴加KSCN溶液,溶液未变红,说明铁粉未变质 |
| C.若依次滴加氯水,KSCN溶液,溶液变红,说明铁粉全部变质 |
| D.若滴加KSCN溶液,溶液未变红;再滴加氯水,溶液变红,说明铁粉全部变质 |
您最近一年使用:0次
2022-02-27更新
|
1458次组卷
|
24卷引用:广东省化州市第一中学2020-2021学年高一上学期期末考试化学试题
广东省化州市第一中学2020-2021学年高一上学期期末考试化学试题广东省广州中学2022-2023学年高一上学期期末考试化学试题广东省东莞市南城开心实验学校2022-2023学年高一上学期12月半月考化学试题天津市红桥区2020-2021学年高三上学期期中考试化学试题第一节 铁及其化合物 第2课时 铁盐、亚铁盐内蒙古包头市2021-2022学年高一上学期期末考试化学试题辽宁省沈阳市2021-2022学年高一上学期期末质量监测化学试题2北京市北京师范大学第二附属中学2022-2023学年高一上学期12月月考化学试题湖南省株洲世纪星高级中学2022-2023学年高一上学期期末考试化学试题天津市南开中学2022-2023学年高一上学期期末考试化学试题吉林市田家炳高级中学2022-2023学年高一上学期期末考试化学试题内蒙古赤峰市红山区2022-2023学年高一上学期期末质量检测化学试题内蒙古包头市2022-2023学年高一上学期期末考试化学试题内蒙古呼伦贝尔市满洲里市第一中学2022-2023学年高一下学期第一次月考化学试题四川省绵阳南山中学2022-2023学年高一上学期期末模拟化学试题湖南省长沙市珺琟高级中学2023-2024学年高一上学期第二次月考化学试题 四川省宜宾市第四中学校2023-2024学年高一上学期1月期末化学试题云南省昆明市五华区2023-2024学年高一上学期1月期末化学试题天津市静海区第一中学2023-2024学年高一上学期12月月考化学试题浙江省丽水市三校联考2023-2024学年高一上学期12月月考化学试题四川省江油市太白中学2023-2024学年高一上学期第三次月考化学试题湖南省常德石门一中2023-2024年上学期高一年级化学期末考试卷(适用湖南地区))湖南省长沙市长郡中学2023-2024学年高一下学期选科适应性检测化学试卷河南省开封市联考2023-2024学年高一上学期1月期末化学试题
解题方法
6 . 下列有关实验的描述正确的是
| A.向碘化钠稀溶液中加入新制氯水立即生成大量紫黑色固体 |
| B.中和热测定时环形玻璃搅拌棒要不断顺时针搅拌,目的是为了混合均匀,充分反应 |
| C.将Fe(NO3)2样品溶于稀硫酸后,滴加KSCN溶液,变红,说明样品变质 |
| D.向分别装有1g Na2CO3和NaHCO3固体的试管中滴入几滴水,温度高的为Na2CO3 |
您最近一年使用:0次
名校
7 . 过氧化钠保存不当容易变质,某课外活动小组为了粗略测定样品中过氧化钠的质量分数,他们称取 样品,并设计用如图装置来测定过氧化钠的质量分数。
样品,并设计用如图装置来测定过氧化钠的质量分数。
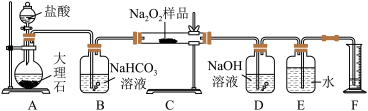
上图中的 和
和 构成量气装置,用来测定
构成量气装置,用来测定 的体积。
的体积。
(1)写出以下装置中发生反应的化学方程式。
装置 :
:_____ 。装置 :
:_______ 。装置 :
:_________ 。
(2) 中
中 溶液的作用是
溶液的作用是_________ 。
(3)为准确读出氧气的体积需进行以下操作,正确的顺序为________ 。
A.调整量筒高度,使广口瓶 与量筒
与量筒 内液面相平
内液面相平
B.将气体冷却至室温
C.平视,使凹液面最低点与视线水平相切再读数
 样品,并设计用如图装置来测定过氧化钠的质量分数。
样品,并设计用如图装置来测定过氧化钠的质量分数。
上图中的
 和
和 构成量气装置,用来测定
构成量气装置,用来测定 的体积。
的体积。(1)写出以下装置中发生反应的化学方程式。
装置
 :
: :
: :
:(2)
 中
中 溶液的作用是
溶液的作用是(3)为准确读出氧气的体积需进行以下操作,正确的顺序为
A.调整量筒高度,使广口瓶
 与量筒
与量筒 内液面相平
内液面相平B.将气体冷却至室温
C.平视,使凹液面最低点与视线水平相切再读数
您最近一年使用:0次
2020-09-04更新
|
551次组卷
|
5卷引用:广东省华南师范大学附属中学2020-2021学年高一上学期期中考试化学试题
广东省华南师范大学附属中学2020-2021学年高一上学期期中考试化学试题人教版(2019)高一必修第一册第二章 海水中的重要元素 第一节 钠及其化合物 课时2 钠的几种化合物 焰色试验(已下线)第13单元 化学实验基本操作(A卷 基础过关检测)-2021年高考化学一轮复习单元滚动双测卷河北省石家庄市第二十四中学2020-2021学年高一上学期期中考试化学试题2(已下线)3.2.1 钠的性质与制备-2021-2022学年高一化学课后培优练(苏教版2019必修第一册)
名校
解题方法
8 . 为探究H2O2、SO2、Br2的性质,某小组同学设计如下实验(夹持及尾气处理装置已略去,气密性已检验)。

(1)在滴入浓硫酸之前要通入N2一段时间的目的是__________________________ 。
(2)该实验可以证明SO2具有_________ 性;H2O2的氧化性_________ Br2(填“强于”“弱于”)。
(3)B中红棕色褪去的原因_______________________________ ,B中重新变成红棕色的原因____________________________________ (均用离子方程式表示)。
(4)C中产生的白色沉淀是______ 。
(5)甲同学通过C中产生白色沉淀,得出结论:SO2能与BaCl2反应产生沉淀。乙同学认为不能得出此结论,并对实验进行了改进:在B和C之间增加盛放_________ 的洗气瓶。再次进行实验时,则C中未产生沉淀。
(6)为进一步研究SO2的性质,分别用煮沸和未煮沸过的蒸馏水配制Ba(NO3)2和BaCl2溶液,进行如下实验:
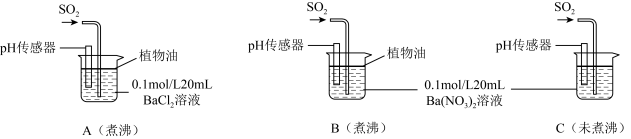
①实验A中,没有观察到白色沉淀,但pH传感器显示溶液呈酸性,原因是__________________ 。(用化学方程式表示)
②实验C中出现白色沉淀比实验B快很多。由此得出的结论是__________________ 。若实验B、C中通入足量的SO2后,溶液酸性:B_________ C(填“强于”“弱于”“等于”)。
(7)Na2SO3固体因贮放不慎发生变质。现取样品1.8克溶于水得溶液A,在A中加入足量BaCl2溶液,过滤得沉淀B,将沉淀B加入足量的稀硫酸后,沉淀不仅不消失,反而增加了0.16g(假如沉淀完全转化)。样品中Na2SO3的质量分数是___________________ 。

| 实验操作 | 实验现象 |
| i.打开弹簧夹,通入N2一段时间,关闭弹簧夹,打开A中分液漏斗活塞,滴加浓硫酸 | A中有气泡产生,B中红棕色溴水褪色,C中有白色沉淀 |
| ⅱ.取C中沉淀加入盐酸 | C中白色沉淀不溶解 |
| ⅲ.打开B中分液漏斗活塞,逐滴滴加H2O2 | 开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色 |
(2)该实验可以证明SO2具有
(3)B中红棕色褪去的原因
(4)C中产生的白色沉淀是
(5)甲同学通过C中产生白色沉淀,得出结论:SO2能与BaCl2反应产生沉淀。乙同学认为不能得出此结论,并对实验进行了改进:在B和C之间增加盛放
(6)为进一步研究SO2的性质,分别用煮沸和未煮沸过的蒸馏水配制Ba(NO3)2和BaCl2溶液,进行如下实验:

①实验A中,没有观察到白色沉淀,但pH传感器显示溶液呈酸性,原因是
②实验C中出现白色沉淀比实验B快很多。由此得出的结论是
(7)Na2SO3固体因贮放不慎发生变质。现取样品1.8克溶于水得溶液A,在A中加入足量BaCl2溶液,过滤得沉淀B,将沉淀B加入足量的稀硫酸后,沉淀不仅不消失,反而增加了0.16g(假如沉淀完全转化)。样品中Na2SO3的质量分数是
您最近一年使用:0次
2020-01-18更新
|
649次组卷
|
3卷引用:广东省汕头市金山中学2019-2020学年高一上学期期末考试化学试题
解题方法
9 . 铁和氯是高中阶段重要的化学元素,请阅读下列信息,回答问题:
Ⅰ.绘制价类图(化合价-物质类别)是学习元素化合物性质的重要方法,如图是铁元素的价类二维图。
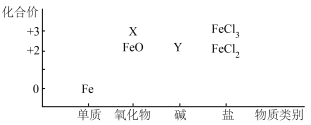
请回答下列问题:
(1)X、Y的化学式分别为___________ 、___________ 。
(2)FeO属于___________ (填“酸性”或“碱性”)氧化物,能与___________ (填试剂名称)反应生成FeCl2;从铁元素的价态分析,FeO与具有强氧化性的硝酸发生反应的氧化产物是___________ (填化学式)。
(3)FeCl3溶液能与铜片、NaOH溶液、KI溶液和KSCN溶液等发生反应,写出其中一个能体现Fe3+的氧化性的离子方程式___________ 。
Ⅱ.某品牌“84”消毒液包装上的说明如下图:
回答下列问题:
(4)该消毒液与洁厕灵同时使用会产生氯气,写出反应的离子方程式___________ 。
(5)理论上,一瓶上述“84”消毒液能从空气中吸收标准状况下___________ LCO2而变质(保留1位小数)。(已知:NaClO+CO2+H2O=NaHCO3+HClO)
Ⅰ.绘制价类图(化合价-物质类别)是学习元素化合物性质的重要方法,如图是铁元素的价类二维图。

请回答下列问题:
(1)X、Y的化学式分别为
(2)FeO属于
(3)FeCl3溶液能与铜片、NaOH溶液、KI溶液和KSCN溶液等发生反应,写出其中一个能体现Fe3+的氧化性的离子方程式
Ⅱ.某品牌“84”消毒液包装上的说明如下图:
| 84消毒液 有效成分:NaClO 规格:1000mL 质量分数:14.9% 物质的量浓度:2.2mol/L | 注意事项: 1.本品对棉织品有漂白脱色作用,有腐蚀性。 2.密封保存,请勿与洁厕灵同时使用。 3.保质期为一年。 |
(4)该消毒液与洁厕灵同时使用会产生氯气,写出反应的离子方程式
(5)理论上,一瓶上述“84”消毒液能从空气中吸收标准状况下
您最近一年使用:0次
名校
10 . I.神舟十九号载人航天飞船运载火箭用偏二甲肼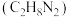 作燃料,四氧化二氮
作燃料,四氧化二氮 作推进剂,点燃后两者反应生成3种常见无污染物质。已知:常温下,
作推进剂,点燃后两者反应生成3种常见无污染物质。已知:常温下, 为无色液体,易溶于水;
为无色液体,易溶于水; 有剧毒,熔点为
有剧毒,熔点为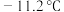 ,沸点为21.2℃,设NA为阿伏伽德罗常数的值。
,沸点为21.2℃,设NA为阿伏伽德罗常数的值。
(1)写出 和
和 发生反应的化学方程式:
发生反应的化学方程式:___________ 。
(2)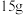
 中含有的N原子数为
中含有的N原子数为________ ,与_______ g 中含有的N原子数相同。
中含有的N原子数相同。
(3)将 a%的
a%的 水溶液跟
水溶液跟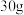 b%的
b%的 水溶液混合,得到的溶液密度为
水溶液混合,得到的溶液密度为 ,设
,设 的摩尔质量为
的摩尔质量为 ,则混合后溶液的物质的量浓度为
,则混合后溶液的物质的量浓度为___________ 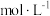 (用含字母的式子表示)。
(用含字母的式子表示)。
Ⅱ.化学工业为医疗等提供了强有力的物质支撑。氯的许多化合物既是重要化工原料,又是高效、广谱的灭菌消毒剂。某同学购买了一瓶“84”消毒液,部分标签如图所示。
净含量:1000 mL 密度:1.19 g·cm-3主要成分:25%NaClO
注意事项:密封保存,易吸收空气中的CO2变质,稀释100倍(体积比)后使用,回答下列问题:
(4)该同学取100 mL该“84”消毒液稀释后用于消毒(假设稀释后溶液密度为1 g·cm-3),稀释后的溶液中c(Na+)=___________ mol·L-1(保留一位有效数字)。
(5)“84”消毒液的稀溶液在浸泡餐具过程中,因吸收空气中 使消毒杀菌能力增强,产物中有小苏打,请用离子方程式说明原因:
使消毒杀菌能力增强,产物中有小苏打,请用离子方程式说明原因:___________ 。一瓶“84”消毒液最多能吸收空气中___________ L CO2(标准状况下)。
(6)该同学参阅“84”消毒液的配方,欲用NaClO固体配制480 mL 0.2 mol·L-1的消毒液。
①需要的仪器有托盘天平、烧杯、玻璃棒、量筒、______ 。
②需要用托盘天平称量的NaClO固体质量为______ g。
③下列关于容量瓶的使用操作,正确的是______ 。 反应可制得一种在生产生活中常用于漂白、消毒的物质,同时有
反应可制得一种在生产生活中常用于漂白、消毒的物质,同时有 生成,该反应的化学方程式是
生成,该反应的化学方程式是________ 。
(8)下列操作可能导致所配溶液浓度偏低的是______ (填字母)。
A.移液时,未洗涤烧杯和玻璃棒B.溶解后未经冷却就移液
C.移液时,有少量液体溅出D.定容时,俯视刻度线
E.容量瓶用蒸馏水洗净后,没烘干就直接使用
(9)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。NaClO的有效氯含量为______ (计算结果保留两位小数)。
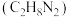 作燃料,四氧化二氮
作燃料,四氧化二氮 作推进剂,点燃后两者反应生成3种常见无污染物质。已知:常温下,
作推进剂,点燃后两者反应生成3种常见无污染物质。已知:常温下, 为无色液体,易溶于水;
为无色液体,易溶于水; 有剧毒,熔点为
有剧毒,熔点为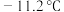 ,沸点为21.2℃,设NA为阿伏伽德罗常数的值。
,沸点为21.2℃,设NA为阿伏伽德罗常数的值。(1)写出
 和
和 发生反应的化学方程式:
发生反应的化学方程式:(2)
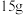
 中含有的N原子数为
中含有的N原子数为 中含有的N原子数相同。
中含有的N原子数相同。(3)将
 a%的
a%的 水溶液跟
水溶液跟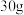 b%的
b%的 水溶液混合,得到的溶液密度为
水溶液混合,得到的溶液密度为 ,设
,设 的摩尔质量为
的摩尔质量为 ,则混合后溶液的物质的量浓度为
,则混合后溶液的物质的量浓度为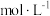 (用含字母的式子表示)。
(用含字母的式子表示)。Ⅱ.化学工业为医疗等提供了强有力的物质支撑。氯的许多化合物既是重要化工原料,又是高效、广谱的灭菌消毒剂。某同学购买了一瓶“84”消毒液,部分标签如图所示。
净含量:1000 mL 密度:1.19 g·cm-3主要成分:25%NaClO
注意事项:密封保存,易吸收空气中的CO2变质,稀释100倍(体积比)后使用,回答下列问题:
(4)该同学取100 mL该“84”消毒液稀释后用于消毒(假设稀释后溶液密度为1 g·cm-3),稀释后的溶液中c(Na+)=
(5)“84”消毒液的稀溶液在浸泡餐具过程中,因吸收空气中
 使消毒杀菌能力增强,产物中有小苏打,请用离子方程式说明原因:
使消毒杀菌能力增强,产物中有小苏打,请用离子方程式说明原因:(6)该同学参阅“84”消毒液的配方,欲用NaClO固体配制480 mL 0.2 mol·L-1的消毒液。
①需要的仪器有托盘天平、烧杯、玻璃棒、量筒、
②需要用托盘天平称量的NaClO固体质量为
③下列关于容量瓶的使用操作,正确的是
A. B.
B. C.
C. D.
D.
 反应可制得一种在生产生活中常用于漂白、消毒的物质,同时有
反应可制得一种在生产生活中常用于漂白、消毒的物质,同时有 生成,该反应的化学方程式是
生成,该反应的化学方程式是(8)下列操作可能导致所配溶液浓度偏低的是
A.移液时,未洗涤烧杯和玻璃棒B.溶解后未经冷却就移液
C.移液时,有少量液体溅出D.定容时,俯视刻度线
E.容量瓶用蒸馏水洗净后,没烘干就直接使用
(9)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。NaClO的有效氯含量为
您最近一年使用:0次



