1 . 某同学做同主族元素性质相似性、递变性实验时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验方案”与“实验现象”前后不一定是对应关系)。
请你帮助该同学整理并完成实验报告。
(1)实验目的:________________ 。
(2)实验用品:
①实验试剂:金属钠、金属钾、新制氯水、溴水、0.1mol·L-1溴化钠溶液、0.1 mol·L-1碘化钠溶液、四氯化碳。
②实验仪器:________ 、________ 、________ 、镊子、小刀、玻璃片等。
(3)实验内容(填写与实验方案对应的实验现象的标号和化学方程式):
(4)实验结论:____________________ 。
实验步骤 | 实验现象 |
| ①将氯水滴加到NaBr溶液中,振荡后再加入适量CCl4,振荡,静置 | A、浮在水面上,熔成小球,不定向移动,随之消失 |
| ②将一小块金属钠放入到冷水中 | B、分层,上层无色,下层紫红色 |
| ③将溴水滴加到NaI溶液中,振荡后再加入适量 CCl4,振荡,静置 | C、浮在水面上,熔成小球,不定向移动,并伴有轻微的爆炸声,很快消失 |
| ④将一小块金属钾放入冷水中 | D、分层,上层无色,下层棕红色 |
(1)实验目的:
(2)实验用品:
①实验试剂:金属钠、金属钾、新制氯水、溴水、0.1mol·L-1溴化钠溶液、0.1 mol·L-1碘化钠溶液、四氯化碳。
②实验仪器:
(3)实验内容(填写与实验方案对应的实验现象的标号和化学方程式):
| 实验方案 | 实验现象 | 化学方程式 |
| ① | ||
| ② | ||
| ③ | ||
| ④ |
您最近一年使用:0次
2019-04-24更新
|
84次组卷
|
2卷引用:广西靖西市第二中学2019-2020学年高二下学期开学考试化学试题
名校
2 . I.生产生活中的化学反应都伴随着能量的变化,请根据有关知识回答下列问题:
(1)冷敷袋在日常生活中有降温、保鲜和镇痛等用途。制作冷敷袋可以利用___________ (填“放热”或“吸热”)的化学变化或物理变化。
(2)“即热饭盒”给人们生活带来方便,它可利用下面___________(填字母)反应释放的热量加热食物。
II.研究含碳、氮的物质间转化的热效应,在日常生活与工业生产中均有很重要的意义。
(3)已知:H2O(l)= H2O(g) △H= +44.0kJ·mol-1,甲烷完全燃烧与不完全燃烧的热效应如下图所示。
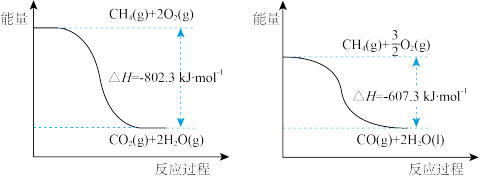
①写出表示甲烷燃烧热的热化学方程式:_____________________________ 。
②CO的燃烧热△H=_______ kJ·mol-1。
(4)以NH3、CO2为原料生产尿素[CONH2)2]的反应历程与能量变化示意图如下。
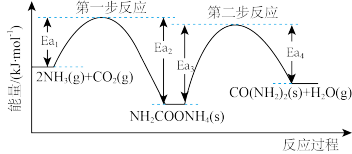
①第一步反应的热化学方程式为_______ 。
②第二步反应的△H_______ 0(填“>”、“<”或“=”)。
③从图象分析决定生产尿素的总反应的反应速率的步骤是第_______ 步反应。
(1)冷敷袋在日常生活中有降温、保鲜和镇痛等用途。制作冷敷袋可以利用
(2)“即热饭盒”给人们生活带来方便,它可利用下面___________(填字母)反应释放的热量加热食物。
| A.生石灰和水 | B.浓硫酸和水 | C.纯碱和水 | D.食盐和白醋 |
II.研究含碳、氮的物质间转化的热效应,在日常生活与工业生产中均有很重要的意义。
(3)已知:H2O(l)= H2O(g) △H= +44.0kJ·mol-1,甲烷完全燃烧与不完全燃烧的热效应如下图所示。

①写出表示甲烷燃烧热的热化学方程式:
②CO的燃烧热△H=
(4)以NH3、CO2为原料生产尿素[CONH2)2]的反应历程与能量变化示意图如下。

①第一步反应的热化学方程式为
②第二步反应的△H
③从图象分析决定生产尿素的总反应的反应速率的步骤是第
您最近一年使用:0次
3 . 餐厨垃圾在酶的作用下可获得乙醇,进一步反应可制备有机物C和高分子材料G,转化关系如下:
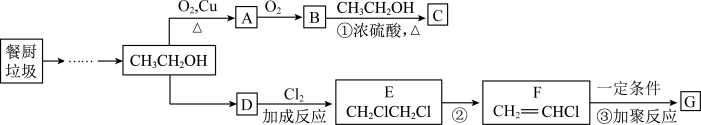
(1)乙醇的官能团的名称是___________ ,写出A的结构简式___________ ,请列举D物质的一种用途___________ ;
(2)反应①的反应类型是___________ ,化学方程式为___________ ;
(3)实验室制备C物质的装置如图,试管a中加入三种液体试剂的顺序为___________ ,实验结束时试管 中观察到
中观察到___________ 、滴加酚酞的饱和 溶液红色变浅,并可以闻到香味;
溶液红色变浅,并可以闻到香味;

(4)下列说法中,不正确的是___________ ;
a.D、E、F均属于烃
b.甲烷中含有D物质,不能用酸性高锰酸钾溶液除去
c.CH3CH2OH与CH3OCH3互为同分异构体
d.F、G均能使溴水发生化学反应而褪色
(5)请写出反应③的化学方程式___________ 。

(1)乙醇的官能团的名称是
(2)反应①的反应类型是
(3)实验室制备C物质的装置如图,试管a中加入三种液体试剂的顺序为
 中观察到
中观察到 溶液红色变浅,并可以闻到香味;
溶液红色变浅,并可以闻到香味;
(4)下列说法中,不正确的是
a.D、E、F均属于烃
b.甲烷中含有D物质,不能用酸性高锰酸钾溶液除去
c.CH3CH2OH与CH3OCH3互为同分异构体
d.F、G均能使溴水发生化学反应而褪色
(5)请写出反应③的化学方程式
您最近一年使用:0次
2023-07-17更新
|
191次组卷
|
2卷引用:广西百色市2022-2023学年高一下学期期末考试化学试题
解题方法
4 . 硫及其化合物有许多用途,请回答下列问题。
(1)基态硫原子的价电子排布式为_______ ,其电子占据最高能级的电子云轮廓图形状为_______ 。
(2)P、S的第二电离能(I2)的大小关系为I2(P)_____ I2(S) (填“>”“=”或“<”),原因是_____ 。
(3)一水合硫酸四氨合铜(II) [Cu(NH3)4]SO4·H2O常用作杀虫剂,该配合物中阴离子的中心原子采取的杂化方式为_______ ,NH3的立体构型为_______ ,H2O的VSEPR模型名称为_______ 。
(4)常见含硫的物质有单质硫(S8)、SO2、 Na2S、 K2S 等,四种物质的熔点最高的是_______ 。
(5)高纯度的PbS可作半导体,PbS的立方晶胞如图所示,硫离子采取面心立方堆积,铅离子填在由硫离子形成的正四面体空隙中。已知该晶胞参数为apm,则该晶体的密度为_______ g·cm-3 (用含a、NA的代数式表示)。

(1)基态硫原子的价电子排布式为
(2)P、S的第二电离能(I2)的大小关系为I2(P)
(3)一水合硫酸四氨合铜(II) [Cu(NH3)4]SO4·H2O常用作杀虫剂,该配合物中阴离子的中心原子采取的杂化方式为
(4)常见含硫的物质有单质硫(S8)、SO2、 Na2S、 K2S 等,四种物质的熔点最高的是
(5)高纯度的PbS可作半导体,PbS的立方晶胞如图所示,硫离子采取面心立方堆积,铅离子填在由硫离子形成的正四面体空隙中。已知该晶胞参数为apm,则该晶体的密度为

您最近一年使用:0次
5 . 已知物质A是营养物质之一,米饭、馒头中都富含A,A在酸性条件下水解的最终产物是B,C是白酒的主要成分,G的产量是衡量一个国家石油化工发展水平的标志,H是一种高分子材料。有关物质的转化关系如下图所示,请回答下列问题:
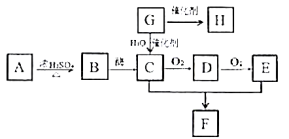
(1)写出G所含的官能团名称___________ ,B的分子式为___________ 。
(2)检验B常用的试剂是___________ ,反应的现象为___________ 。
(3)C与E反应生成F的条件是___________ ,该反应的类型是___________ 。
(4)写出C→D的化学反应方程是___________ 。
(5)下列说法正确的是___________ (填标号)。
A.G能使高锰酸钾和溴水褪色,但褪色原理不同
B. E与足量的金属钠反应,生成
E与足量的金属钠反应,生成 H。
H。
C.用碳酸钠溶液能鉴别C、E和F
D.H是聚合物,其制品在现代生活中用途广泛

(1)写出G所含的官能团名称
(2)检验B常用的试剂是
(3)C与E反应生成F的条件是
(4)写出C→D的化学反应方程是
(5)下列说法正确的是
A.G能使高锰酸钾和溴水褪色,但褪色原理不同
B.
 E与足量的金属钠反应,生成
E与足量的金属钠反应,生成 H。
H。C.用碳酸钠溶液能鉴别C、E和F
D.H是聚合物,其制品在现代生活中用途广泛
您最近一年使用:0次
6 . 短周期元素X、Y、Z、M的原子序数依次增大,元素X的一种高硬度单质可作为装饰品,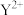 电子层结构与氖原子相同,Z的质子数为偶数,室温下M的单质为淡黄色固体。
电子层结构与氖原子相同,Z的质子数为偶数,室温下M的单质为淡黄色固体。
回答下列问题:
(1)X元素位于周期表中位置的为___________ 。
(2)Z元素在自然界中常见的二元化合物是___________ (填化学符号,下同),该化合物的用途及其广泛,请列举出一种___________ 。
(3)Y和M的简单离子半径大小的关系是___________ ;Y单质可用于航空航天合金材料的制备,该单质与X的最高价氧化物在点燃条件下发生反应的化学方程式为____ 。
(4)Z的氢化物的化学键类型为___________ ,X元素和Z元素的最简单氢化物的稳定性由强到弱的关系是___________ 。
(5)核电荷数数比M多1的元素构成的单质气体呈___________ 色,写出利用 制备该气体的离子方程式
制备该气体的离子方程式___________ 。
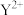 电子层结构与氖原子相同,Z的质子数为偶数,室温下M的单质为淡黄色固体。
电子层结构与氖原子相同,Z的质子数为偶数,室温下M的单质为淡黄色固体。回答下列问题:
(1)X元素位于周期表中位置的为
(2)Z元素在自然界中常见的二元化合物是
(3)Y和M的简单离子半径大小的关系是
(4)Z的氢化物的化学键类型为
(5)核电荷数数比M多1的元素构成的单质气体呈
 制备该气体的离子方程式
制备该气体的离子方程式
您最近一年使用:0次
7 . 已知:A为淡黄色固体,T、R为两种常见的用途很广的金属单质,D是具有磁性的黑色晶体,H是白色沉淀,W溶液中加入KSCN溶液出现血红色。各物质之间的转化关系如下图所示,请回答下列问题:
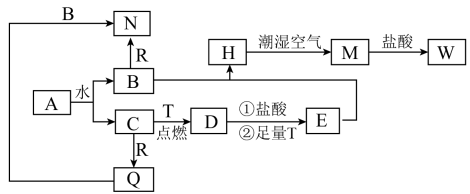
(1)写出化学式:A____________ ,D____________ ,R________________ ;
(2)W溶液中加入KSCN溶液出现血红色,说明W溶液中含有________ 离子(用离子符号表示)。
(3)H→M的过程中,可能观察到的现象为______________________________ 。
(4)写出A→B+C的化学方程式_________________________________ ;在C与R反应中,当有20.4gQ物质生成时,转移电子__________ mol。
(5)D→E过程中②的离子方程式__________________________ 。

(1)写出化学式:A
(2)W溶液中加入KSCN溶液出现血红色,说明W溶液中含有
(3)H→M的过程中,可能观察到的现象为
(4)写出A→B+C的化学方程式
(5)D→E过程中②的离子方程式
您最近一年使用:0次



