1 . 下列物质的性质与用途具有对应关系的是
A. 受热易分解,可用作氮肥 受热易分解,可用作氮肥 |
B. 的熔点高,可用作光纤通信材料 的熔点高,可用作光纤通信材料 |
C. 的水溶液显碱性,可用于除铁屑上的油污 的水溶液显碱性,可用于除铁屑上的油污 |
| D.石墨具有导电性,可用作铅笔的笔芯材料 |
您最近一年使用:0次
2 . 镁及其合金是用途很广的金属材料。从海水中获取镁的主要步骤如图所示:

A.试剂①可以选用 (或 (或 ),试剂②可以选用 ),试剂②可以选用 |
| B.操作Ⅱ是蒸发浓缩至有大量晶体析出、趁热过滤、洗涤、干燥 |
C.实验室熔融无水 (熔点: (熔点: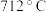 )时需酒精喷灯、三脚架、泥三角、坩埚和坩埚钳等仪器 )时需酒精喷灯、三脚架、泥三角、坩埚和坩埚钳等仪器 |
D.无水 电解生成镁的化学方程式为 电解生成镁的化学方程式为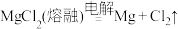 |
您最近一年使用:0次
3 . 联氨(H2N—NH2,二元弱碱,无色油状液体)是一种用途广泛的化工原料,可用作火箭和燃料电池的燃料,在空气中能燃烧且产物无污染。
(1)已知:
联氨高温热分解,N2H4(l)+O2(l)=N2(g)+2H2O(g) ∆H=________ kJ∙mol-1。
(2)联氨属于________ (填“强电解质”或“弱电解质”),联氨在水中可分步电离,联氨在D2O中的第一步电离方程式为________ 。
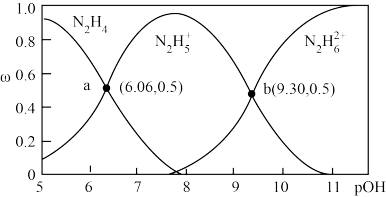
(3)常温下,向 的联氨水溶液中逐滴滴加一定浓度的稀盐酸,水溶液中部分微粒的物质的量分数(ω)变化如图所示[
的联氨水溶液中逐滴滴加一定浓度的稀盐酸,水溶液中部分微粒的物质的量分数(ω)变化如图所示[ ]。该联氨水溶液中含氮元素的粒子的浓度由大到小的关系为
]。该联氨水溶液中含氮元素的粒子的浓度由大到小的关系为________ ;联氨的一级电离常数Kb1=________ 。
(4)常温下,浓度均为0.1mol∙L-1的NH3∙H2O (Kb=1.8×10-5)溶液和联氨水溶液中,c(OH-)较大的溶液是________ (填“NH3∙H2O溶液”或“联氨水溶液”,下同);均稀释至原溶液浓度的一半,稀释后溶液中c(OH-)较大的溶液是________ 。
(1)已知:
| 共价键 |  |  |  |  |  |
| 键能/( kJ∙mol-1) | 157 | 391 | 497 | 463 | 946 |
(2)联氨属于
(3)常温下,向
 的联氨水溶液中逐滴滴加一定浓度的稀盐酸,水溶液中部分微粒的物质的量分数(ω)变化如图所示[
的联氨水溶液中逐滴滴加一定浓度的稀盐酸,水溶液中部分微粒的物质的量分数(ω)变化如图所示[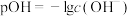 ]。该联氨水溶液中含氮元素的粒子的浓度由大到小的关系为
]。该联氨水溶液中含氮元素的粒子的浓度由大到小的关系为
(4)常温下,浓度均为0.1mol∙L-1的NH3∙H2O (Kb=1.8×10-5)溶液和联氨水溶液中,c(OH-)较大的溶液是
您最近一年使用:0次
2022-11-10更新
|
137次组卷
|
2卷引用:广西贵港市桂平市浔州高级中学2022-2023学年高二上学期期中考试化学试题
解题方法
4 . 铜及其化合物的用途非常广泛。回答下列问题:
(1)实验室常用新制的 来检验醛基,反应原理为
来检验醛基,反应原理为 。
。
①基态铜原子的价电子排布式为___________ ,Cu成为阳离子时首先失去___________ 轨道上的电子。
② 中的中心原子的杂化轨道类型为
中的中心原子的杂化轨道类型为___________ ,HCHO分子中 键与
键与 键的个数之比为
键的个数之比为___________ 。
③上述反应中涉及的非金属元素的电负性由大到小的顺序为___________ (填元素符号)。
(2)黄铜矿(主要成分为 )是工业炼铜的主要原料,高温下灼烧黄铜矿,其发生的反应之一为
)是工业炼铜的主要原料,高温下灼烧黄铜矿,其发生的反应之一为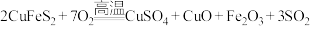 。
。
① 的空间结构为
的空间结构为___________ 。
② 中的中心原子S上的孤电子对数为
中的中心原子S上的孤电子对数为___________ 。
(3)磷化铜(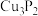 )用于制造磷青铜,某磷青铜的晶胞结构如图所示。
)用于制造磷青铜,某磷青铜的晶胞结构如图所示。

①该晶体中距离Cu原子最近的Cu原子有___________ 个。
②该晶胞中距离最近的Cu原子的核间距为apm,则该晶胞的密度为___________ (用含a、 的代数式表示,
的代数式表示, 表示阿伏加德罗常数的值)
表示阿伏加德罗常数的值) 。
。
(1)实验室常用新制的
 来检验醛基,反应原理为
来检验醛基,反应原理为 。
。①基态铜原子的价电子排布式为
②
 中的中心原子的杂化轨道类型为
中的中心原子的杂化轨道类型为 键与
键与 键的个数之比为
键的个数之比为③上述反应中涉及的非金属元素的电负性由大到小的顺序为
(2)黄铜矿(主要成分为
 )是工业炼铜的主要原料,高温下灼烧黄铜矿,其发生的反应之一为
)是工业炼铜的主要原料,高温下灼烧黄铜矿,其发生的反应之一为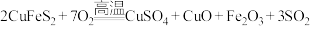 。
。①
 的空间结构为
的空间结构为②
 中的中心原子S上的孤电子对数为
中的中心原子S上的孤电子对数为(3)磷化铜(
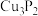 )用于制造磷青铜,某磷青铜的晶胞结构如图所示。
)用于制造磷青铜,某磷青铜的晶胞结构如图所示。
①该晶体中距离Cu原子最近的Cu原子有
②该晶胞中距离最近的Cu原子的核间距为apm,则该晶胞的密度为
 的代数式表示,
的代数式表示, 表示阿伏加德罗常数的值)
表示阿伏加德罗常数的值) 。
。
您最近一年使用:0次
5 . 硼及其化合物在工业上有许多用途。以铁硼矿(主要成分为 和
和 还有少量
还有少量 、FeO、CaO、
、FeO、CaO、 和
和 等)为原料制备硼酸(
等)为原料制备硼酸( )的工艺流程如图所示:
)的工艺流程如图所示:
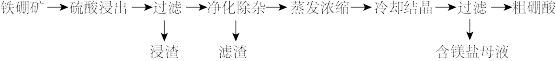
该工艺条件下,有关金属离子开始沉淀和沉淀完全的pH见下表(室温下):
回答下列问题:
(1)“硫酸浸出”时,常将铁硼矿粉碎,其目的是___________ 。
(2)“净化除杂”时:
①首先需通入过量的 ,其目的是
,其目的是___________ 。
②其次调节溶液的pH约为5,“滤渣”的主要成分为___________ (填化学式)。
③室温下,依据表中提供的数据求出
___________ 。
(3)室温下, 为一元弱酸,可用于中和溅在皮肤上的NaOH溶液,
为一元弱酸,可用于中和溅在皮肤上的NaOH溶液, 的
的 的pH约为
的pH约为___________ (已知:室温下, ,lg2≈0.3,lg3≈0.5)。
,lg2≈0.3,lg3≈0.5)。
 和
和 还有少量
还有少量 、FeO、CaO、
、FeO、CaO、 和
和 等)为原料制备硼酸(
等)为原料制备硼酸( )的工艺流程如图所示:
)的工艺流程如图所示: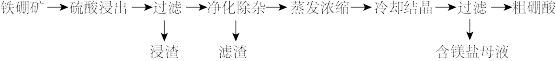
该工艺条件下,有关金属离子开始沉淀和沉淀完全的pH见下表(室温下):
| 金属离子 |  |  |  |  |  |
开始沉淀(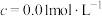 )的pH )的pH | 2.2 | 3.7 | 9.5 | 12.3 | 6.3 |
沉淀完全( )的pH )的pH | 3.2 | 4.7 | 11.0 | 13.8 | 8.3 |
(1)“硫酸浸出”时,常将铁硼矿粉碎,其目的是
(2)“净化除杂”时:
①首先需通入过量的
 ,其目的是
,其目的是②其次调节溶液的pH约为5,“滤渣”的主要成分为
③室温下,依据表中提供的数据求出

(3)室温下,
 为一元弱酸,可用于中和溅在皮肤上的NaOH溶液,
为一元弱酸,可用于中和溅在皮肤上的NaOH溶液, 的
的 的pH约为
的pH约为 ,lg2≈0.3,lg3≈0.5)。
,lg2≈0.3,lg3≈0.5)。
您最近一年使用:0次
名校
6 . 下列物质的用途或者制备中所涉及到的离子方程式书写正确的是
| 选项 | 用途或者制备 | 离子方程式 |
| A | 用稀硫酸清洗铁锈 | Fe2O3+6H+=2Fe2++3H2O |
| B | 实验室用大理石与稀盐酸反应制备二氧化碳 | CO32-+2H+ =H2O+CO2↑ |
| C | 用氢氧化钠溶液吸收氯气 | Cl2 + 2OH-=Cl-+ClO-+H2O |
| D | 用氯化铁溶液刻蚀铜板 | Fe3+ + Cu =Fe2++Cu2+ |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2019-01-20更新
|
1014次组卷
|
9卷引用:广西贵港市名校2023-2024学年高一上学期入学联考化学试题
广西贵港市名校2023-2024学年高一上学期入学联考化学试题【区级联考】北京市昌平区2018-2019学年高一第一学期期末教学统一检测化学试题【全国百强校】四川省成都外国语学校2018-2019学年高一下学期入学考试化学试题(已下线)期中模拟卷(二)——2020-2021学年高一化学必修第一册同步单元AB卷(新教材人教版)河北省安平中学2020-2021学年高一上学期第一次月考化学试题河北省石家庄市第二十三中学2020-2021学年高一上学期12月阶段考试化学试题河北省石家庄市第二十三中学2020-2021学年高一上学期第三次月考化学试题湖南省邵阳市隆回县2021-2022学年高一上学期期末考试化学试题新疆哈密市第八中学2022-2023学年高一上学期期末考试化学试题
13-14高一·全国·课时练习
名校
7 . 镁及其合金是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的。主要步骤如下:
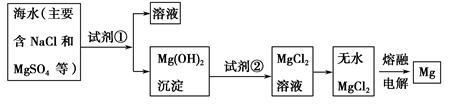
(1)为了使MgSO4转化为Mg(OH)2,试剂①可以选用______ ,要使MgSO4完全转化为沉淀,加入试剂的量应为______ 。
(2)加入试剂①后,能够分离得到Mg(OH)2沉淀的方法是______ 。
(3)试剂②选用______ ;写出其反应的离子方程式______ 。
(4)无水MgCl2在熔融状态下,通电后产生镁和氯气,该反应的化学方程式为______ 。

(1)为了使MgSO4转化为Mg(OH)2,试剂①可以选用
(2)加入试剂①后,能够分离得到Mg(OH)2沉淀的方法是
(3)试剂②选用
(4)无水MgCl2在熔融状态下,通电后产生镁和氯气,该反应的化学方程式为
您最近一年使用:0次
2016-12-09更新
|
779次组卷
|
11卷引用:广西贵港市覃塘高级中学2016-2017学年高一6月月考化学试题
广西贵港市覃塘高级中学2016-2017学年高一6月月考化学试题(已下线)2014年高一化学人教版必修2 4.1.2海水资源的开发利用练习卷(已下线)同步君 必修2 第4章 第1节 海水资源的开发利用高中化学人教版 必修2 第四章 化学与自然资源的开发利用 第一节 开发利用金属矿物和海水资源 海水资源的开发利用(已下线)2018年5月25日 海水提镁——《每日一题》2017-2018学年高一化学人教必修2河北省邢台市第八中学2018-2019学年高二上学期期中考试化学试题云南省景谷一中2018-2019学年高一下学期期末考试化学试题云南省德宏傣族景颇族自治州陇川县第一中学2019-2020学年高二上学期开学考试化学试题云南省峨山彝族自治县第一中学2019-2020学年高二上学期期中考试化学(文)试题2019-2020学年新人教版必修2同步练习题:8.1自然资源的开发利用(已下线)8.1.2 海水资源的开发利用(能力提升)-2020-2021学年高一化学新教材新理念新设计同步课堂(人教2019必修第二册)



