名校
解题方法
1 . A、B、C、D、E为前四周期原子序数依次增大的五种元素。其中A元素原子半径是所有元素原子中最小的,B元素原子核外有三种不同的能级且各个能级所填充的电子数相同,D元素原子最外层电子数是内层电子数的3倍,E2+的3d轨道中有10个电子。
(1)E基态原子的核外电子排布式为__________________ 。
(2)B、C、D三种元素电负性从小到大的顺序是______________ (填元素符号)。
(3)B2A2中的化学键包括_________ 键(填“极性键”或“非极性键”),分子为_________ 分子(填“极性”或“非极性”)。1mol B2A2分子中含有 键与
键与 键的数目之比为
键的数目之比为_________ 。
(4)A2D2是常用的绿色氧化剂,其电子式为___________ 。A2D2能与水混溶,却不溶于CCl4。请解释原因__________________ 。
(5)B、C形成的BC-常作为配位化合物的配体。已知E2+与 形成配离子时,配位数为4,而Au+与BC-形成配离子时,配位数为2。工业上常用Au+与BC-形成的配离子与E单质反应,生成E2+与BC-形成的配离子来提取Au。写出上述离子反应的离子方程式
形成配离子时,配位数为4,而Au+与BC-形成配离子时,配位数为2。工业上常用Au+与BC-形成的配离子与E单质反应,生成E2+与BC-形成的配离子来提取Au。写出上述离子反应的离子方程式_________________ 。
(1)E基态原子的核外电子排布式为
(2)B、C、D三种元素电负性从小到大的顺序是
(3)B2A2中的化学键包括
 键与
键与 键的数目之比为
键的数目之比为(4)A2D2是常用的绿色氧化剂,其电子式为
(5)B、C形成的BC-常作为配位化合物的配体。已知E2+与
 形成配离子时,配位数为4,而Au+与BC-形成配离子时,配位数为2。工业上常用Au+与BC-形成的配离子与E单质反应,生成E2+与BC-形成的配离子来提取Au。写出上述离子反应的离子方程式
形成配离子时,配位数为4,而Au+与BC-形成配离子时,配位数为2。工业上常用Au+与BC-形成的配离子与E单质反应,生成E2+与BC-形成的配离子来提取Au。写出上述离子反应的离子方程式
您最近一年使用:0次
2024-05-02更新
|
65次组卷
|
2卷引用:广西百色市田东县''贵百河“2023-2024学年高二下学期4月月考化学试题
2 . 由下列实验方案、现象得出的结论不正确的是
实验方案 | 现象 | 结论 | |
| A | 向FeCl3溶液中加入几滴KSCN溶液 | 溶液立即变红 | KSCN溶液可用来检验Fe3+ |
| B | 用毛皮摩擦过的带电橡胶靠近CF2Cl2液流 | 液流方向改变 | CF2Cl2是正四面体结构,为非极性分子 |
| C | 在碘水中加入CCl4,振荡 | 分层,下层紫红色 | I2在水中的溶解度小于在CCl4中的溶解度 |
| D | [Cu(NH3)4]SO4溶液中加入乙醇 | 析出深蓝色固体 | [Cu(NH3)4]SO4在乙醇中溶解度小 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-04-22更新
|
158次组卷
|
2卷引用:广西百色市田东县''贵百河“2023-2024学年高二下学期4月月考化学试题
解题方法
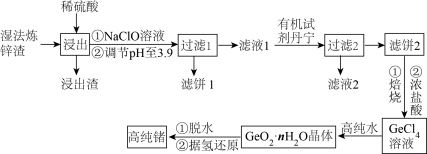
3 . 锗是一种重要的半导体材料。图为工业上利用湿法炼锌渣(主要含有GeO2、ZnO、FeO、Fe2O3、SiO2)制备高纯锗的工艺流程:
①GeO2为两性化合物。
②常温下,部分金属阳离子转化为氢氧化物沉淀的pH见下表。
③有机试剂丹宁沉淀金属阳离子的沉淀率见下表。
(1)为了提高锗元素浸出率,“浸出”时可采取的措施___________________ (任写2种)。
(2)浸出后加入NaClO溶液的作用是________________ (用离子方程式表示)。
(3)常温下调节溶液的pH至3.9时,
______  。
。
(4)“滤液2”中主要含有的金属阳离子是_________ (填离子符号)。
(5) GeCl4与高纯水反应的化学方程式为_____________________ 。
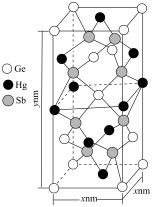
(6)锗(Ge)可与汞(Hg)和锑(Sb)可形成一种绝缘材料,晶胞结构如下图所示。____________ ,该晶胞中与Hg距离最近的Sb的数目为_________ 。
①GeO2为两性化合物。
②常温下,部分金属阳离子转化为氢氧化物沉淀的pH见下表。
离子 |
|
|
|
|
开始沉淀时pH | 7.5 | 2.2 | 6.2 | 8.2 |
完全沉淀时pH[ | 9.0 | 3.2 | 8.2 | 11.2 |
离子 |
|
|
|
|
沉淀率(%) | 0 | 99 | 0 | 97~98.5 |
(1)为了提高锗元素浸出率,“浸出”时可采取的措施
(2)浸出后加入NaClO溶液的作用是
(3)常温下调节溶液的pH至3.9时,

 。
。(4)“滤液2”中主要含有的金属阳离子是
(5) GeCl4与高纯水反应的化学方程式为
(6)锗(Ge)可与汞(Hg)和锑(Sb)可形成一种绝缘材料,晶胞结构如下图所示。
您最近一年使用:0次
4 . 氨是一种重要的化工产品。回答下列问题:
(1)已知:
①
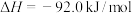
②

③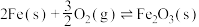
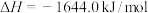
则反应

___________ kJ/mol,该反应在(填“高温”“低温”或“任意温度”)__________________ 下能自发进行。
(2)下列关于合成氨工艺的理解中,正确的有 (填标号)。
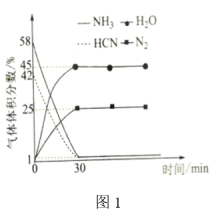
(3)温度为T℃,压强恒定为pMPa,用Fe2O3处理NH3和HCN(起始时NH3的体积分数为58%)的混合气体,部分气体的体积分数随时间的变化如图1,反应经30min达到平衡。 =
=____________  。
。
②反应 的平衡常数Kp=
的平衡常数Kp=____________  (列出计算式即可,Kp计算时用平衡分压代替平衡浓度,分压=总压×体积分数)
(列出计算式即可,Kp计算时用平衡分压代替平衡浓度,分压=总压×体积分数)
(4)电化学气敏传感器可用于检测环境中NH3的含量,其工作原理如图2所示。_________ 极(填“正”或“负”),其电极反应式为____________ 。
②反应消耗的O2与NH3的物质的量之比为_________ 。
(1)已知:
①

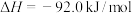
②


③
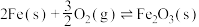
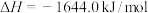
则反应


(2)下列关于合成氨工艺的理解中,正确的有 (填标号)。
| A.控制温度远高于室温,是为了保证尽可能高的平衡转化率和快的反应速率 |
B.合成氨反应在不同温度下的 和 和 S都小于零 S都小于零 |
| C.NH3易液化,不断将液氨移去,利于反应正向进行 |
| D.原料气中N2由分离空气得到,H2由天然气与水蒸气反应生成,原料气需要经过净化处理,以防催化剂中毒和安全事故发生 |
 =
= 。
。②反应
 的平衡常数Kp=
的平衡常数Kp= (列出计算式即可,Kp计算时用平衡分压代替平衡浓度,分压=总压×体积分数)
(列出计算式即可,Kp计算时用平衡分压代替平衡浓度,分压=总压×体积分数)(4)电化学气敏传感器可用于检测环境中NH3的含量,其工作原理如图2所示。
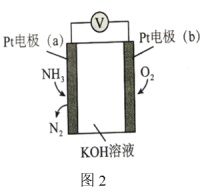
②反应消耗的O2与NH3的物质的量之比为
您最近一年使用:0次
5 .  (三氯化六氨合钴)是一种重要的化工产品。实验室可以用活性炭(作催化剂)、浓氨水、氯化铵、双氧水和
(三氯化六氨合钴)是一种重要的化工产品。实验室可以用活性炭(作催化剂)、浓氨水、氯化铵、双氧水和 制备,实验装置如图:
制备,实验装置如图:
a. 开始沉淀pH=9。
开始沉淀pH=9。
b. 为橘黄色晶体,难溶于乙醇。
为橘黄色晶体,难溶于乙醇。
实验步骤如下:
①首先将活性炭、 和氯化铵在仪器c中混合,再滴加浓氨水。
和氯化铵在仪器c中混合,再滴加浓氨水。
②置于冰水浴中冷却至10℃以下,缓慢滴加双氧水并不断搅拌。
③转移至60℃热水浴中,恒温加热30min,同时缓慢搅拌。
④将反应后的混合物冷却到0℃左右,过滤得到 粗产品。
粗产品。
⑤将粗产品转入含少量盐酸的沸水中,趁热过滤,再往滤液中慢慢加入10mL浓HCl,即有大量的橘黄色晶体析出,过滤。
⑥所得晶体用冷的浓盐酸洗涤、再用少许乙醇洗涤、干燥等操作得到较纯 。
。
请回答下列问题:
(1) 中Co的化合价是
中Co的化合价是_________ ,配位数为_________ 。
(2)仪器b的名称为_________ 。
(3)仪器d中所盛药品为_________ ,其作用主要为吸收挥发出来的氨气。
(4)步骤⑥中,再用少许乙醇洗涤的目的是____________________________________________________ 。
(5)反应器中发生的总反应化学方程式为______________________________________________________ 。
(6)称取m g粗产品与氢氧化钠在空气中混合煅烧得氧化钴→将氧化钴用稀硫酸溶解→配成250mL溶液→___________ (按顺序填序号),纯度为____________ (写出表达式)。
a.向锥形瓶中加入稍过量的KI溶液( 被还原后的产物为
被还原后的产物为 ),充分反应
),充分反应
b.平行滴定三次,消耗标准溶液的体积平均值为V mL
c.取25.00mL待测液于锥形瓶中
d.用淀粉溶液作指示剂,用c
 标准溶液滴定(产物为
标准溶液滴定(产物为 )
)
 (三氯化六氨合钴)是一种重要的化工产品。实验室可以用活性炭(作催化剂)、浓氨水、氯化铵、双氧水和
(三氯化六氨合钴)是一种重要的化工产品。实验室可以用活性炭(作催化剂)、浓氨水、氯化铵、双氧水和 制备,实验装置如图:
制备,实验装置如图:
a.
 开始沉淀pH=9。
开始沉淀pH=9。b.
 为橘黄色晶体,难溶于乙醇。
为橘黄色晶体,难溶于乙醇。实验步骤如下:
①首先将活性炭、
 和氯化铵在仪器c中混合,再滴加浓氨水。
和氯化铵在仪器c中混合,再滴加浓氨水。②置于冰水浴中冷却至10℃以下,缓慢滴加双氧水并不断搅拌。
③转移至60℃热水浴中,恒温加热30min,同时缓慢搅拌。
④将反应后的混合物冷却到0℃左右,过滤得到
 粗产品。
粗产品。⑤将粗产品转入含少量盐酸的沸水中,趁热过滤,再往滤液中慢慢加入10mL浓HCl,即有大量的橘黄色晶体析出,过滤。
⑥所得晶体用冷的浓盐酸洗涤、再用少许乙醇洗涤、干燥等操作得到较纯
 。
。请回答下列问题:
(1)
 中Co的化合价是
中Co的化合价是(2)仪器b的名称为
(3)仪器d中所盛药品为
(4)步骤⑥中,再用少许乙醇洗涤的目的是
(5)反应器中发生的总反应化学方程式为
(6)称取m g粗产品与氢氧化钠在空气中混合煅烧得氧化钴→将氧化钴用稀硫酸溶解→配成250mL溶液→
a.向锥形瓶中加入稍过量的KI溶液(
 被还原后的产物为
被还原后的产物为 ),充分反应
),充分反应b.平行滴定三次,消耗标准溶液的体积平均值为V mL
c.取25.00mL待测液于锥形瓶中
d.用淀粉溶液作指示剂,用c

 标准溶液滴定(产物为
标准溶液滴定(产物为 )
)
您最近一年使用:0次
解题方法
6 . 已知:常温下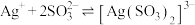 ,
,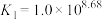 ,
,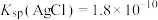 ,某实验小组利用AgCl与Na2SO3反应生成
,某实验小组利用AgCl与Na2SO3反应生成 来“分银”,“分银”时,
来“分银”,“分银”时, 的浓度与溶液pH的关系如图1;
的浓度与溶液pH的关系如图1; 与H+形成的微粒的浓度分数
与H+形成的微粒的浓度分数 随溶液pH变化的关系如图2,下列叙述错误的是
随溶液pH变化的关系如图2,下列叙述错误的是
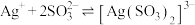 ,
,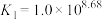 ,
,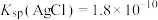 ,某实验小组利用AgCl与Na2SO3反应生成
,某实验小组利用AgCl与Na2SO3反应生成 来“分银”,“分银”时,
来“分银”,“分银”时, 的浓度与溶液pH的关系如图1;
的浓度与溶液pH的关系如图1; 与H+形成的微粒的浓度分数
与H+形成的微粒的浓度分数 随溶液pH变化的关系如图2,下列叙述错误的是
随溶液pH变化的关系如图2,下列叙述错误的是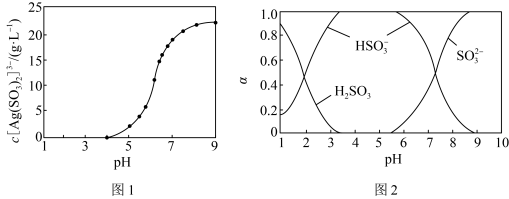
A. 中的∠O—S—O小于 中的∠O—S—O小于 中的∠O—S—O 中的∠O—S—O |
| B.“分银”时,pH需控制的范围大约是8~9 |
C. 溶液中存在 溶液中存在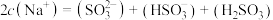 |
D.AgCl与 反应生成 反应生成 和 和 ,该反应的平衡常数 ,该反应的平衡常数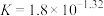 |
您最近一年使用:0次
7 . 已知反应: 。在一定压强下,按
。在一定压强下,按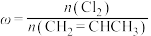 向密闭容器中充入氯气与丙烯。图甲表示平衡时,丙烯的体积分数(
向密闭容器中充入氯气与丙烯。图甲表示平衡时,丙烯的体积分数( )与温度(T)、
)与温度(T)、 的关系,图乙表示反应的平衡常数(K)与温度(T)的关系。则下列说法正确的是
的关系,图乙表示反应的平衡常数(K)与温度(T)的关系。则下列说法正确的是
 。在一定压强下,按
。在一定压强下,按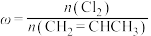 向密闭容器中充入氯气与丙烯。图甲表示平衡时,丙烯的体积分数(
向密闭容器中充入氯气与丙烯。图甲表示平衡时,丙烯的体积分数( )与温度(T)、
)与温度(T)、 的关系,图乙表示反应的平衡常数(K)与温度(T)的关系。则下列说法正确的是
的关系,图乙表示反应的平衡常数(K)与温度(T)的关系。则下列说法正确的是
A.此反应 H>0 H>0 | B.图甲中 |
| C.图乙中,曲线A表示正反应的平衡常数 | D.温度T1、 , , 的转化率约为33.3% 的转化率约为33.3% |
您最近一年使用:0次
解题方法
8 . 可利用电化学的原理回收利用工业废气中的CO2和SO2,实验原理示意图如下。
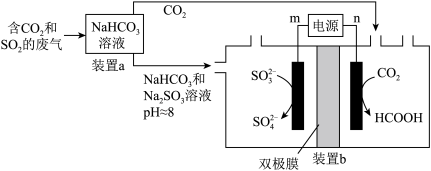
| A.装置b中左边的电极为阳极 |
| B.装置a中溶液的作用是吸收废气中的CO2和SO2 |
C.装置b中右边电极的电极反应式为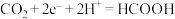 |
D.装置b若采用质子交换膜,每消耗1mol CO2则有2mol  转移 转移 |
您最近一年使用:0次
解题方法
9 . 化学反应在社会发展中运用广泛。下列解释事实的离子方程式正确的是
A.纯碱溶液可以除去油污: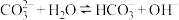 |
B.用亚硫酸钠溶液吸收少量氯气: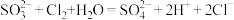 |
C.铅酸蓄电池充电时的阴极电极反应: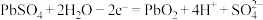 |
D.用醋酸和淀粉—KI溶液检验加碘食盐中所含的碘: |
您最近一年使用:0次
解题方法
10 . 下列实验装置或操作方法正确且能达到实验目的的是
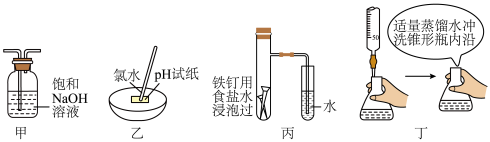
| A.甲装置可以除氯气中的氯化氢气体 |
| B.乙装置用来测新制氯水的pH值 |
| C.丙装置可以验证铁的吸氧腐蚀 |
| D.丁装置为用高锰酸钾溶液滴定草酸接近终点的操作 |
您最近一年使用:0次





 ]
]

