1 . 西北工业大学曾华强课题组借用足球烯核心,成功实现了高效且选择性可精准定制的离子跨膜运输,如图所示。

已知:图甲中的有机物为“冠醚”,命名规则是“环上原子个数-冠醚-氧原子个数”。
请回答下列问题:
(1)基态Cs原子的价层电子的轨道表示式为___________ 。基态K原子的核外电子云有___________ 个伸展方向。
(2)运输Cs+的冠醚名称是___________ 。冠醚分子中氧原子的杂化类型是___________ ,冠醚与碱金属离子之间存在微弱的配位键,配位原子是___________ (填元素符号)。
(3)几种冠醚与识别的碱金属离子的有关数据如下表所示:
18-冠醚-6不能识别和运输Na+和Cs+的原因是___________ 。
(4)碱金属氯化物中NaCl 、KCl、RbCl、 CsCl熔点由高到低顺序为___________ ,理由是___________ 。
(5) 具有反萤石结构,晶胞如图所示。已知晶胞参数为0.4665nm,阿伏加德罗常数的值为
具有反萤石结构,晶胞如图所示。已知晶胞参数为0.4665nm,阿伏加德罗常数的值为 ,则
,则 的密度为
的密度为___________  (列出计算式)。若该立方晶胞中原子A的坐标参数为(0,1,0),则原子B的坐标参数为
(列出计算式)。若该立方晶胞中原子A的坐标参数为(0,1,0),则原子B的坐标参数为___________ 。


已知:图甲中的有机物为“冠醚”,命名规则是“环上原子个数-冠醚-氧原子个数”。
请回答下列问题:
(1)基态Cs原子的价层电子的轨道表示式为
(2)运输Cs+的冠醚名称是
(3)几种冠醚与识别的碱金属离子的有关数据如下表所示:
| 冠醚 | 冠醚空腔直径/pm | 适合的粒子直径/pm |
| 12-冠醚- 4 | 120~ 150 | Li+ (152) |
| 15 -冠醚- 5 | 170~ 220 | Na+ (204) |
| 18 -冠醚- 6 | 260~ 320 | K+ (276) |
| —— | 340~ 430 | Rb+ (304) |
| Cs+ (334) |
(4)碱金属氯化物中NaCl 、KCl、RbCl、 CsCl熔点由高到低顺序为
(5)
 具有反萤石结构,晶胞如图所示。已知晶胞参数为0.4665nm,阿伏加德罗常数的值为
具有反萤石结构,晶胞如图所示。已知晶胞参数为0.4665nm,阿伏加德罗常数的值为 ,则
,则 的密度为
的密度为 (列出计算式)。若该立方晶胞中原子A的坐标参数为(0,1,0),则原子B的坐标参数为
(列出计算式)。若该立方晶胞中原子A的坐标参数为(0,1,0),则原子B的坐标参数为
您最近一年使用:0次
名校
解题方法
2 . 任何化学反应都伴随着能量的变化,通过化学反应,化学能可转化为热能、电能等不同形式的能量。
(1)H2可用于工业合成氨气,已知拆开1molH—H、1molN≡N分别需要吸收的能量为436kJ、946kJ,形成1molN—H会放出能量391kJ,则在反应N2+3H2 2NH3中,每生成2molNH3,
2NH3中,每生成2molNH3,_______ (填“吸收”或“放出”)热量_______ kJ。当在相同的条件下向容器中充入1molN2和3molH2时,它们反应对应的热量_______ (填“大于”“等于”或“小于”)你所计算出的值。
(2)用图甲、乙所示装置进行实验,请回答下列问题。
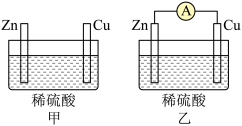
以下叙述中,正确的是_______ (填字母)。
a.甲中铜片是正极,乙中锌片是负极
b.两池中溶液的pH均增大
c.两池中铜片表面均有气泡产生
d.若反应过程中有0.2mol电子转移,生成的氢气在标准状况下的体积均为2.24L
(3)Mg、Al设计成如图所示原电池装置:
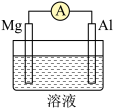
若溶液为氢氧化钠溶液,负极的电极反应为_______ 。
(4)电化学法处理SO2是目前研究的热点。利用过氧化氢吸收SO2可消除SO2污染,设计装置如图所示。
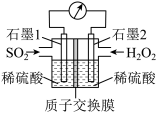
①石墨1为_______ (填“正极”或“负极”);正极的电极反应式为_______ 。
②若11.2L(标准状况)SO2参与反应,则迁移H+的物质的量为_______ 。
(1)H2可用于工业合成氨气,已知拆开1molH—H、1molN≡N分别需要吸收的能量为436kJ、946kJ,形成1molN—H会放出能量391kJ,则在反应N2+3H2
 2NH3中,每生成2molNH3,
2NH3中,每生成2molNH3,(2)用图甲、乙所示装置进行实验,请回答下列问题。

以下叙述中,正确的是
a.甲中铜片是正极,乙中锌片是负极
b.两池中溶液的pH均增大
c.两池中铜片表面均有气泡产生
d.若反应过程中有0.2mol电子转移,生成的氢气在标准状况下的体积均为2.24L
(3)Mg、Al设计成如图所示原电池装置:

若溶液为氢氧化钠溶液,负极的电极反应为
(4)电化学法处理SO2是目前研究的热点。利用过氧化氢吸收SO2可消除SO2污染,设计装置如图所示。

①石墨1为
②若11.2L(标准状况)SO2参与反应,则迁移H+的物质的量为
您最近一年使用:0次
2023-04-12更新
|
677次组卷
|
2卷引用:广西百色高级中学田林分校2022-2023学年高一下学期3月月考化学试题
3 . 该反应是工业制硫酸的反应之一,在2 L恒温恒容密闭容器中投入2 mol SO2和 1 mol O2在一定条件下充分反应,如图是SO2和SO3随时间的变化曲线。_______ 。
(2)前10minSO3的平均反应速率为_______ ;平衡时,SO2的转化率为_______ 。
(3)下列叙述不能判断该反应达到平衡状态的是_______ (填序号)。
①容器中压强不再改变 ②容器中气体密度不再改变 ③SO3的质量不再改变 ④O2的物质的量浓度不再改变 ⑤容器内气体原子总数不再发生变化
(4)以下操作会引起化学反应速率变快的是_______ (填字母)。
A.向容器中通入氦气 B.升高温度 C.扩大容器的容积 D.向容器中通入O2 E.使用正催化剂
(5)10min时,反应是否达到化学平衡?_______ (填“是”或“否”);25min时,正反应速率_______ 逆反应速率(填“>”“<”或“=”)。

(2)前10minSO3的平均反应速率为
(3)下列叙述不能判断该反应达到平衡状态的是
①容器中压强不再改变 ②容器中气体密度不再改变 ③SO3的质量不再改变 ④O2的物质的量浓度不再改变 ⑤容器内气体原子总数不再发生变化
(4)以下操作会引起化学反应速率变快的是
A.向容器中通入氦气 B.升高温度 C.扩大容器的容积 D.向容器中通入O2 E.使用正催化剂
(5)10min时,反应是否达到化学平衡?
您最近一年使用:0次
2023-04-12更新
|
692次组卷
|
4卷引用:广西百色高级中学田林分校2022-2023学年高一下学期3月月考化学试题
4 . 能源、材料、环保、健康等是当今社会重要的研究主题,化学与这些主题密切相关,在其研究与应用中发挥着重要作用。甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
反应I: CO2(g)+ 3H2(g)⇌CH3OH(g)+H2O(g) △H1=- 49.58kJ·mol-1
反应II: CO2(g)+H2(g)⇌CO(g)+ H2O(g) △H2=+41.19kJ·mol-1
反应III: CO(g)+ 2H2(g)⇌CH3OH(g) △H3
回答下列问题:
(1)反应III的△H3=_______ 。
(2)恒温,恒容密闭容器中,对于反应I,下列说法中不能说明该反应达到化学平衡状态的是_______。
(3)对于反应I,不同温度对CO2的转化率及催化剂的效率影响如图所示,下列有关说法正确的是_______。

(4)若在2L密闭容器中充入3 mol H2和1 mol CO2发生反应I,250℃时反应的平衡常数K=____ (列出计算式)。
(5)甲醇燃料电池的工作原理如图所示,则Y电极为_______ (填“正极”或“负极”), X电极的电极反应式为_______ 。换膜若使用该电池完成铁制品镀银,当铁制品质量增加64.8g时,理论上消耗甲醇的质量为_______ g。

反应I: CO2(g)+ 3H2(g)⇌CH3OH(g)+H2O(g) △H1=- 49.58kJ·mol-1
反应II: CO2(g)+H2(g)⇌CO(g)+ H2O(g) △H2=+41.19kJ·mol-1
反应III: CO(g)+ 2H2(g)⇌CH3OH(g) △H3
回答下列问题:
(1)反应III的△H3=
(2)恒温,恒容密闭容器中,对于反应I,下列说法中不能说明该反应达到化学平衡状态的是_______。
| A.混合气体的密度不再变化 |
| B.混合气体的平均相对分子质量不再变化 |
| C.CO2、H2、CH3OH、H2O的物质的量之比为1:3:1:1。 |
| D.混合气体的压强不再变化 |

| A.其他条件不变,若不使用催化剂,则250°C时CO2的平衡转化率可能位于M1 |
| B.温度低于250°C时,随温度升高甲醇的产率增大 |
| C.M点时平衡常数比N点时平衡常数大 |
| D.实际反应应尽可能在较低的温度下进行,以提高CO2的转化率。 |
(5)甲醇燃料电池的工作原理如图所示,则Y电极为

您最近一年使用:0次
2022-07-22更新
|
338次组卷
|
2卷引用:广西百色市2021-2022学年高二下学期期末考试理综化学试题
解题方法
5 . 研究和深度开发 CO,CO2的应用对构建生态文明社会具有重要的意义。
(1)CO 可用于炼铁。
已知:a.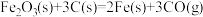 △H1=+489.0kJ·mol-1
△H1=+489.0kJ·mol-1
b.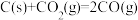 △H2=+172.5 kJ·mol-1
△H2=+172.5 kJ·mol-1
则 △H=
△H=_______ 。
(2)CO2和 H2充入一定体积的密闭容器中,在两种温度下发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) △H,测得 CH3OH 的物质的量随时间的变化如图所示。

①T1_______ T2,△H_______ 0(填“>”“=”或“<”)。
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则 c的取值范围为_______ 。
(3)甲醇是重要的化学工业基础原料和清洁液体燃料。工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
①据上述反应可推导出K1、K2与K3之间的关系,则K3=_______ (用K1、K2表示)。500 ℃时测得反应③在某时刻H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol·L-1)分别为0.8、0.1、0.3、0.15,则此时v正_______ (填“>”“=”或“<”)v逆。
②在3L容积可变的密闭容器中发生反应②,已知c(CO)随反应时间t的变化如图曲线Ⅰ所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。

当曲线Ⅰ变为曲线Ⅱ时,改变的条件是_______ ;当曲线Ⅰ变为曲线Ⅲ时,改变的条件是_______ 。
(1)CO 可用于炼铁。
已知:a.
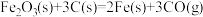 △H1=+489.0kJ·mol-1
△H1=+489.0kJ·mol-1b.
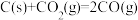 △H2=+172.5 kJ·mol-1
△H2=+172.5 kJ·mol-1则
 △H=
△H=(2)CO2和 H2充入一定体积的密闭容器中,在两种温度下发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) △H,测得 CH3OH 的物质的量随时间的变化如图所示。

①T1
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1 mol CO2、2 mol H2 | a mol CO2、b mol H2、c mol CH3OH(g)、c mol H2O(g) |
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则 c的取值范围为
(3)甲醇是重要的化学工业基础原料和清洁液体燃料。工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
| 化学反应 | 平衡常数 | 温度/℃ | |
| 500 | 800 | ||
| ①2H2(g)+CO(g)⇌CH3OH(g) | K1 | 2.5 | 0.15 |
| ②H2(g)+CO2(g)⇌H2O(g)+CO(g) | K2 | 1.0 | 2.50 |
| ③3H2(g)+CO2(g)⇌CH3OH(g)+H2O(g) | K3 | ||
①据上述反应可推导出K1、K2与K3之间的关系,则K3=
②在3L容积可变的密闭容器中发生反应②,已知c(CO)随反应时间t的变化如图曲线Ⅰ所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。

当曲线Ⅰ变为曲线Ⅱ时,改变的条件是
您最近一年使用:0次
解题方法
6 . Cl2是一种重要的化工原料,在生产和生活中应用十分广泛。
I∶地康法制取氯气的反应为4HCl+O2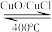 2Cl2+2H2O
2Cl2+2H2O
(1)已知400℃时反应物4molHCl(g)和1molO2 (g)总能量为akJ,生成物2molCl2 (g)和2molH2O (g)总能量为bkJ,其中a大于b。
①写出400℃时,地康法制取氯气的热化学方程式∶___________ 。
②下列有关地康法制取氯气说法正确的是___________ 。
A.使用催化剂或升高温度都可以提高活化分子百分数,从而缩短达到化学平衡的时间
B.催化剂可以降低正逆反应的活化能,从而改变反应的焓变
C.选择温度为400℃,主要考虑此温度下催化剂活性高,反应速率快
D.达到化学平衡时,正反应和逆反应的速率相等且为零
(2)保持恒温恒容条件,将物质的量之和为5mol的HCl和O2以不同的氯氧比[n(HCl])/n(O2)]进行反应,平衡时某反应物的转化率与氯氧比及不同温度的关系如图所示∶

①图中纵坐标表示___________ 的转化率(填“HCl”或“O2”)。
②图中T1、 T2的关系为∶ T1___________ T2(填 “>”、“<” 或“=”)。
③若容器容积为2L,则A点的平衡常数的值为___________ 。
II∶电解法是制备氯气的常用方法,离子交换膜法电解食盐水如上图。
①请写出阳极的电极反应式∶___________ 。
②离子交换膜法所选择的是交换膜___________ (填“阳离子”或“阴离子”)。
I∶地康法制取氯气的反应为4HCl+O2
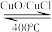 2Cl2+2H2O
2Cl2+2H2O(1)已知400℃时反应物4molHCl(g)和1molO2 (g)总能量为akJ,生成物2molCl2 (g)和2molH2O (g)总能量为bkJ,其中a大于b。
①写出400℃时,地康法制取氯气的热化学方程式∶
②下列有关地康法制取氯气说法正确的是
A.使用催化剂或升高温度都可以提高活化分子百分数,从而缩短达到化学平衡的时间
B.催化剂可以降低正逆反应的活化能,从而改变反应的焓变
C.选择温度为400℃,主要考虑此温度下催化剂活性高,反应速率快
D.达到化学平衡时,正反应和逆反应的速率相等且为零
(2)保持恒温恒容条件,将物质的量之和为5mol的HCl和O2以不同的氯氧比[n(HCl])/n(O2)]进行反应,平衡时某反应物的转化率与氯氧比及不同温度的关系如图所示∶

①图中纵坐标表示
②图中T1、 T2的关系为∶ T1
③若容器容积为2L,则A点的平衡常数的值为
II∶电解法是制备氯气的常用方法,离子交换膜法电解食盐水如上图。
①请写出阳极的电极反应式∶
②离子交换膜法所选择的是交换膜
您最近一年使用:0次
名校
7 . 氢化钙( )固体是一种储氢材料,是登山运动员常用的能源提供剂,某化学小组的同学在老师的指导下制备氢化钙。
)固体是一种储氢材料,是登山运动员常用的能源提供剂,某化学小组的同学在老师的指导下制备氢化钙。
【查阅资料】
Ⅰ.固体 的部分性质:常温:
的部分性质:常温: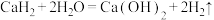
Ⅱ.金属 的部分性质:①
的部分性质:① (固体)②
(固体)② 的金属活动顺序介于K和
的金属活动顺序介于K和 之间
之间
【进行实验】
该小组同学设计的制取装置如图所示(固定装置略),回答下列问题:
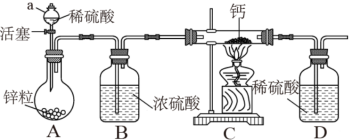
(1)写出 常温遇水发生反应的化学方程式
常温遇水发生反应的化学方程式___________ 。
(2)仪器a的名称___________ ;组装好仪器后,先进行的操作是___________ 。
(3)D中浓硫酸的作用为___________ 。
(4)实验时,先___________ (填“打开A中活塞”或“点燃C中酒精灯”),目的是___________ 。
【实验反思】
(5)实验结束后,甲同学取少量C装置中的固体小心加入水中,观察到有气泡冒出,溶液中加入酚酞后显红色,甲同学据此推断上述实验有 生成,乙同学否定了甲同学的结论原因是
生成,乙同学否定了甲同学的结论原因是___________ 。
该小组同学通过反思提出问题:如何检验制得的 是否纯净?他们再次设计实验进行检验,实验步骤如下(固定装置略):
是否纯净?他们再次设计实验进行检验,实验步骤如下(固定装置略):
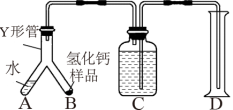
步骤1:检查装置气密性,装入足量的水和质量为mg的 样品,按图连接仪器。
样品,按图连接仪器。
步骤2:倾斜Y形管,使A中的水全部进入B,样品完全反应后,冷却至室温,量筒读数为V 。
。
(6)当
___________  时(用m、
时(用m、 表示),表明制得的
表示),表明制得的 样品是纯净的。(该实验条件下的气体摩尔体积为
样品是纯净的。(该实验条件下的气体摩尔体积为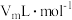 )
)
 )固体是一种储氢材料,是登山运动员常用的能源提供剂,某化学小组的同学在老师的指导下制备氢化钙。
)固体是一种储氢材料,是登山运动员常用的能源提供剂,某化学小组的同学在老师的指导下制备氢化钙。【查阅资料】
Ⅰ.固体
 的部分性质:常温:
的部分性质:常温: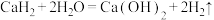
Ⅱ.金属
 的部分性质:①
的部分性质:① (固体)②
(固体)② 的金属活动顺序介于K和
的金属活动顺序介于K和 之间
之间【进行实验】
该小组同学设计的制取装置如图所示(固定装置略),回答下列问题:

(1)写出
 常温遇水发生反应的化学方程式
常温遇水发生反应的化学方程式(2)仪器a的名称
(3)D中浓硫酸的作用为
(4)实验时,先
【实验反思】
(5)实验结束后,甲同学取少量C装置中的固体小心加入水中,观察到有气泡冒出,溶液中加入酚酞后显红色,甲同学据此推断上述实验有
 生成,乙同学否定了甲同学的结论原因是
生成,乙同学否定了甲同学的结论原因是该小组同学通过反思提出问题:如何检验制得的
 是否纯净?他们再次设计实验进行检验,实验步骤如下(固定装置略):
是否纯净?他们再次设计实验进行检验,实验步骤如下(固定装置略):
步骤1:检查装置气密性,装入足量的水和质量为mg的
 样品,按图连接仪器。
样品,按图连接仪器。步骤2:倾斜Y形管,使A中的水全部进入B,样品完全反应后,冷却至室温,量筒读数为V
 。
。(6)当

 时(用m、
时(用m、 表示),表明制得的
表示),表明制得的 样品是纯净的。(该实验条件下的气体摩尔体积为
样品是纯净的。(该实验条件下的气体摩尔体积为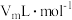 )
)
您最近一年使用:0次
2021-07-07更新
|
1073次组卷
|
4卷引用:广西百色市2020-2021学年高一下学期期末教学质量调研测试化学试题
8 . 在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)⇌CO(g)+ H2O(g),其化学平衡常数 K 和温度T的关系如下表:
请回答下列问题:
(1)该反应的平衡常数表达式为______ ,该反应为______ (填“吸热”或“放热”)
(2)能判断该反应是否已达化学平衡状态的依据是______ (填字母)。
A.混合气体的密度不变
B. 容器中压强不变
C.容器中 CO2、H2、CO、H2O的浓度之比为1:1:1:1
D.1 mol H—H 键断裂的同时断裂 2 mol H—O 键
E.混合气体中c(H2)保持不变
(3)能使该反应的反应速率增大,且平衡向正反应方向移动的是______ (填字母)。
a.及时分离出 CO 和 H2O b. 升高温度
c.增大压强 d. 选择高效的催化剂
(4)某温度下,在2L的密闭容器中,加入1 mol CO2和1 mol H2充分反应达平衡时,CO2平衡浓度为0.25 mol/L,则平衡时 CO2的转化率为______ ,试通过计算判断此时的温度为______ ℃。
(5)在830℃时,向2L的密闭容器中,充人2mol CO2、2 mol H2和2 mol H2O,则达到平衡时,混合物中 CO2的物质的量分数可能是______ (填字母)。
A.16.67% B.22.2% C.33.3% D.36.8%
| T/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的平衡常数表达式为
(2)能判断该反应是否已达化学平衡状态的依据是
A.混合气体的密度不变
B. 容器中压强不变
C.容器中 CO2、H2、CO、H2O的浓度之比为1:1:1:1
D.1 mol H—H 键断裂的同时断裂 2 mol H—O 键
E.混合气体中c(H2)保持不变
(3)能使该反应的反应速率增大,且平衡向正反应方向移动的是
a.及时分离出 CO 和 H2O b. 升高温度
c.增大压强 d. 选择高效的催化剂
(4)某温度下,在2L的密闭容器中,加入1 mol CO2和1 mol H2充分反应达平衡时,CO2平衡浓度为0.25 mol/L,则平衡时 CO2的转化率为
(5)在830℃时,向2L的密闭容器中,充人2mol CO2、2 mol H2和2 mol H2O,则达到平衡时,混合物中 CO2的物质的量分数可能是
A.16.67% B.22.2% C.33.3% D.36.8%
您最近一年使用:0次
2021-02-01更新
|
643次组卷
|
3卷引用:广西百色中学2021-2022学年高二上学期第一次月考化学试题
广西百色中学2021-2022学年高二上学期第一次月考化学试题广西河池市2020-2021学年高二上学期期末教学质量检测化学试题(已下线)专题10 化学反应速率与平衡-备战2021届高考化学二轮复习题型专练
名校
解题方法
9 . 3,4-二羟基肉桂酸乙酯(I)具有抗炎作用和治疗自身免疫性疾病的潜力。由化合物A制备该物质的合成路线如下:
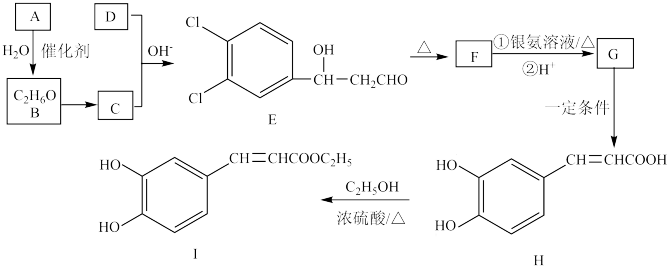
已知:R—CHO+R′—CH2—CHO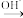
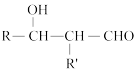

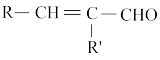
回答下列问题:
(1)I中含氧官能团的名称是____ 。
(2)E生成F的反应类型为___ 。
(3)下列有关H的说法中,错误的是____ 。
a.能使酸性高锰酸钾溶液褪色
b.1molH最多能和3molBr2反应
c.H分子中最多有8个碳原子共平面
d.1molH分别与足量NaOH、NaHCO3反应消耗NaOH、NaHCO3的物质的量之比为3:1
(4)D的结构简式为___ 。
(5)写出F与银氨溶液反应的化学方程式____ 。
(6)已知W是H的同分异构体,且W符合下列条件:
①属于芳香族化合物。
②1molW与足量NaHCO3溶液反应生成气体44.8L(标准状况)。
③核磁共振氢谱有4组吸收峰,且峰面积比为 1:2:2:3
则W的结构简式为___ 。
(7)呋喃丙烯酸(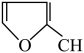 =CHCOOH )是一种医治血吸虫病的药物呋喃丙胺的原料。
=CHCOOH )是一种医治血吸虫病的药物呋喃丙胺的原料。
设计以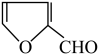 、CH3CH2OH为原料制备呋喃丙烯酸的合成路线(无机试剂任选)
、CH3CH2OH为原料制备呋喃丙烯酸的合成路线(无机试剂任选)______ 。

已知:R—CHO+R′—CH2—CHO
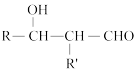

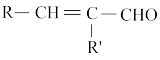
回答下列问题:
(1)I中含氧官能团的名称是
(2)E生成F的反应类型为
(3)下列有关H的说法中,错误的是
a.能使酸性高锰酸钾溶液褪色
b.1molH最多能和3molBr2反应
c.H分子中最多有8个碳原子共平面
d.1molH分别与足量NaOH、NaHCO3反应消耗NaOH、NaHCO3的物质的量之比为3:1
(4)D的结构简式为
(5)写出F与银氨溶液反应的化学方程式
(6)已知W是H的同分异构体,且W符合下列条件:
①属于芳香族化合物。
②1molW与足量NaHCO3溶液反应生成气体44.8L(标准状况)。
③核磁共振氢谱有4组吸收峰,且峰面积比为 1:2:2:3
则W的结构简式为
(7)呋喃丙烯酸(
 =CHCOOH )是一种医治血吸虫病的药物呋喃丙胺的原料。
=CHCOOH )是一种医治血吸虫病的药物呋喃丙胺的原料。设计以
 、CH3CH2OH为原料制备呋喃丙烯酸的合成路线(无机试剂任选)
、CH3CH2OH为原料制备呋喃丙烯酸的合成路线(无机试剂任选)
您最近一年使用:0次
2020-07-27更新
|
329次组卷
|
4卷引用:广西百色市2022-2023学年高二下学期期末考试化学试题
解题方法
10 . .按要求回答下列问题:
(1)以CO2和NH3为原料合成尿素是利用CO2的成功范例。在尿素合成塔中的主要反应可表示如下:
反应Ⅰ:2NH3(g)+CO2(g)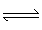 NH2COONH4(s)△H1
NH2COONH4(s)△H1
反应Ⅱ:NH2COONH4(s)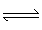 CO(NH2)2(s)+H2O(g)△H2=+72.49kJ/mol
CO(NH2)2(s)+H2O(g)△H2=+72.49kJ/mol
总反应:2NH3(g)+CO2(g)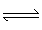 CO(NH2)2(s)+H2O(g)△H3=-86.98kJ/mol
CO(NH2)2(s)+H2O(g)△H3=-86.98kJ/mol
①反应Ⅰ的△H1=__ 。
②一定温度下,在体积固定的密闭容器中按n(NH3):n(CO2)=2:1进行反应Ⅰ,下列能说明反应Ⅰ达到了平衡状态的是__ (填序号)。
A.容器内气体总压强不再变化
B.NH3与CO2的转化率相等
C.容器内混合气体的密度不再变化
(2)在一定体积的密闭容器中进行如下化学反应:CO2(g)+H2(g)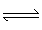 CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
回答下列问题:
①该反应的化学平衡常数表达式为K=__ 。
②该反应为__ (填“吸热”或“放热”)反应。
③某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为__ ℃。
④在800℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)为2mol·L-1,c(H2)为1.5mol·L-1,c(CO)为1mol·L-1,c(H2O)为3mol·L-1,此时反应向__ (填“正向”或“逆向”)进行。
(3)工业上从废铅蓄电池废液回收铅的过程中,常用纯碱溶液与处理后的铅膏(主要含PbSO4)发生反应:PbSO4(s)+CO (aq)
(aq)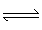 PbCO3(s)+SO
PbCO3(s)+SO ( aq)。
( aq)。
已知溶度积常数:Ksp(PbSO4)=1.6×10-8,Ksp(PbCO3)=7.4×10-14,则该反应的化学平衡常数K=__ 。
Ⅱ.N2H4—O2燃料电池是一种高效低污染的新型电池,其装置如图所示:
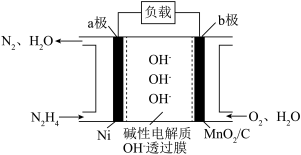
(1)N2H4的电子式为__ ;
(2)a极的电极反应方程式为___ 。
(1)以CO2和NH3为原料合成尿素是利用CO2的成功范例。在尿素合成塔中的主要反应可表示如下:
反应Ⅰ:2NH3(g)+CO2(g)
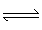 NH2COONH4(s)△H1
NH2COONH4(s)△H1反应Ⅱ:NH2COONH4(s)
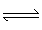 CO(NH2)2(s)+H2O(g)△H2=+72.49kJ/mol
CO(NH2)2(s)+H2O(g)△H2=+72.49kJ/mol总反应:2NH3(g)+CO2(g)
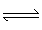 CO(NH2)2(s)+H2O(g)△H3=-86.98kJ/mol
CO(NH2)2(s)+H2O(g)△H3=-86.98kJ/mol①反应Ⅰ的△H1=
②一定温度下,在体积固定的密闭容器中按n(NH3):n(CO2)=2:1进行反应Ⅰ,下列能说明反应Ⅰ达到了平衡状态的是
A.容器内气体总压强不再变化
B.NH3与CO2的转化率相等
C.容器内混合气体的密度不再变化
(2)在一定体积的密闭容器中进行如下化学反应:CO2(g)+H2(g)
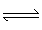 CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:| t/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
①该反应的化学平衡常数表达式为K=
②该反应为
③某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为
④在800℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)为2mol·L-1,c(H2)为1.5mol·L-1,c(CO)为1mol·L-1,c(H2O)为3mol·L-1,此时反应向
(3)工业上从废铅蓄电池废液回收铅的过程中,常用纯碱溶液与处理后的铅膏(主要含PbSO4)发生反应:PbSO4(s)+CO
 (aq)
(aq)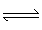 PbCO3(s)+SO
PbCO3(s)+SO ( aq)。
( aq)。已知溶度积常数:Ksp(PbSO4)=1.6×10-8,Ksp(PbCO3)=7.4×10-14,则该反应的化学平衡常数K=
Ⅱ.N2H4—O2燃料电池是一种高效低污染的新型电池,其装置如图所示:

(1)N2H4的电子式为
(2)a极的电极反应方程式为
您最近一年使用:0次



