1 .  催化重整对温室气体的减排具有重要意义,其反应为:
催化重整对温室气体的减排具有重要意义,其反应为: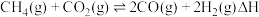 。回答下列问题:
。回答下列问题:
(1)已知相关物质的燃烧热(
 ):
):
则 催化重整反应的
催化重整反应的
_______  。
。
(2)将原料按初始组成
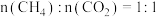 充入密闭容器中,保持体系压强为
充入密闭容器中,保持体系压强为
 发生反应。达到平衡时,
发生反应。达到平衡时,
 体积分数与温度的关系如图所示。
体积分数与温度的关系如图所示。
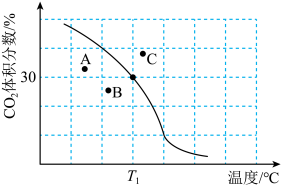
①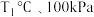 下,n(平衡时气体):n(初始气体)=
下,n(平衡时气体):n(初始气体)=_______ 。该温度下,此反应的平衡常数
_______  (以分压表示,分压=总压强×气体成分的物质的量分数。保留1位小数)。
(以分压表示,分压=总压强×气体成分的物质的量分数。保留1位小数)。
②若A、B、C三点表示不同温度和压强下达到平衡时 的体积分数,则
的体积分数,则_______ 点对应的平衡常数最小,理由是_______ 。
(3)其他条件相同,在不同催化剂(A、B)作用下,反应
 进行相同时间后,
进行相同时间后,
 的产率随反应温度的变化如图所示。
的产率随反应温度的变化如图所示。

①在催化剂A、B作用下,它们正、逆反应活化能差值分别用 表示,则
表示,则
_______  (填“>”“<”或“=”,下同)。
(填“>”“<”或“=”,下同)。
②y点对应的
_______ z点对应的 。
。
(4) 和
和
 都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示:
都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示:
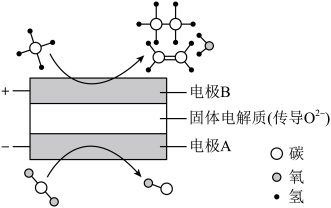
①阴极的电极反应式为_______ 。
②若生成的乙烯和乙烷的体积比为 ,则消耗的
,则消耗的 和
和 的体积比为
的体积比为_______ 。
 催化重整对温室气体的减排具有重要意义,其反应为:
催化重整对温室气体的减排具有重要意义,其反应为: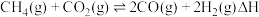 。回答下列问题:
。回答下列问题:(1)已知相关物质的燃烧热(
 ):
):| 物质 |  |  |  |
燃烧热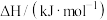 |  |  |  |
 催化重整反应的
催化重整反应的
 。
。(2)将原料按初始组成
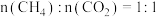 充入密闭容器中,保持体系压强为
充入密闭容器中,保持体系压强为 发生反应。达到平衡时,
发生反应。达到平衡时, 体积分数与温度的关系如图所示。
体积分数与温度的关系如图所示。
①
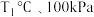 下,n(平衡时气体):n(初始气体)=
下,n(平衡时气体):n(初始气体)=
 (以分压表示,分压=总压强×气体成分的物质的量分数。保留1位小数)。
(以分压表示,分压=总压强×气体成分的物质的量分数。保留1位小数)。②若A、B、C三点表示不同温度和压强下达到平衡时
 的体积分数,则
的体积分数,则(3)其他条件相同,在不同催化剂(A、B)作用下,反应
 进行相同时间后,
进行相同时间后, 的产率随反应温度的变化如图所示。
的产率随反应温度的变化如图所示。
①在催化剂A、B作用下,它们正、逆反应活化能差值分别用
 表示,则
表示,则
 (填“>”“<”或“=”,下同)。
(填“>”“<”或“=”,下同)。②y点对应的

 。
。(4)
 和
和 都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示:
都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示:
①阴极的电极反应式为
②若生成的乙烯和乙烷的体积比为
 ,则消耗的
,则消耗的 和
和 的体积比为
的体积比为
您最近一年使用:0次
2023-10-29更新
|
681次组卷
|
4卷引用:广西北海市2024届高三一模考试化学试题
解题方法
2 . 柠檬酸是番茄中最常见的天然酸性物质,其分子结构简式为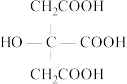 (用
(用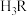 表示)。常温下,用
表示)。常温下,用 溶液滴定
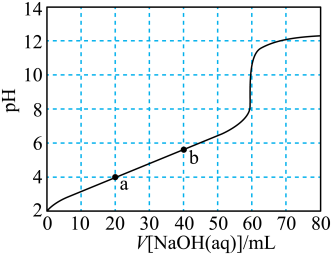
溶液滴定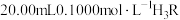 溶液的滴定曲线如图所示。已知常温下柠檬酸的电离常数为:
溶液的滴定曲线如图所示。已知常温下柠檬酸的电离常数为: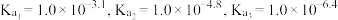 。下列叙述正确的是
。下列叙述正确的是
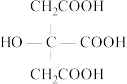 (用
(用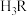 表示)。常温下,用
表示)。常温下,用 溶液滴定
溶液滴定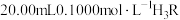 溶液的滴定曲线如图所示。已知常温下柠檬酸的电离常数为:
溶液的滴定曲线如图所示。已知常温下柠檬酸的电离常数为: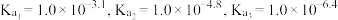 。下列叙述正确的是
。下列叙述正确的是
A.a点溶液中,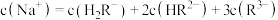 |
B.b点溶液中,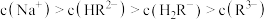 |
C.常温下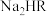 溶液加水稀释过程中, 溶液加水稀释过程中,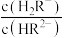 减小 减小 |
D.常温下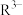 的水解常数为 的水解常数为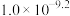 |
您最近一年使用:0次
解题方法
3 . 某实验小组同学用铜与浓硫酸反应制取SO2,验证SO2性质并制备NaHSO3,设计如图所示实验装置。
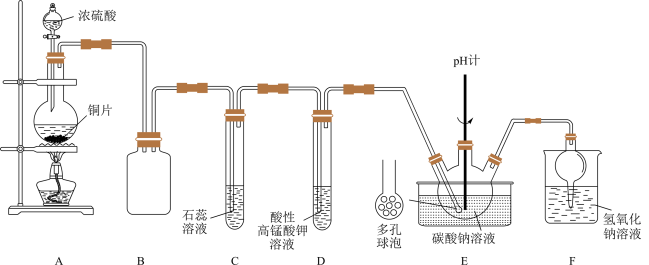
回答下列问题:
(1)C中的实验现象是_____ ,F的作用是_____ 。
(2)A中发生反应的化学方程式是_____ 。
(3)试管D中发生反应的离子方程式为_____ 。
(4)装置E中设计多孔球泡的目的是_____ 。
(5)向装置E中通入SO2可制得NaHSO3.已知:Na2SO3水溶液中H2SO3、HSO 、SO
、SO 随pH的分布如图1所示,Na2SO4的溶解度曲线如图2所示。
随pH的分布如图1所示,Na2SO4的溶解度曲线如图2所示。

①边搅拌边向Na2CO3溶液中通入SO2制备NaHSO3溶液。实验中确定何时停止通入SO2的实验操作为_____ 。
②请补充完整由NaHSO3溶液制备无水Na2SO3的实验方案:边搅拌边向NaHSO3溶液中滴加NaOH溶液,测量溶液pH,pH约为_____ 时,停止滴加NaOH溶液,加热浓缩溶液至有大量晶体析出,在高于_____ ℃条件下趁热过滤,用少量无水乙醇洗涤,干燥,密封包装。

回答下列问题:
(1)C中的实验现象是
(2)A中发生反应的化学方程式是
(3)试管D中发生反应的离子方程式为
(4)装置E中设计多孔球泡的目的是
(5)向装置E中通入SO2可制得NaHSO3.已知:Na2SO3水溶液中H2SO3、HSO
 、SO
、SO 随pH的分布如图1所示,Na2SO4的溶解度曲线如图2所示。
随pH的分布如图1所示,Na2SO4的溶解度曲线如图2所示。
①边搅拌边向Na2CO3溶液中通入SO2制备NaHSO3溶液。实验中确定何时停止通入SO2的实验操作为
②请补充完整由NaHSO3溶液制备无水Na2SO3的实验方案:边搅拌边向NaHSO3溶液中滴加NaOH溶液,测量溶液pH,pH约为
您最近一年使用:0次
4 . 有机物A是有机化学工业的基本原料,其产量可以用来衡量一个国家石油化学工业的发展水平。B和D都是日常生活中常见的有机物,E是一种油状、有香味的物质。下图为部分有机物间的转化关系:

回答下列问题:
(1)B的结构简式为_____ ,D中含氧官能团的名称为_____ 。
(2)①丙烯(CH3CH=CH2)在催化剂、加热条件下与O2反应可生成一种重要的化工原料丙烯酸(H2C=CHCOOH)。下列关于丙烯酸的说法正确的是_____ (填字母)。
a.可用酸性KMnO4溶液鉴别乙烯和丙烯酸
b.能发生加成反应,取代反应、中和反应
c.H2C=CHCOOH与OHC-CH2-CHO互为同分异构体
d.一定条件下能发生加聚反应生成
②写出反应⑤的化学方程式:_____ 。
(3)反应③的化学方程式为_____ 。某实验小组用下列装置模拟上述反应③的转化过程:

实验过程中,铜网的颜色变化为_____ 。甲和乙两个水浴作用不相同,甲的作用是_____ (填“加热”或“冷却”)。

回答下列问题:
(1)B的结构简式为
(2)①丙烯(CH3CH=CH2)在催化剂、加热条件下与O2反应可生成一种重要的化工原料丙烯酸(H2C=CHCOOH)。下列关于丙烯酸的说法正确的是
a.可用酸性KMnO4溶液鉴别乙烯和丙烯酸
b.能发生加成反应,取代反应、中和反应
c.H2C=CHCOOH与OHC-CH2-CHO互为同分异构体
d.一定条件下能发生加聚反应生成

②写出反应⑤的化学方程式:
(3)反应③的化学方程式为

实验过程中,铜网的颜色变化为
您最近一年使用:0次
名校
5 . 许多配合物都是用 作配位体的,如
作配位体的,如 溶于氨水可以形成
溶于氨水可以形成 。下列有关
。下列有关 的说法正确的是
的说法正确的是
 作配位体的,如
作配位体的,如 溶于氨水可以形成
溶于氨水可以形成 。下列有关
。下列有关 的说法正确的是
的说法正确的是A. 中 中 键的数目为 键的数目为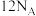 |
B. 中 中 的键角小于 的键角小于 中的键角 中的键角 |
C.由于 是配合物,故向其中滴加 是配合物,故向其中滴加 溶液不会产生沉淀 溶液不会产生沉淀 |
D. 中任意两个 中任意两个 被两个Cl取代,只有一种产物,则 被两个Cl取代,只有一种产物,则 的空间结构为正四面体 的空间结构为正四面体 |
您最近一年使用:0次
2023-06-04更新
|
224次组卷
|
6卷引用:广西北海市2022-2023学年高二下学期期末检测化学(B卷)试题
解题方法
6 . 铜及其化合物是生活、生产中运用广泛的材料。
(1)铜元素在周期表中的位置是___________ ,基态 原子核外电子占据最高能层的符号是
原子核外电子占据最高能层的符号是___________ 。
(2)合成氨工业常用醋酸二氨合铜(I){ }溶液吸收对氨合成的催化剂有毒害作用的
}溶液吸收对氨合成的催化剂有毒害作用的 。
。
① 中存在的化学键类型有
中存在的化学键类型有___________ 。
② 的沸点比
的沸点比 的沸点
的沸点___________ ,原因是___________ 。 的键角小于
的键角小于 的键角,原因是
的键角,原因是___________ 。
(3)晶胞的两个基本要素。
①原子坐标参数:晶胞内部各微粒的相对位置。 的晶胞结构如图所示,其中原子坐标参数:A
的晶胞结构如图所示,其中原子坐标参数:A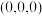 ;B
;B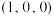 ;C
;C 。则
。则 处微粒的坐标参数为
处微粒的坐标参数为___________ 。
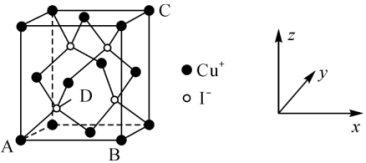
②晶胞参数:描述晶胞的大小和形状。若晶胞的边长为 ,则
,则 与
与 的最短距离为
的最短距离为___________  ,设
,设 为阿伏加德罗常数的值,该化合物的密度为
为阿伏加德罗常数的值,该化合物的密度为___________ (用含 、
、 的代数式表示)
的代数式表示) 。
。
(1)铜元素在周期表中的位置是
 原子核外电子占据最高能层的符号是
原子核外电子占据最高能层的符号是(2)合成氨工业常用醋酸二氨合铜(I){
 }溶液吸收对氨合成的催化剂有毒害作用的
}溶液吸收对氨合成的催化剂有毒害作用的 。
。①
 中存在的化学键类型有
中存在的化学键类型有②
 的沸点比
的沸点比 的沸点
的沸点 的键角小于
的键角小于 的键角,原因是
的键角,原因是(3)晶胞的两个基本要素。
①原子坐标参数:晶胞内部各微粒的相对位置。
 的晶胞结构如图所示,其中原子坐标参数:A
的晶胞结构如图所示,其中原子坐标参数:A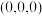 ;B
;B ;C
;C 。则
。则 处微粒的坐标参数为
处微粒的坐标参数为
②晶胞参数:描述晶胞的大小和形状。若晶胞的边长为
 ,则
,则 与
与 的最短距离为
的最短距离为 ,设
,设 为阿伏加德罗常数的值,该化合物的密度为
为阿伏加德罗常数的值,该化合物的密度为 、
、 的代数式表示)
的代数式表示) 。
。
您最近一年使用:0次
7 . 设计如下实验装置制备硫代硫酸钠晶体(Na2S2O3·5H2O)(夹持仪器略),总反应为2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2.已知硫代硫酸钠晶体在中性或碱性溶液中较稳定,酸性溶液中产生浑浊。
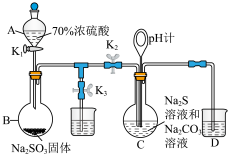
(1)仪器A的名称为___________ ,烧瓶B中制备SO2的化学方程式为___________ ,A中使用浓硫酸的质量分数为70%的原因是___________ 。
(2)Na2S2O3的制备:先组装好仪器,然后检验装置的气密性,将所需药品加入各仪器装置;打开K2,关闭K3,调节K1使硫酸缓缓滴下,导管口有气泡冒出,pH计读数逐渐减小,当pH计读数接近7时,必须立即打开K3,关闭K1、K2,原因是___________ (用离子方程式解释)。
(3)充分反应后,将C中溶液经过一系列操作可得硫代硫酸钠晶体。准确称取7.00g产品,溶于蒸馏水配成100.00 mL,溶液,取20.00 mL注入锥形瓶,以淀粉作指示剂,用0.10 mol/L标准碘溶液滴定。已知:2S2O +I2(aq)=S4O
+I2(aq)=S4O 后(无色)+2I-(aq)。
后(无色)+2I-(aq)。
①标准碘溶液应盛放在___________ (填“酸式”或“碱式”)滴定管中。
②第一次滴定开始和结束时,滴定管中的液面如图,则消耗标准碘溶液的体积为___________ mL。
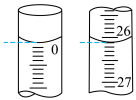
③重复上述操作三次,记录另两次数据如表中所示,则产品中Na2S2O3·5H2O(M=248 g·mol-1)的质量分数为___________ %。
(4)Na2S2O3有还原性,可作脱氯剂。向Na2S2O3溶液中通入少量Cl2,预测S2O 转变为SO
转变为SO ,设计实验方案验证该预测:取少量反应后的溶液于试管中,
,设计实验方案验证该预测:取少量反应后的溶液于试管中,___________ 。

(1)仪器A的名称为
(2)Na2S2O3的制备:先组装好仪器,然后检验装置的气密性,将所需药品加入各仪器装置;打开K2,关闭K3,调节K1使硫酸缓缓滴下,导管口有气泡冒出,pH计读数逐渐减小,当pH计读数接近7时,必须立即打开K3,关闭K1、K2,原因是
(3)充分反应后,将C中溶液经过一系列操作可得硫代硫酸钠晶体。准确称取7.00g产品,溶于蒸馏水配成100.00 mL,溶液,取20.00 mL注入锥形瓶,以淀粉作指示剂,用0.10 mol/L标准碘溶液滴定。已知:2S2O
 +I2(aq)=S4O
+I2(aq)=S4O 后(无色)+2I-(aq)。
后(无色)+2I-(aq)。①标准碘溶液应盛放在
②第一次滴定开始和结束时,滴定管中的液面如图,则消耗标准碘溶液的体积为

③重复上述操作三次,记录另两次数据如表中所示,则产品中Na2S2O3·5H2O(M=248 g·mol-1)的质量分数为
| 滴定次输 | 滴定前/mL | 滴定后/mL |
| 第二次 | 1.56 | 30.30 |
| 第三次 | 0.22 | 26.34 |
(4)Na2S2O3有还原性,可作脱氯剂。向Na2S2O3溶液中通入少量Cl2,预测S2O
 转变为SO
转变为SO ,设计实验方案验证该预测:取少量反应后的溶液于试管中,
,设计实验方案验证该预测:取少量反应后的溶液于试管中,
您最近一年使用:0次
8 . 在催化剂作用下H2(g)可将烟气中的SO2(g)还原成S(s)。回答下列问题:
(1)已知:
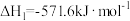

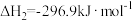
则H2(g)还原烟气中的SO2(g)的热化学方程式为___________ 。
(2)在容积为10L的容器中充入1mol SO2(g)与2mol H2(g)的混合气体,发生反应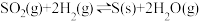
 。
。
①恒容时,反应经过4s后达到平衡,此时测得H2O(g)的物质的量为1.2mol。则0~4s内,v(H2)=___________ mol/(L·s),平衡时,c(SO2)=___________ mol/L;若平衡后升高温度,SO2的转化率将___________ (填“增 大”“减小”或“不变”)。
②恒温时,压强p与SO2的平衡转化率α如图所示,该温度下,该反应的平衡常数K=___________ L/mol;平衡状态由A变到B,平衡常数K(A) ___________ (填“>”“<”或“=”)K(B)。
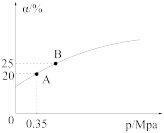
③若在恒温恒容密闭容器中发生上述反应,下列可作为该反应达到平衡状态的标志是___________ (填标号)。
A.压强不再变化
B.密度不再变化
C.气体的平均相对分子质量不再变化
D.SO2的消耗速率与H2的消耗速率之比为1∶2
(1)已知:

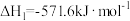

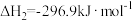
则H2(g)还原烟气中的SO2(g)的热化学方程式为
(2)在容积为10L的容器中充入1mol SO2(g)与2mol H2(g)的混合气体,发生反应
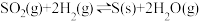
 。
。①恒容时,反应经过4s后达到平衡,此时测得H2O(g)的物质的量为1.2mol。则0~4s内,v(H2)=
②恒温时,压强p与SO2的平衡转化率α如图所示,该温度下,该反应的平衡常数K=

③若在恒温恒容密闭容器中发生上述反应,下列可作为该反应达到平衡状态的标志是
A.压强不再变化
B.密度不再变化
C.气体的平均相对分子质量不再变化
D.SO2的消耗速率与H2的消耗速率之比为1∶2
您最近一年使用:0次
2021-11-02更新
|
551次组卷
|
4卷引用:广西北海市2021-2022学年高三上学期第一次化学模拟考试理综化学试题
名校
9 . 常温下, 的二元酸
的二元酸 的溶液与等浓度的
的溶液与等浓度的 溶液等体积混合(忽略混合后体积的变化),所得溶液中
溶液等体积混合(忽略混合后体积的变化),所得溶液中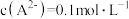 。则混合溶液的
。则混合溶液的 为
为
 的二元酸
的二元酸 的溶液与等浓度的
的溶液与等浓度的 溶液等体积混合(忽略混合后体积的变化),所得溶液中
溶液等体积混合(忽略混合后体积的变化),所得溶液中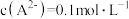 。则混合溶液的
。则混合溶液的 为
为| A.1 | B.2 | C.3 | D.无法计算 |
您最近一年使用:0次
2021-01-05更新
|
702次组卷
|
16卷引用:广西北海市2020-2021学年高二下学期期末教学质量检测化学试题
广西北海市2020-2021学年高二下学期期末教学质量检测化学试题安徽省名校2020-2021学年高二上学期12月联考化学试题河南省九师联盟2020-2021学年高二上学期1月联考化学试题河南省顶尖名校联盟2020-2021学年高二12月联考化学试题湖南省长沙市雅礼中学2020-2021学年高二下学期开学考化学试题河南省洛阳市豫西名校2021-2022学年高二上学期第一次联考化学试题山西省运城市康杰中学2021-2022学年高二上学期期中化学试题山西省三重教育2021-2022学年高二上学期名校联考化学试题 湖南省临澧县第一中学2021-2022学年高二上学期期中段考化学试题湖南省常德市临澧县第一中学2021-2022学年高二上学期期中考试化学试题山西省运城市康杰中学2021-2022学年高二上学期期末考试化学试题辽宁省营口开发区第一高级中学2022-2023学年高二上学期11月月考化学试题内蒙古兴安盟乌兰浩特市第一中学2022-2023学年高二上学期期中考试化学试题山西省太原师范学院附属中学2022-2023学年高二上学期12月月考化学试题黑龙江省绥化市绥棱县第一中学2022-2023学年高二上学期期中考试化学试题辽宁省本溪市第一中学2022-2023学年高二上学期期末考试化学试题
解题方法
10 . 点击化学的代表反应为铜催化的叠氮-炔基Husigen环加成反应,NaN3、SO2F2、FSO2N2等均是点击化学中常用无机试剂。回答下列问题:
(1)基态Cu原子价电子排布式为___________ ;基态N原子未成对电子有___________ 个。
(2)F、O、N的电负性从小到大的顺序是___________ 。
(3)SO2F2中硫原子价层电子对数目为___________ ;SO2F2的沸点比FSO2N3的低,其主要原因是___________ 。
(4)NaN3是HN3的钠盐,下列有关HN3说法正确的是___________ (填字母)。
a.HN3分子呈直线型 b.HN3分子间存在氢键
c.HN3中氮原子杂化方式只有sp d.HN3与HOCN互为等电子体
(5)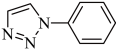 是一种叠氮-炔基Husigen环加成反应产物,每个该分子中含有
是一种叠氮-炔基Husigen环加成反应产物,每个该分子中含有___________ 个σ键。
(6)CuBr是点击化学常用的催化剂,其晶胞结构如图所示,晶胞参数为a pm。
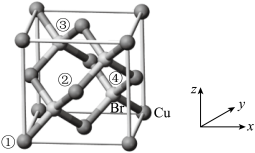
已知①、②号铜原子坐标依次为(0,0,0)、( ,0,
,0, ),则③号溴原子的坐标为
),则③号溴原子的坐标为___________ ;设NA为阿伏加德罗常数的值,CuBr的密度为___________ g·cm-3(列出计算式)。
(1)基态Cu原子价电子排布式为
(2)F、O、N的电负性从小到大的顺序是
(3)SO2F2中硫原子价层电子对数目为
(4)NaN3是HN3的钠盐,下列有关HN3说法正确的是
a.HN3分子呈直线型 b.HN3分子间存在氢键
c.HN3中氮原子杂化方式只有sp d.HN3与HOCN互为等电子体
(5)
 是一种叠氮-炔基Husigen环加成反应产物,每个该分子中含有
是一种叠氮-炔基Husigen环加成反应产物,每个该分子中含有(6)CuBr是点击化学常用的催化剂,其晶胞结构如图所示,晶胞参数为a pm。

已知①、②号铜原子坐标依次为(0,0,0)、(
 ,0,
,0, ),则③号溴原子的坐标为
),则③号溴原子的坐标为
您最近一年使用:0次



