1 . 某化学小组同学对FeCl3溶液与Na2SO3溶液的反应进行探究
(1)请用离子方程式表示Na2SO3溶液显碱性的原因___________ 。
(2)甲同学认为实验①发生了氧化还原,其反应的离子方程式为___________ ,取反应后的溶液中加入K3[Fe(CN)6]溶液,观察到___________ (填现象),证实了此结论。
(3)乙同学检验红褐色沉淀为Fe(OH)3,请用平衡移动原理解释生成沉淀的原因___________ 。
(4)丙组同学检验实验②中无Fe2+,为探究此浓度下是否能发生氧化还原反应,做了如下实验:向U形管的左侧加入___________ ,观察到___________ (填实验现象),证实此浓度下的FeCl3溶液与Na2SO3溶液可以发生氧化还原反应。 可形成难电离的红色配合物:
可形成难电离的红色配合物: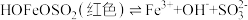 。请解释实验②中无Fe2+生成的原因
。请解释实验②中无Fe2+生成的原因___________ 。
(6)通过以上探究,FeCl3溶液与Na2SO3溶液的反应受___________ 因素影响(至少写出两项)。
| 实验操作 | 现象 | |
| ① |
| 溶液由棕黄色变为红色,无沉淀生成。 放置6小时后,溶液变为淡黄色,始终无沉淀生成。 |
② |
| 溶液由棕黄色变为红色,无沉淀生成。 放置6小时后,生成红褐色沉淀,上层清液为无色。 |
(1)请用离子方程式表示Na2SO3溶液显碱性的原因
(2)甲同学认为实验①发生了氧化还原,其反应的离子方程式为
(3)乙同学检验红褐色沉淀为Fe(OH)3,请用平衡移动原理解释生成沉淀的原因
(4)丙组同学检验实验②中无Fe2+,为探究此浓度下是否能发生氧化还原反应,做了如下实验:向U形管的左侧加入
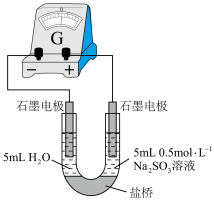
 可形成难电离的红色配合物:
可形成难电离的红色配合物: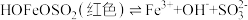 。请解释实验②中无Fe2+生成的原因
。请解释实验②中无Fe2+生成的原因(6)通过以上探究,FeCl3溶液与Na2SO3溶液的反应受
您最近一年使用:0次
解题方法
2 . 一种超导材料(仅由 、
、 、F三种元素组成)的长方体晶胞结构如图所示(已知
、F三种元素组成)的长方体晶胞结构如图所示(已知 ),下列说法错误的是
),下列说法错误的是
 、
、 、F三种元素组成)的长方体晶胞结构如图所示(已知
、F三种元素组成)的长方体晶胞结构如图所示(已知 ),下列说法错误的是
),下列说法错误的是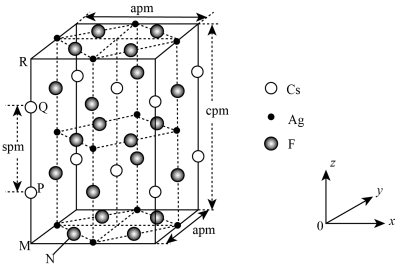
A.基态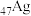 位于元素周期表的 位于元素周期表的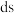 区 区 |
B.若N点原子分数坐标为 ,则P点原子分数坐标为 ,则P点原子分数坐标为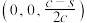 |
C.M、N之间的距离为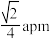 |
D.该晶体最简化学式为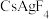 |
您最近一年使用:0次
2024-04-01更新
|
486次组卷
|
4卷引用:广西钦州市第四中学2023-2024学年高二下学期3月考试化学试卷
广西钦州市第四中学2023-2024学年高二下学期3月考试化学试卷2024届湖南省岳阳市高三下学期第二次教学质量监测(二模)化学试题(已下线)提升练01 晶体结构及相关计算-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)(已下线)压轴题10?晶体结构及相关计算(5大题型+方法总结+压轴题速练)-2024年高考化学压轴题专项训练(新高考通用)
名校
解题方法
3 .  晶体中,
晶体中,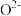 围成正四面体空隙(1、3、6、7号氧围成)和正八面体空隙3、6、7、8、9、12号氧围成),
围成正四面体空隙(1、3、6、7号氧围成)和正八面体空隙3、6、7、8、9、12号氧围成), 中有一半的
中有一半的 填充在正四面体空隙中,
填充在正四面体空隙中, 和另一半
和另一半 填充在正八面体空隙中,下列有关说法错误的是
填充在正八面体空隙中,下列有关说法错误的是
 晶体中,
晶体中,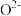 围成正四面体空隙(1、3、6、7号氧围成)和正八面体空隙3、6、7、8、9、12号氧围成),
围成正四面体空隙(1、3、6、7号氧围成)和正八面体空隙3、6、7、8、9、12号氧围成), 中有一半的
中有一半的 填充在正四面体空隙中,
填充在正四面体空隙中, 和另一半
和另一半 填充在正八面体空隙中,下列有关说法错误的是
填充在正八面体空隙中,下列有关说法错误的是
A.若1、3、6、7号氧围成的正四面体空隙填充有 ,则8、9、12、14号氧围成的正四面体空隙也填充有 ,则8、9、12、14号氧围成的正四面体空隙也填充有 |
B.晶体中正四面体空隙数与正八面体空隙数之比为 |
C.若1、3、6、7号氧围成的正四面体空隙填充有 ,设立方体的棱长为1,11号 ,设立方体的棱长为1,11号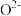 坐标为 坐标为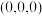 则该 则该 的坐标为 的坐标为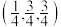 |
D.若立方体棱长为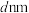 ,则晶体密度计算式为 ,则晶体密度计算式为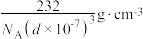 |
您最近一年使用:0次
2024-03-17更新
|
1073次组卷
|
6卷引用:广西钦州市第四中学2023-2024学年高二下学期3月考试化学试卷
广西钦州市第四中学2023-2024学年高二下学期3月考试化学试卷重庆市七校联盟2023-2024学年高三下学期第一次月考化学试题辽宁省沈阳市东北育才学校高中部2023-2024学年高二下学期第1次月考化学试题(已下线)提升练01 晶体结构及相关计算-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)福建省泉州实验中学2023-2024学年高二下学期3月月考化学试题福建省泉州市永春第一中学2023-2024学年高二下学期4月期中考试化学试题
名校
解题方法
4 . 科学工作者发现了一种光解水的催化剂,其晶胞结构如图所示,已知晶胞参数为a pm,设 为阿伏加德罗常数的值。下列说法中错误的是
为阿伏加德罗常数的值。下列说法中错误的是
 为阿伏加德罗常数的值。下列说法中错误的是
为阿伏加德罗常数的值。下列说法中错误的是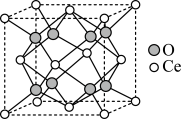
| A.O位于由Ce构成的四面体空隙中 |
| B.Ce在晶胞中的配位数为8 |
C.Ce与Ce最近的距离为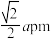 |
D.该晶体的摩尔体积 |
您最近一年使用:0次
2024-03-15更新
|
1415次组卷
|
8卷引用:广西钦州市第四中学2023-2024学年高二下学期3月考试化学试卷
广西钦州市第四中学2023-2024学年高二下学期3月考试化学试卷山东省聊城市2023-2024学年高三下学期一模化学试题 2024届河南省郑州市宇华实验学校高三下学期二模化学试题(已下线)题型5 物质结构与性质 有机物的结构与性质(25题)-2024年高考化学常考点必杀300题(新高考通用)北京市大兴区第一中学2023-2024学年高二下学期期中考试化学试题山东省泰安市新泰市第一中学北校2023-2024学年高二下学期第一次阶段考试化学试题(已下线)压轴题10?晶体结构及相关计算(5大题型+方法总结+压轴题速练)-2024年高考化学压轴题专项训练(新高考通用)山东省聊城市2024年高考模拟试题(一) 化学
5 .  是一种高效、安全消毒剂。目前已开发出多种电解法制取
是一种高效、安全消毒剂。目前已开发出多种电解法制取 气体的新工艺,方法一:如图乙,电解精制饱和食盐水制取
气体的新工艺,方法一:如图乙,电解精制饱和食盐水制取 ;方法二:如图丙,电极上通入
;方法二:如图丙,电极上通入 
 酸性溶液中电解
酸性溶液中电解 制取
制取 。某浓差电池的示意图如图丁,该电池既能提供电能,又能产生产生多种化学品。
。某浓差电池的示意图如图丁,该电池既能提供电能,又能产生产生多种化学品。
(1)图甲中,操作Ⅰ、Ⅱ为_______ ,试剂 Ⅱ为_______ (填化学式)
(2)图乙中,电解精制饱和食盐水产生 的电极反应式为
的电极反应式为________ ;电解一段时间,若有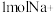 通过离子交换膜,在电极A上产生的气体体积(标准状况)为
通过离子交换膜,在电极A上产生的气体体积(标准状况)为______ L。
(3)图丙中,阴极电极反应式为_______ ;电解一段时间后,阴极区(溶液体积变化忽略不计 溶液的 pH
溶液的 pH______ (填“变大”、“变小”、“不变”)
(4)若以图丁所示电池作图乙的电源,则 a端与______ 相连(填 “e”或 “f”),图乙中阳极的另一产物可不断补充到图丁的正极区,该物质是_______ (填化学式)
(5)工业生产中,还可以用酸性 溶液还原
溶液还原 制得
制得 ,则每生成0.2mol
,则每生成0.2mol ,转移电子的数目为
,转移电子的数目为___________ 。
 是一种高效、安全消毒剂。目前已开发出多种电解法制取
是一种高效、安全消毒剂。目前已开发出多种电解法制取 气体的新工艺,方法一:如图乙,电解精制饱和食盐水制取
气体的新工艺,方法一:如图乙,电解精制饱和食盐水制取 ;方法二:如图丙,电极上通入
;方法二:如图丙,电极上通入 
 酸性溶液中电解
酸性溶液中电解 制取
制取 。某浓差电池的示意图如图丁,该电池既能提供电能,又能产生产生多种化学品。
。某浓差电池的示意图如图丁,该电池既能提供电能,又能产生产生多种化学品。
(1)图甲中,操作Ⅰ、Ⅱ为
(2)图乙中,电解精制饱和食盐水产生
 的电极反应式为
的电极反应式为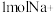 通过离子交换膜,在电极A上产生的气体体积(标准状况)为
通过离子交换膜,在电极A上产生的气体体积(标准状况)为(3)图丙中,阴极电极反应式为
 溶液的 pH
溶液的 pH(4)若以图丁所示电池作图乙的电源,则 a端与
(5)工业生产中,还可以用酸性
 溶液还原
溶液还原 制得
制得 ,则每生成0.2mol
,则每生成0.2mol ,转移电子的数目为
,转移电子的数目为
您最近一年使用:0次
2024-01-22更新
|
162次组卷
|
2卷引用:广西钦州市第四中学2023-2024学年高二上学期1月考试化学试卷
6 . 根据下列物质:① ②
② ③
③ 溶液 ④冰醋酸⑤CO2 ⑥Mg ⑦CaO ⑧
溶液 ④冰醋酸⑤CO2 ⑥Mg ⑦CaO ⑧ 晶体,回答下列有关问题:
晶体,回答下列有关问题:
(1)以上物质中属于强电解质的是________ (填编号)
(2)常温,测得 中
中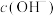 为
为 ,则
,则 在该温度下的电离常数
在该温度下的电离常数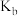 约为
约为___________ (结果保留一位小数)
(3)常温, ,下列有关说法正确的是_________。
,下列有关说法正确的是_________。
(4)室温下,将三支装入含酚酞的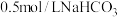 溶液的试管分别放在盛水的烧杯中,然后在甲烧杯试管中加入
溶液的试管分别放在盛水的烧杯中,然后在甲烧杯试管中加入 晶体,在乙烧杯中加入CaO。写出
晶体,在乙烧杯中加入CaO。写出 溶液中碳元素的守恒关系式:
溶液中碳元素的守恒关系式:___________ ;一段时间后,甲烧杯试管中溶液颜色___________ (填“变深”、“变浅”、“不变”);结合方程式解释乙烧杯中加CaO后其试管内颜色变化的原因:__________ 。
(5)将1g 溶于100mL蒸馏水,测定电导率随时间的变化,当电导率不变时,再加入10mL蒸馏水(加水过程,
溶于100mL蒸馏水,测定电导率随时间的变化,当电导率不变时,再加入10mL蒸馏水(加水过程, 始终未完全溶解),观察电导率的变化,重复操作,绘图如下:
始终未完全溶解),观察电导率的变化,重复操作,绘图如下:
 ②
② ③
③ 溶液 ④冰醋酸⑤CO2 ⑥Mg ⑦CaO ⑧
溶液 ④冰醋酸⑤CO2 ⑥Mg ⑦CaO ⑧ 晶体,回答下列有关问题:
晶体,回答下列有关问题:(1)以上物质中属于强电解质的是
(2)常温,测得
 中
中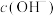 为
为 ,则
,则 在该温度下的电离常数
在该温度下的电离常数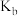 约为
约为(3)常温,
 ,下列有关说法正确的是_________。
,下列有关说法正确的是_________。| A.向冰醋酸中加水,溶液的导电能力先增大后减小 |
B.向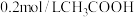 溶液中加水稀释, 溶液中加水稀释, 增大 增大 |
C.等温等浓度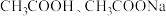 混合溶液中: 混合溶液中: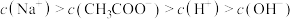 |
D.pH为3的 溶液中,水电离的 溶液中,水电离的 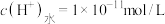 |
(4)室温下,将三支装入含酚酞的
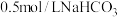 溶液的试管分别放在盛水的烧杯中,然后在甲烧杯试管中加入
溶液的试管分别放在盛水的烧杯中,然后在甲烧杯试管中加入 晶体,在乙烧杯中加入CaO。写出
晶体,在乙烧杯中加入CaO。写出 溶液中碳元素的守恒关系式:
溶液中碳元素的守恒关系式:(5)将1g
 溶于100mL蒸馏水,测定电导率随时间的变化,当电导率不变时,再加入10mL蒸馏水(加水过程,
溶于100mL蒸馏水,测定电导率随时间的变化,当电导率不变时,再加入10mL蒸馏水(加水过程, 始终未完全溶解),观察电导率的变化,重复操作,绘图如下:
始终未完全溶解),观察电导率的变化,重复操作,绘图如下: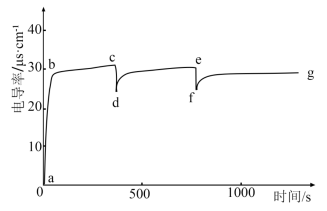
| A.c、e点电导率相等 |
| B.d、f点为饱和溶液 |
C.b→c电导率基本不变的原因是 到溶解平衡 到溶解平衡 |
| D.g点再加10mL蒸馏水可重复c→d、e→f图像 |
您最近一年使用:0次
2024-01-22更新
|
105次组卷
|
2卷引用:广西钦州市第四中学2023-2024学年高二上学期1月考试化学试卷
7 . 一定温度下, 和
和 的沉淀溶解平衡曲线如图所示
的沉淀溶解平衡曲线如图所示
 和
和 的沉淀溶解平衡曲线如图所示
的沉淀溶解平衡曲线如图所示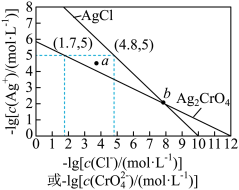
A.a点条件下能生成 沉淀,不能生成 沉淀,不能生成 沉淀 沉淀 |
B.b点时,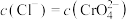 , ,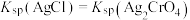 |
C.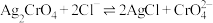 的平衡常数 的平衡常数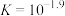 |
D.向 、 、 的混合溶液中滴加 的混合溶液中滴加 溶液,一定先产生 溶液,一定先产生 沉淀 沉淀 |
您最近一年使用:0次
2024-01-20更新
|
178次组卷
|
2卷引用:广西钦州市第四中学2023-2024学年高二上学期1月考试化学试卷
名校
解题方法
8 . 常温下,用浓度为 的
的 标准溶液滴定浓度均为
标准溶液滴定浓度均为 的
的 和
和 的混合溶液,滴定过程中溶液的pH随
的混合溶液,滴定过程中溶液的pH随 (
(
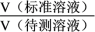 )的变化曲线如图所示。下列说法正确的是
)的变化曲线如图所示。下列说法正确的是

A.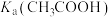 的数量级为 的数量级为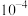 |
B.点a: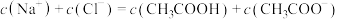 |
C.点b: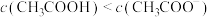 |
| D.水的电离程度:a<b<c<d |
您最近一年使用:0次
2024-01-20更新
|
116次组卷
|
2卷引用:广西钦州市第四中学2023-2024学年高二上学期1月考试化学试卷
名校
解题方法
9 . 在恒压、NO和 的起始浓度一定的条件下,催化反应相同时间,测得不同温度下NO转化为
的起始浓度一定的条件下,催化反应相同时间,测得不同温度下NO转化为 的转化率如图中实线所示。下列说法正确的是
的转化率如图中实线所示。下列说法正确的是
 的起始浓度一定的条件下,催化反应相同时间,测得不同温度下NO转化为
的起始浓度一定的条件下,催化反应相同时间,测得不同温度下NO转化为 的转化率如图中实线所示。下列说法正确的是
的转化率如图中实线所示。下列说法正确的是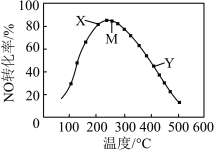
A.反应 的 的 |
| B.M点的转化率一定是平衡转化率 |
| C.图中X点所示条件下,延长反应时间能提高NO转化率 |
D.图中Y点所示条件下,增加 的浓度不能提高NO转化率 的浓度不能提高NO转化率 |
您最近一年使用:0次
2024-01-20更新
|
102次组卷
|
2卷引用:广西钦州市第四中学2023-2024学年高二上学期1月考试化学试卷
名校
解题方法
10 . 下列方程式书写正确的是
A.往饱和Na2CO3溶液中通入足量CO2: +CO2+H2O=2 +CO2+H2O=2 |
| B.鸡蛋壳(主要含CaCO3)浸泡在食醋中:CaCO3+ 2CH3COOH=(CH3COO)2Ca+CO2↑+ H2O |
C.足量NaHSO4溶液中加入MgO固体:MgO+2H++ =MgSO4↓+H2O =MgSO4↓+H2O |
D.向氨化的饱和氯化钠溶液中通入少量二氧化碳:NH3+H2O+CO2+ Na+=NaHCO3↓+ |
您最近一年使用:0次
2024-01-05更新
|
270次组卷
|
2卷引用:广西钦州市第四中学2023-2024学年高一上学期10月考试化学试卷





