常温下,用浓度为 的
的 标准溶液滴定浓度均为
标准溶液滴定浓度均为 的
的 和
和 的混合溶液,滴定过程中溶液的pH随
的混合溶液,滴定过程中溶液的pH随 (
(
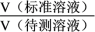 )的变化曲线如图所示。下列说法正确的是
)的变化曲线如图所示。下列说法正确的是

A.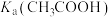 的数量级为 的数量级为 |
B.点a: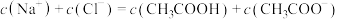 |
C.点b: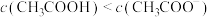 |
| D.水的电离程度:a<b<c<d |
更新时间:2024-01-20 16:53:51
|
相似题推荐
单选题
|
较难
(0.4)
名校
解题方法
【推荐1】25℃时,向20mL0.1mol/L 溶液中逐滴加入0.1mo/L NaOH溶液,滴入NaOH溶液的体积与溶液pH的变化关系如图所示。下列说法错误的是
溶液中逐滴加入0.1mo/L NaOH溶液,滴入NaOH溶液的体积与溶液pH的变化关系如图所示。下列说法错误的是

 溶液中逐滴加入0.1mo/L NaOH溶液,滴入NaOH溶液的体积与溶液pH的变化关系如图所示。下列说法错误的是
溶液中逐滴加入0.1mo/L NaOH溶液,滴入NaOH溶液的体积与溶液pH的变化关系如图所示。下列说法错误的是
| A.a点的pH>1 |
| B.c点时,V(NaOH)=20mL |
C.反应过程中 的值逐渐增大 的值逐渐增大 |
| D.a、b、c点溶液中,水的电离程度逐渐增大 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐2】常温下,用20mL0.1mol·L-1Na2SO3溶液吸收SO2气体。吸收液的pH与 的关系如图所示。下列说法不正确的是
的关系如图所示。下列说法不正确的是
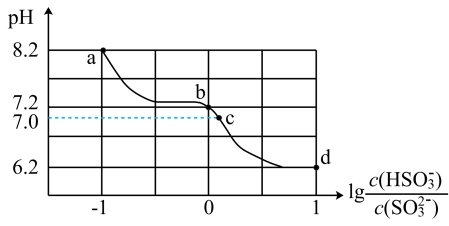
 的关系如图所示。下列说法不正确的是
的关系如图所示。下列说法不正确的是
| A.常温下,H2SO3的第二步电离常数为1.0×10-7.2 |
B.b点对应溶液中:c(Na+)>c(HSO )>c(OH-) )>c(OH-) |
C.c点对应溶液中:c(Na+)=c(HSO )+c(SO )+c(SO ) ) |
| D.通入SO2气体的过程中,水的电离平衡逆向移动 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐3】常温下,向10mL0.2mol/LH2C2O4溶液中滴加0.2mol/LKOH溶液,水电离出氢离子浓度c(H+)与加入氢氧化钾溶液的体积的变化如下图,已知常温下,H2C2O4的电离常数为:K1=5.0×10-2,K2=5.4×10-5,根据图示判断,下列说法不正确的是


| A.c点的溶液显碱性 |
| B.a点时,加入KOH溶液的体积V1=10mL |
| C.b点时,溶液中各粒子浓度的大小顺序为:c(K+)>c(C2O42-)>c(OH-)>c(HC2O4-)>c(H+) |
| D.当V(KOH)=15mL时,溶液中存在以下关系:2c(K+)=3c(C2O42-)+3c(HC2O4-)+3c(H2C2O4) |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐1】25℃时,向含有1 mol甘氨酸盐酸盐(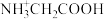 )的溶液中加入NaOH固体,溶液pH及体系中
)的溶液中加入NaOH固体,溶液pH及体系中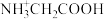 ,
, ,
,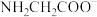 三种粒子的分布系数变化如图所示。
三种粒子的分布系数变化如图所示。 中
中 的分布系数:
的分布系数: ]
]
下列说法正确的是
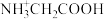 )的溶液中加入NaOH固体,溶液pH及体系中
)的溶液中加入NaOH固体,溶液pH及体系中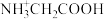 ,
, ,
,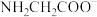 三种粒子的分布系数变化如图所示。
三种粒子的分布系数变化如图所示。
 中
中 的分布系数:
的分布系数: ]
]下列说法正确的是
A.a代表 |
| B.m点:pH小于2.35 |
C.n点溶液中 |
D.曲线上任意点溶液均存在: |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐2】向 的醋酸溶液中逐滴加入等物质的量浓度的烧碱溶液,测定混合溶液的温度变化如图所示。下列关于混合溶液的相关说法中正确的是
的醋酸溶液中逐滴加入等物质的量浓度的烧碱溶液,测定混合溶液的温度变化如图所示。下列关于混合溶液的相关说法中正确的是
 的醋酸溶液中逐滴加入等物质的量浓度的烧碱溶液,测定混合溶液的温度变化如图所示。下列关于混合溶液的相关说法中正确的是
的醋酸溶液中逐滴加入等物质的量浓度的烧碱溶液,测定混合溶液的温度变化如图所示。下列关于混合溶液的相关说法中正确的是
A.醋酸的电离平衡常数: |
| B.b点溶液呈中性 |
C.水的电离程度: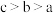 |
D.c点溶液中: |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐3】室温下,以下说法正确的是
| A.0.1 mol·L-1CH3COONa溶液和0.1 mol·L-1 HCl溶液等体积混合:c(Na+)= c(Cl—)>c(H+)>c(CH3COO-) |
| B.pH相等的CH3COONa、Na2CO3、NaHCO3三种溶液:c(Na2CO3)>c(NaHCO3)>c(CH3COONa) |
| C.Na2CO3溶液和 NaHCO3溶液等体积混合:2c(Na+) = 3c(CO32—) + 3c(HCO3—) + 3c(H2CO3) |
| D.0.1 mol·L-1 Na2C2O4溶液和0.1 mol·L-1 HCl溶液等体积混合(H2C2O4为二元弱酸):c(Na+)+ c(H+) = 2c(C2O42-) + c(HC2O4-) + c(OH-) |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐1】恒温25 ℃下,向一定量的0.1 mol·L-1的BOH溶液中逐滴滴入稀盐酸。溶液中水电离出的氢离子浓度的负对数[用pC表示,pC=-lgc(H+)水]与加入盐酸体积的关系如图所示。下列叙述错误的是( )


| A.BOH为弱碱且Kb的数量级为10-5 |
| B.b点溶液中:c(B+)=c(Cl-) |
| C.c点溶液中水的电离程度最大 |
| D.c~d点间溶液中:c(BOH)+c(OH-)>c(H+) |
您最近一年使用:0次
单选题
|
较难
(0.4)
解题方法
【推荐2】在某温度时,将n mol·L-1氨水滴入10mL1.0mol·L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示。下列有关说法不正确的是


| A.当氨水滴加至b点时,两者恰好反应 |
B.c点的离子大小关系为:c(Cl-)=c(NH )>c(H+)=c(OH-) )>c(H+)=c(OH-) |
| C.水的电离程度:c>b>a |
D.25℃时,NH3•H2O的电离平衡常数为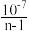 (用n表示) (用n表示) |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐3】下列说法正确的是
 常温下,强酸溶液的
常温下,强酸溶液的 ,将溶液的体积稀释到原来的
,将溶液的体积稀释到原来的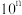 倍,则
倍,则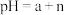
 已知
已知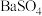 的
的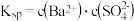 ,所以在
,所以在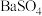 溶液中有
溶液中有
 将
将 的NaHS和
的NaHS和 的
的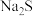 溶液等体积混合,所得溶液中有
溶液等体积混合,所得溶液中有
 在
在 氨水中滴加
氨水中滴加 盐酸,刚好完全中和时
盐酸,刚好完全中和时 ,由水电离产生的
,由水电离产生的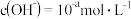 .
.

 常温下,强酸溶液的
常温下,强酸溶液的 ,将溶液的体积稀释到原来的
,将溶液的体积稀释到原来的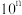 倍,则
倍,则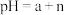
 已知
已知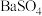 的
的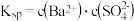 ,所以在
,所以在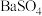 溶液中有
溶液中有
 将
将 的NaHS和
的NaHS和 的
的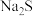 溶液等体积混合,所得溶液中有
溶液等体积混合,所得溶液中有
 在
在 氨水中滴加
氨水中滴加 盐酸,刚好完全中和时
盐酸,刚好完全中和时 ,由水电离产生的
,由水电离产生的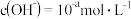 .
.A. | B. | C.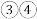 | D. |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐1】如图是草酸溶液中H2C2O4、HC2O4-、C2O42-三种微粒的分布分数(某微粒物质的量浓度与三种微粒物质的量浓度和的比值)与pH的关系,下列有关说法不正确的是

| A.pH=5 的溶液中c(C2O42-)>c(HC2O4-) |
| B.NaHC2O4溶液中:c(OH-)+c(C2O42-)=c(H+)+c(H2C2O4) |
| C.向NaHC2O4溶液中加强酸至pH与a点对应时,溶液中 2c(Na+)=c(HC2O4-)+ c(H2C2O4) |
| D.为使溶液中c(c(HC2O4-)尽可能多一些,溶液的pH最好控制在2.7左右 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐2】已知 。室温下,向20.00mL0.10mol·LCH3COOH溶液中逐滴滴加
。室温下,向20.00mL0.10mol·LCH3COOH溶液中逐滴滴加 溶液,溶液的pH与
溶液,溶液的pH与 的变化关系如图所示。下列说法正确的是
的变化关系如图所示。下列说法正确的是

 。室温下,向20.00mL0.10mol·LCH3COOH溶液中逐滴滴加
。室温下,向20.00mL0.10mol·LCH3COOH溶液中逐滴滴加 溶液,溶液的pH与
溶液,溶液的pH与 的变化关系如图所示。下列说法正确的是
的变化关系如图所示。下列说法正确的是
| A.x=2.75 |
B.水的电离程度: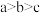 |
C.当 时,加入NaOH溶液的体积小于10.00mL 时,加入NaOH溶液的体积小于10.00mL |
D.当溶液加入10.00 mL NaOH溶液时: |
您最近一年使用:0次
单选题
|
较难
(0.4)
解题方法
【推荐3】电位滴定法是根据滴定过程中电极电位变化来判断滴定终点的一种滴定分析方法,滴定终点时电极电位发生突变。常温下,利用盐酸滴定某溶液中磷酸钠的含量,其电位滴定曲线与pH曲线如图所示。下列说法不正确的是
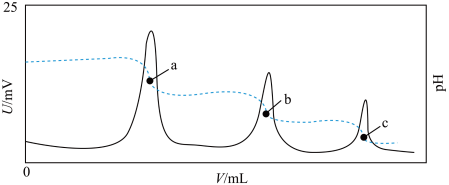
A.a点溶液中存在:c(Cl-)<c( )<c(OH-)<c(H+) )<c(OH-)<c(H+) |
B.b点对应的溶液中存在:c(H+)+c(H3PO4)=c(OH-)+c( )+2c( )+2c( ) ) |
C.c点对应的溶液中存在:c(H+)=c(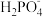 )+2c( )+2c( )+3c( )+3c( )+c(OH-) )+c(OH-) |
| D.水的电离程度:a>b |
您最近一年使用:0次



