解题方法
1 . 为了实现“碳达峰”和“碳中和”的。目标,将 转化成可利用的化学能源的负碳技术是世界各国关注的焦点。
转化成可利用的化学能源的负碳技术是世界各国关注的焦点。
方法一: 捕集
捕集 合成
合成 。
。
Ⅰ.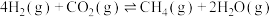


Ⅱ.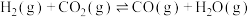


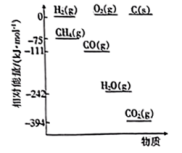
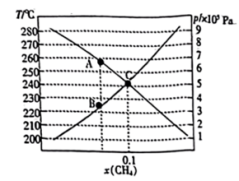
(1)相关物质相对能量大小如图所示,则 =
=___________  ,升高温度,
,升高温度,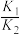
___________ (填“增大”或“减小”)。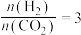 时,反应在不同条件下达到平衡,240℃时甲烷的物质的量分数
时,反应在不同条件下达到平衡,240℃时甲烷的物质的量分数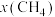 与压强p的变化关系、
与压强p的变化关系、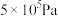 时
时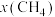 与温度T的变化关系如图所示,图中A、B两点对应的速率:
与温度T的变化关系如图所示,图中A、B两点对应的速率: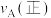
___________ (填“大于”、“小于”或“等于”)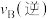 ;若C点
;若C点 与
与 的分压相同,则
的分压相同,则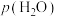 =
=___________  。
。 催化加氢制甲醇。
催化加氢制甲醇。
以 、
、 为原料合成
为原料合成 涉及的反应如下:
涉及的反应如下:
i.
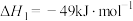
ii.
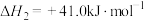
iii.

(3)一定温度和催化剂条件下,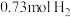 、
、 和
和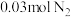 (已知
(已知 不参与反应)在总压强为
不参与反应)在总压强为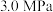 的密闭容器中进行上述反应,平衡时
的密闭容器中进行上述反应,平衡时 的转化率、
的转化率、 和
和 的选择性随温度的变化曲线如图所示。
的选择性随温度的变化曲线如图所示。___________ (填“ ”、“
”、“ ”或“
”或“ ”)的变化。
”)的变化。
②某温度下, 反应达到平衡,测得容器中
反应达到平衡,测得容器中 的体积分数为12.5%。此时用
的体积分数为12.5%。此时用 的分压表示0~t1时间内的反应速率
的分压表示0~t1时间内的反应速率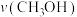 =
=___________  ;设此时
;设此时 ,该温度下反应ii的平衡常数
,该温度下反应ii的平衡常数
___________ 。(用含a的代数式表示)。【已知:分压=总压×该组分的物质的量分数;对于反应 ,
,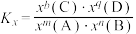 ,x为物质的量分数】
,x为物质的量分数】
 转化成可利用的化学能源的负碳技术是世界各国关注的焦点。
转化成可利用的化学能源的负碳技术是世界各国关注的焦点。方法一:
 捕集
捕集 合成
合成 。
。Ⅰ.
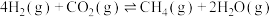


Ⅱ.
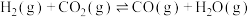


(1)相关物质相对能量大小如图所示,则
 =
= ,升高温度,
,升高温度,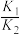
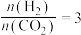 时,反应在不同条件下达到平衡,240℃时甲烷的物质的量分数
时,反应在不同条件下达到平衡,240℃时甲烷的物质的量分数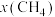 与压强p的变化关系、
与压强p的变化关系、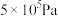 时
时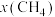 与温度T的变化关系如图所示,图中A、B两点对应的速率:
与温度T的变化关系如图所示,图中A、B两点对应的速率: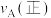
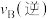 ;若C点
;若C点 与
与 的分压相同,则
的分压相同,则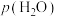 =
= 。
。
 催化加氢制甲醇。
催化加氢制甲醇。以
 、
、 为原料合成
为原料合成 涉及的反应如下:
涉及的反应如下:i.

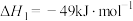
ii.

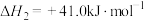
iii.


(3)一定温度和催化剂条件下,
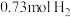 、
、 和
和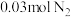 (已知
(已知 不参与反应)在总压强为
不参与反应)在总压强为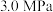 的密闭容器中进行上述反应,平衡时
的密闭容器中进行上述反应,平衡时 的转化率、
的转化率、 和
和 的选择性随温度的变化曲线如图所示。
的选择性随温度的变化曲线如图所示。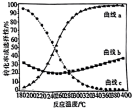
 ”、“
”、“ ”或“
”或“ ”)的变化。
”)的变化。②某温度下,
 反应达到平衡,测得容器中
反应达到平衡,测得容器中 的体积分数为12.5%。此时用
的体积分数为12.5%。此时用 的分压表示0~t1时间内的反应速率
的分压表示0~t1时间内的反应速率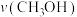 =
= ;设此时
;设此时 ,该温度下反应ii的平衡常数
,该温度下反应ii的平衡常数
 ,
,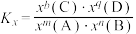 ,x为物质的量分数】
,x为物质的量分数】
您最近一年使用:0次
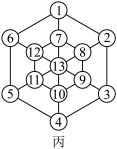
2 . 砷化镓(如图甲)是一种立方晶系,将Mn掺杂到砷化镓晶体中得到稀磁性半导体材料(如图乙),砷化镓的晶胞参数为xpm。下列说法错误 的是

| A.砷化稼中As的配位数为4 |
B.Ga和As之间的最近距离是号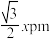 |
| C.沿体对角线a→b方向的投影如图丙,若c在11处,则As的位置为7、9、11、13 |
| D.将Mn掺杂到砷化稼晶体中,和Mn最近且等距离的As的数目为4 |
您最近一年使用:0次
3 . 电解锰工业中会产生大量含铬、锰元素的工业废水。废水处理和铬、锰的回收工艺如下:
Ⅰ.含铬、锰元素工业废水(主要含Cr3+、Mn2+、CrO 和少量有机物)的处理。
和少量有机物)的处理。

已知:①重铬酸是一种酸性较强的无机酸,化学式为H2Cr2O7;
②Ksp(BaCrO4)=1.0×10-9,Ksp(BaSO4)=1.07×10-10,Ksp(CaSO4)=7.1×10-5。
(1)“氧化”过程中需保持溶液呈碱性,则该过程中Cr3+发生反应的离子方程式为_______ 。
(2)H2O2也可用于“氧化”过程,与NaClO相比,缺点为_______ 。
(3)“二级处理”的目的为_______ 。
Ⅱ.铬渣中铬元素的回收。

(4)“转化”过程中发生反应的化学方程式为_______ 。
Ⅲ.锰渣中锰元素的回收。
第一步:将MnO2和固体KOH粉碎,混合均匀,在空气中加热熔化并连续搅拌得到K2MnO4;
第二步:电解K2MnO4浓溶液制备KMnO4,电解装置原理如图所示:

(5)电解过程中以铁网和石墨为电极材料,其中B极的电极材料为_______ ;阳极的电极反应式为_______ 。
Ⅰ.含铬、锰元素工业废水(主要含Cr3+、Mn2+、CrO
 和少量有机物)的处理。
和少量有机物)的处理。
已知:①重铬酸是一种酸性较强的无机酸,化学式为H2Cr2O7;
②Ksp(BaCrO4)=1.0×10-9,Ksp(BaSO4)=1.07×10-10,Ksp(CaSO4)=7.1×10-5。
(1)“氧化”过程中需保持溶液呈碱性,则该过程中Cr3+发生反应的离子方程式为
(2)H2O2也可用于“氧化”过程,与NaClO相比,缺点为
(3)“二级处理”的目的为
Ⅱ.铬渣中铬元素的回收。

(4)“转化”过程中发生反应的化学方程式为
Ⅲ.锰渣中锰元素的回收。
第一步:将MnO2和固体KOH粉碎,混合均匀,在空气中加热熔化并连续搅拌得到K2MnO4;
第二步:电解K2MnO4浓溶液制备KMnO4,电解装置原理如图所示:

(5)电解过程中以铁网和石墨为电极材料,其中B极的电极材料为
您最近一年使用:0次
4 . 黄血盐[亚铁氰化钾,K4Fe(CN)6]目前广泛用作食品添加剂(抗结剂),我国卫生部规定实验中黄血盐的最大使用量为10mg/kg。一种制备黄雪盐的工艺如图:
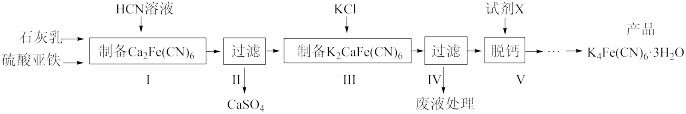
回答下列问题:
(1)步骤I反应的化学方程式为_____ 。
(2)步骤IV过滤所得的废液中含量较多的溶质为______ (填化学式)。
(3)步骤V所用的试剂X是_____ 。(填化学式)
(4)工艺中用到剧毒的HCN溶液,含CN-的废水必须处理后才能排放。
已知:HCN是一种具有苦杏仁味的无色剧毒液体,易挥发,25℃时Ka(HCN)=6.25×10-10;10-0.35=0.447;溶液中H2CO3、HCO 、CO
、CO 的存在与溶液pH的关系如图所示:
的存在与溶液pH的关系如图所示:

①NaCN中碳的化合价为______ 。
②处理含CN-废水的方法:第一步控制pH>10,用NaClO溶液先将CN-不完全氧化为OCN-;第二步控制pH为7.5~8.5,用NaClO溶液完全氧化OCN-生成N2和两种盐(其中一种用于制作面包的发酵粉)。第一步控制强碱性的主要目的是_____ ,第二步反应的离子方程式为_____ 。
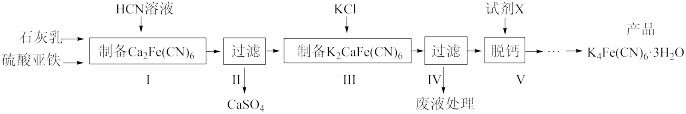
回答下列问题:
(1)步骤I反应的化学方程式为
(2)步骤IV过滤所得的废液中含量较多的溶质为
(3)步骤V所用的试剂X是
(4)工艺中用到剧毒的HCN溶液,含CN-的废水必须处理后才能排放。
已知:HCN是一种具有苦杏仁味的无色剧毒液体,易挥发,25℃时Ka(HCN)=6.25×10-10;10-0.35=0.447;溶液中H2CO3、HCO
 、CO
、CO 的存在与溶液pH的关系如图所示:
的存在与溶液pH的关系如图所示:
①NaCN中碳的化合价为
②处理含CN-废水的方法:第一步控制pH>10,用NaClO溶液先将CN-不完全氧化为OCN-;第二步控制pH为7.5~8.5,用NaClO溶液完全氧化OCN-生成N2和两种盐(其中一种用于制作面包的发酵粉)。第一步控制强碱性的主要目的是
您最近一年使用:0次
5 . I.已知2A2(g)+B2(g)⇌2C(g) ΔH=-akJ·mol-1(a>0),在一个2L固定容积的容器中加入4molA2和2molB2,在500℃时充分反应达到平衡后C的浓度为wmol·L-1。
(1)若在500℃时,反应在第5min时达平衡,且w=1,计算此5min内A2的平均反应速率为_______ ,反应达平衡时B2的转化率为_______ ,若达平衡时测得容器内压强为10MPa,则平衡常数为Kp=_______ (用平衡分压代替浓度计算,分压=总压×物质的量分数)。
(2)若将反应温度升高到700℃,该反应的平衡常数将_______ (填“增大”“减小”或“不变”)。
(3)若在原来的容器中,只加入4molC,500℃时充分反应达到平衡后,吸收热量bkJ,C的浓度_______ wmol·L-1(填“>”“=”或“<”)。
II.一定温度下,在容积固定的VL密闭容器中加入nmolA、2nmolB,发生反应:A(g)+2B(g)⇌2C(g) ΔH<0。该反应的逆反应速率与时间的关系如图所示

(4)由图可知,反应在t1、t3、t7时都达到了平衡状态,而t2时改变了一种条件,试判断改变的条件是_______ 。
(5)t2时平衡向_______ 方向移动(填“正反应”或“逆反应”)。
(6)若t4时降压,t5时达到平衡,t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系线_______ 。
(1)若在500℃时,反应在第5min时达平衡,且w=1,计算此5min内A2的平均反应速率为
(2)若将反应温度升高到700℃,该反应的平衡常数将
(3)若在原来的容器中,只加入4molC,500℃时充分反应达到平衡后,吸收热量bkJ,C的浓度
II.一定温度下,在容积固定的VL密闭容器中加入nmolA、2nmolB,发生反应:A(g)+2B(g)⇌2C(g) ΔH<0。该反应的逆反应速率与时间的关系如图所示

(4)由图可知,反应在t1、t3、t7时都达到了平衡状态,而t2时改变了一种条件,试判断改变的条件是
(5)t2时平衡向
(6)若t4时降压,t5时达到平衡,t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系线
您最近一年使用:0次
解题方法
6 . 有下列物质:
①氢氧化钡②Al2(SO4)3③液态HCl④稀硫酸⑤二氧化碳⑥铁⑦碳酸钠⑧蔗糖⑨熔融氯化钠⑩
请回答下列问题:
(1)可以导电的有___________ (填序号)。
(2)属于电解质的有___________ (填序号)。
(3)属于非电解质的有___________ (填序号)。
(4)②在水中的电离方程式为___________ 。
(5)请写出④与⑦反应的离子方程式___________ 。
(6)请写出②与①反应的化学方程式___________ 。
①氢氧化钡②Al2(SO4)3③液态HCl④稀硫酸⑤二氧化碳⑥铁⑦碳酸钠⑧蔗糖⑨熔融氯化钠⑩

请回答下列问题:
(1)可以导电的有
(2)属于电解质的有
(3)属于非电解质的有
(4)②在水中的电离方程式为
(5)请写出④与⑦反应的离子方程式
(6)请写出②与①反应的化学方程式
您最近一年使用:0次
解题方法
7 . 推理是化学学习中常用的思维方法。下列推理正确的是
| A.酸和碱能发生中和反应,则硝酸与氢氧化钠也能发生中和反应 |
| B.铝表面的氧化铝薄膜能起到保护作用,则铁表面的氧化铁也能起到保护作用 |
| C.碱溶液能使石蕊试液变蓝,则能使石蕊试液变蓝的溶液一定是碱 |
| D.蔗糖的饱和溶液,不能再溶解蔗糖,也一定不能再溶解其它物质 |
您最近一年使用:0次
8 . 下列反应的离子方程式正确的是
| A.大理石溶于醋酸溶液中:CaCO3+2H+===Ca2++CO2↑+H2O |
| B.往硫酸铜溶液中滴加氢氧化钡溶液:Ba2++2OH-+Cu2++SO42-===BaSO4↓+Cu(OH)2↓ |
| C.用FeCl3溶液腐蚀印刷电路板:Fe3++Cu===Fe2++Cu2+ |
| D.铁与稀盐酸反应:2Fe+6H+===2Fe3++3H2↑ |
您最近一年使用:0次
2020-05-16更新
|
429次组卷
|
3卷引用:广西壮族自治区贺州市中学2020-2021学年高二上学期第二次月考化学试题
名校
解题方法
9 . 如图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出。常温下X是固体,B和G是液体,其余均为气体。根据下图关系推断:
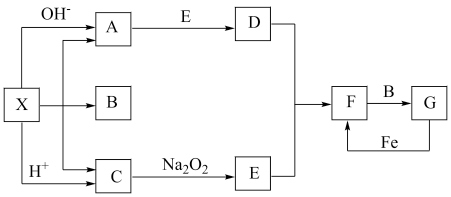
(1)写出化学式:X_______ ,A________ ,B_______ 。
(2)实验室收集气体D和F的方法依次是_______ 法、________ 法。
(3)写出C→E的化学方程式:____________ 。
(4)请写出A与E反应生成D的化学方程式:_______________
(5)检验物质A的方法和现象是________________

(1)写出化学式:X
(2)实验室收集气体D和F的方法依次是
(3)写出C→E的化学方程式:
(4)请写出A与E反应生成D的化学方程式:
(5)检验物质A的方法和现象是
您最近一年使用:0次
2019-06-21更新
|
1200次组卷
|
27卷引用:广西贺州市富川县民族中学2019-2020学年高一上学期期末考试化学试题
广西贺州市富川县民族中学2019-2020学年高一上学期期末考试化学试题云南省通海三中2018-2019学年高一6月份考试化学试题云南省景谷一中2018-2019学年高一下学期期末考试化学试题云南省施甸县二中2018-2019学年高一下学期期末考试化学试题云南省澜沧一中2018-2019学年高一下学期期末考试化学试题贵州省金沙县一中2018-2019学年高一下学期期末考试化学试题云南省富宁县一中2019-2020学年高二上学期开学考试化学试题云南省盈江县一中2019-2020学年高二上学期开学考试化学试题(已下线)2019年12月7日 《每日一题》人教版(必修1)——周末培优云南省玉溪市江川区第二中学2019-2020学年高一上学期12月月考化学试题云南省大姚县一中2019-2020学年高一12月月考化学试题云南省普洱市景东彝族自治县第一中学2019-2020学年高一上学期12月月考化学试题云南省玉溪市新平县第三中学2019-2020学年高一上学期期末考试化学试题云南省福贡县第一中学2019-2020学年高一上学期期末考试化学试题云南省马关县第二中学2019-2020学年高一上学期期末考试化学试题云南省普洱市墨江第二中学2019-2020学年高一上学期期末考试化学试题云南省丽江市华坪县第一中学2019—2020学年高一上学期期末考试化学试题云南省丽江县第三中学2019—2020学年高一上学期期末考试化学试题云南省永善县第二中学2019—2020学年高一上学期期末考试化学试题云南省玉溪市元江民族中学2019-2020学年高一12月月考化学试题贵州省剑河县第二中学2019-2020学年高一上学期期末考试化学试题贵州省三都水族自治县高级中学2019-2020学年高一上学期期末考试化学试题云南省曲靖市罗平县第三中学2019-2020学年高一上学期期末考试化学试题云南省曲靖市富源县第三中学2019-2020学年高一上学期期末考试化学试题云南省勐腊县第二中学2019-2020学年高一上学期期末考试化学试题(已下线)4.4.1 氨(基础练)-2020-2021学年高一化学上学期十分钟同步课堂专练(人教版)云南省迪庆州香格里拉中学2019-2020学年高一上学期期末考试化学试题
名校
10 . 用物质的量都是0.1 mol的CH3COOH和CH3COONa配成1L混合溶液,已知其中c(CH3COO-)>c(Na+),对该溶液的下列判断正确的是
| A.c(H+)>c(OH-) | B.c(CH3COO-)=0.1 mol·L-1 |
| C.c(CH3COOH)>c(CH3COO-) | D.c(CH3COO-)+c(OH-)=0.1 mol·L-1 |
您最近一年使用:0次
2019-03-28更新
|
668次组卷
|
13卷引用:广西钟山县钟山中学2021-2022学年高二上学期第三次(12月)月考化学(理科)试题
广西钟山县钟山中学2021-2022学年高二上学期第三次(12月)月考化学(理科)试题【全国百强校】江苏省启东中学2018-2019学年高一(创新班)下学期3月月考化学试题鲁科版(2019)高二选择性必修第一册第3章 物质在水溶液中的行为 第2节 弱电解质的电离 盐类的水解 课时4 溶液中粒子浓度的大小关系(已下线)第27讲 盐类水解(精讲)——2021年高考化学一轮复习讲练测贵州省安顺市大洋实验学校2020-2021学年高二上学期期中考试化学试题甘肃省兰州市教育局第四片区2021-2022学年高二上学期期末考试化学(理)试题第三章 本章复习提升3河南省中原名校2021-2022学年高二上学期期末联考化学试题(已下线)第八章 水溶液中的离子反应与平衡 第50练 溶液中“粒子”浓度关系3.3.3盐类水解的应用 课后第3课时 溶液中粒子浓度的大小比较微专题(八)——水溶液中粒子浓度关系(已下线)微专题 溶液中“粒子”浓度关系



