1 . Mn的基态价层电子排布图为
A.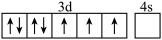 | B.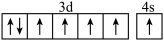 | C.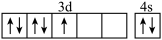 | D. |
您最近一年使用:0次
名校
解题方法
2 . 室温下,下列各组离子在指定溶液中能大量共存的是
A.pH=2的溶液:Na+、Fe2+、I-、 |
B.c[NaAl(OH)4]=0.1mol·L-1的溶液:K+、H+、Cl-、 |
C.Kw/(H+) =0.1mol·L-1的溶液:Na+、K+、 、ClO- 、ClO- |
D.c(Fe3+)=0.1mol·L-1的溶液:Al3+、 、 、 、SCN- 、SCN- |
您最近一年使用:0次
名校
3 . 高温下,某可逆反应达到平衡,其平衡常数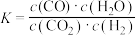 ,恒容时,升高温度,
,恒容时,升高温度, 的浓度减小,则下列说法正确的是
的浓度减小,则下列说法正确的是
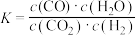 ,恒容时,升高温度,
,恒容时,升高温度, 的浓度减小,则下列说法正确的是
的浓度减小,则下列说法正确的是A.该反应的化学方程式为  |
| B.升高温度,K增大 |
| C.升高温度,逆反应速率减小 |
| D.该反应的∆H<0 |
您最近一年使用:0次
名校
解题方法
4 . 中华传统文化中蕴含着很多化学知识,下列说法正确的是
| A.“霾尘积聚难见路人”,其中的雾霾所形成的气溶胶属于胶体 |
| B.“薪柴之灰,令人以灰淋汁,取碱浣衣”,“薪柴之灰”也可与铵态氮肥混合施用 |
| C.“火药乃焰硝、硫黄、杉木炭所合”,火药发生爆炸时,生成无色的SO2、NO2和CO2 |
| D.“白墙黛瓦马头墙,回廊挂落花格窗”中“黛瓦”的青黑色是因为含有氧化铁的缘故 |
您最近一年使用:0次
名校
解题方法
5 . 根据所学习的电化学知识,下列说法正确的是
| A.构成原电池的条件之一是必须有活动性不同的两个电极 |
| B.铁表面的镀锡层破损后,仍然可以对铁起保护作用 |
| C.水库的钢闸门与电源正极连接可实现电化学保护 |
| D.智能手机常用的锂离子电池属于二次电池 |
您最近一年使用:0次
名校
解题方法
6 . 常温下,下列有关溶液的说法一定正确的是
A.NaHCO3溶液加水稀释,c(Na+)与c(HCO )的比值将减小 )的比值将减小 |
| B.pH=1的一元酸和pH=13的一元碱等体积混合后:c(OH-)=c(H+) |
C.0.1 mol·L-1硫酸铵溶液中:c(NH ) > c(SO ) > c(SO ) >c(H+)>c(OH-) ) >c(H+)>c(OH-) |
| D.0.1 mol·L-1硫化钠溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S) |
您最近一年使用:0次
7 . NA是阿伏加德罗常数的值。下列说法错误的是
| A.1 mol H2O和足量Na2O2充分反应后,转移电子总数为 NA |
| B.在标准状况下,将22.4 LNO与11.2 LO2混合于密闭容器中充分反应,生成NO2分子数为NA个 |
| C.12 g由3H和18O组成的水中,中子数和电子数之和为12 NA |
D.反应N2(g)+3H2(g) 2NH3(g) ΔH=−92.4 kJ·mol−1,若放出热量4.62 kJ,则转移电子的数目为0.3NA 2NH3(g) ΔH=−92.4 kJ·mol−1,若放出热量4.62 kJ,则转移电子的数目为0.3NA |
您最近一年使用:0次
名校
解题方法
8 . 电解池在生活和生产中有着广泛应用。下列有关判断中错误的是
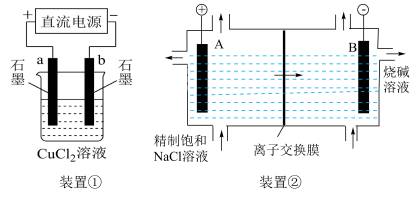

| A.装置①研究的是电解CuCl2溶液,a电极上产生气泡 |
| B.装置①电解一段时间后,要使电解质溶液恢复,可加入适量的CuCl2(s) |
| C.装置②研究的是电解饱和食盐水,A电极发生的反应:2Cl--2e-=Cl2↑ |
| D.装置②中,阳离子的移动方向是由电极B→A |
您最近一年使用:0次
名校
解题方法
9 . 合成氨反应实现工业化后,人类社会得到快速发展。回答问题:
(1)已知部分化学键的键能如下表:
工业上合成氨反应的热化学方程式为___________ 。
(2)不同催化剂下合成氨反应的历程如下图,吸附在催化剂表面的物种用“*”表示。
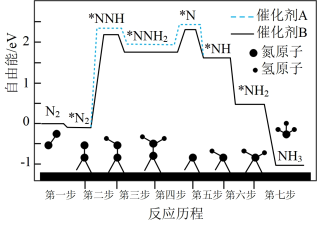
①下列说法正确的是___________ (填选项序号)。
a.工业合成氨的耗能高,寻找优良的催化剂依然是当前的重要课题
b.常温常压下,合成氨反应速率慢的根本原因是N≡N的键能太大
c.反应过程中增大压强能加快合成氨反应的速率
d.催化剂A的催化效率比B更好
②使用催化剂A时,根据反应历程决定总反应速率的步骤是第___________ 步。
(3)向某容器中充入物质的量之比为1:3的N2和H2,在不同条件下反应相同的时间,得到NH3的体积分数如下图所示。
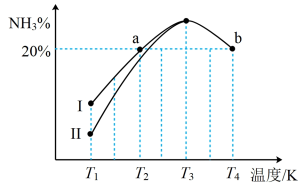
①图中的曲线Ⅰ与Ⅱ___________ (填“能”或“不能”)表示不同的压强条件下反应得出的两条曲线。
②若容器体积恒为1L,N2和H2的总物质的量为4mol,则T4K时该反应的平衡常数K为___________  。
。
(4)工业合成氨有工艺能耗高、转换率低等缺点,电化学合成氨借助电能突破了合成氨在热力学上的限制,能够在低温、常压下进行,从而引起研究者广泛关注,一种固态体系电化学合成氨装置如图所示。

①M极连接电源___________ (填“正极”或“负极”)。
②N极发生的电极反应式为___________ 。
(1)已知部分化学键的键能如下表:
| 化学键 | N≡N | H-H | N-H |
| 键能/(kJ/mol) | 946 | 436 | 391 |
(2)不同催化剂下合成氨反应的历程如下图,吸附在催化剂表面的物种用“*”表示。

①下列说法正确的是
a.工业合成氨的耗能高,寻找优良的催化剂依然是当前的重要课题
b.常温常压下,合成氨反应速率慢的根本原因是N≡N的键能太大
c.反应过程中增大压强能加快合成氨反应的速率
d.催化剂A的催化效率比B更好
②使用催化剂A时,根据反应历程决定总反应速率的步骤是第
(3)向某容器中充入物质的量之比为1:3的N2和H2,在不同条件下反应相同的时间,得到NH3的体积分数如下图所示。

①图中的曲线Ⅰ与Ⅱ
②若容器体积恒为1L,N2和H2的总物质的量为4mol,则T4K时该反应的平衡常数K为
 。
。(4)工业合成氨有工艺能耗高、转换率低等缺点,电化学合成氨借助电能突破了合成氨在热力学上的限制,能够在低温、常压下进行,从而引起研究者广泛关注,一种固态体系电化学合成氨装置如图所示。

①M极连接电源
②N极发生的电极反应式为
您最近一年使用:0次
名校
解题方法
10 . 某兴趣小组用镀锌铁皮按下列流程制备七水合硫酸锌(ZnSO4·7H2O)

相关信息如下:①金属离子形成氢氧化物沉淀的相关pH范围。
请回答:
(1)①镀锌铁皮上的油污可用Na2CO3溶液去除,理由是___________ 。
②步骤Ⅰ,可用于判断镀锌层完全反应的实验现象是___________ 。
(2)步骤Ⅱ,需加入H2O2,其作用是___________ (用离子方程式表示)。
(3)步骤Ⅲ,合适的pH范围是___________ 。
(4)步骤Ⅴ,某同学采用不同降温方式进行冷却结晶,测得ZnSO4·7H2O晶体颗粒大小分布如图1所示。根据该实验结果,为了得到颗粒大小相对均一的较大晶粒,宜选择___________ 方式进行冷却结晶。
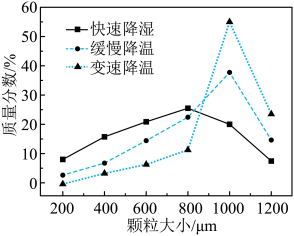
图1
A.快速降温 B.缓慢降温 C.变速降温
(5)ZnSO4·7H2O产品的纯度可用配位滴定法测定。
下列关于滴定分析,正确的是___________ 。

图2
A.图2中,应将凡士林涂在旋塞的a端和旋塞套内的c端
B.滴定前,锥形瓶和滴定管均须用标准溶液润洗
C.将标准溶液装入滴定管时,应借助烧杯或漏斗等玻璃仪器转移
D.滴定时,通常用左手控制旋塞滴加溶液,右手摇动锥形瓶,眼睛观察滴定管中液面变化
E.滴定前滴定管尖嘴内无气泡,滴定后尖嘴内有气泡,则测得的体积比实际消耗的小
(6)工业上利用磷矿石生产磷酸,现称取2.000 g磷酸粗产品,移入500 mL锥形瓶中,用160 mL的超纯水稀释,加入1 mL百里香酚酞指示剂,用0.500 0 mol·L-1的NaOH标准溶液滴定至溶液刚呈浅蓝色(生成Na2HPO4)即为终点,重复测量三次,所用标准溶液的体积分别为69.37 mL、65.65 mL、69.39 mL,则该磷酸的产品中H3PO4的质量分数是___________ (保留2位有效数字)。

相关信息如下:①金属离子形成氢氧化物沉淀的相关pH范围。
| 金属离子 | pH | |
| 开始沉淀 | 完全沉淀 | |
| Fe3+ | 1.5 | 2.8 |
| Fe2+ | 5.5 | 8.3 |
| Zn2+ | 5.4 | 8.2 |
(1)①镀锌铁皮上的油污可用Na2CO3溶液去除,理由是
②步骤Ⅰ,可用于判断镀锌层完全反应的实验现象是
(2)步骤Ⅱ,需加入H2O2,其作用是
(3)步骤Ⅲ,合适的pH范围是
(4)步骤Ⅴ,某同学采用不同降温方式进行冷却结晶,测得ZnSO4·7H2O晶体颗粒大小分布如图1所示。根据该实验结果,为了得到颗粒大小相对均一的较大晶粒,宜选择

图1
A.快速降温 B.缓慢降温 C.变速降温
(5)ZnSO4·7H2O产品的纯度可用配位滴定法测定。
下列关于滴定分析,正确的是

图2
A.图2中,应将凡士林涂在旋塞的a端和旋塞套内的c端
B.滴定前,锥形瓶和滴定管均须用标准溶液润洗
C.将标准溶液装入滴定管时,应借助烧杯或漏斗等玻璃仪器转移
D.滴定时,通常用左手控制旋塞滴加溶液,右手摇动锥形瓶,眼睛观察滴定管中液面变化
E.滴定前滴定管尖嘴内无气泡,滴定后尖嘴内有气泡,则测得的体积比实际消耗的小
(6)工业上利用磷矿石生产磷酸,现称取2.000 g磷酸粗产品,移入500 mL锥形瓶中,用160 mL的超纯水稀释,加入1 mL百里香酚酞指示剂,用0.500 0 mol·L-1的NaOH标准溶液滴定至溶液刚呈浅蓝色(生成Na2HPO4)即为终点,重复测量三次,所用标准溶液的体积分别为69.37 mL、65.65 mL、69.39 mL,则该磷酸的产品中H3PO4的质量分数是
您最近一年使用:0次



