名校
1 . 高温下,某可逆反应达到平衡,其平衡常数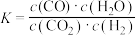 ,恒容时,升高温度,
,恒容时,升高温度, 的浓度减小,则下列说法正确的是
的浓度减小,则下列说法正确的是
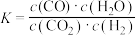 ,恒容时,升高温度,
,恒容时,升高温度, 的浓度减小,则下列说法正确的是
的浓度减小,则下列说法正确的是A.该反应的化学方程式为  |
| B.升高温度,K增大 |
| C.升高温度,逆反应速率减小 |
| D.该反应的∆H<0 |
您最近一年使用:0次
2 . NA是阿伏加德罗常数的值。下列说法错误的是
| A.1 mol H2O和足量Na2O2充分反应后,转移电子总数为 NA |
| B.在标准状况下,将22.4 LNO与11.2 LO2混合于密闭容器中充分反应,生成NO2分子数为NA个 |
| C.12 g由3H和18O组成的水中,中子数和电子数之和为12 NA |
D.反应N2(g)+3H2(g) 2NH3(g) ΔH=−92.4 kJ·mol−1,若放出热量4.62 kJ,则转移电子的数目为0.3NA 2NH3(g) ΔH=−92.4 kJ·mol−1,若放出热量4.62 kJ,则转移电子的数目为0.3NA |
您最近一年使用:0次
名校
解题方法
3 . 电解池在生活和生产中有着广泛应用。下列有关判断中错误的是
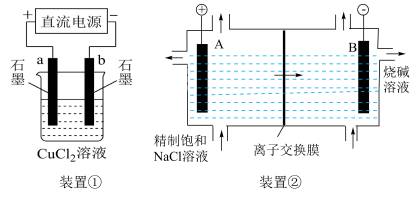

| A.装置①研究的是电解CuCl2溶液,a电极上产生气泡 |
| B.装置①电解一段时间后,要使电解质溶液恢复,可加入适量的CuCl2(s) |
| C.装置②研究的是电解饱和食盐水,A电极发生的反应:2Cl--2e-=Cl2↑ |
| D.装置②中,阳离子的移动方向是由电极B→A |
您最近一年使用:0次
名校
解题方法
4 . 合成氨反应实现工业化后,人类社会得到快速发展。回答问题:
(1)已知部分化学键的键能如下表:
工业上合成氨反应的热化学方程式为___________ 。
(2)不同催化剂下合成氨反应的历程如下图,吸附在催化剂表面的物种用“*”表示。
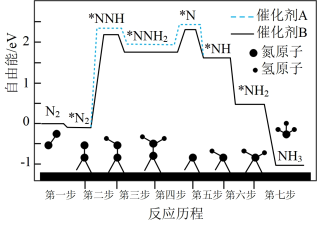
①下列说法正确的是___________ (填选项序号)。
a.工业合成氨的耗能高,寻找优良的催化剂依然是当前的重要课题
b.常温常压下,合成氨反应速率慢的根本原因是N≡N的键能太大
c.反应过程中增大压强能加快合成氨反应的速率
d.催化剂A的催化效率比B更好
②使用催化剂A时,根据反应历程决定总反应速率的步骤是第___________ 步。
(3)向某容器中充入物质的量之比为1:3的N2和H2,在不同条件下反应相同的时间,得到NH3的体积分数如下图所示。
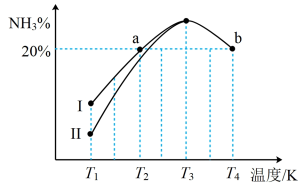
①图中的曲线Ⅰ与Ⅱ___________ (填“能”或“不能”)表示不同的压强条件下反应得出的两条曲线。
②若容器体积恒为1L,N2和H2的总物质的量为4mol,则T4K时该反应的平衡常数K为___________  。
。
(4)工业合成氨有工艺能耗高、转换率低等缺点,电化学合成氨借助电能突破了合成氨在热力学上的限制,能够在低温、常压下进行,从而引起研究者广泛关注,一种固态体系电化学合成氨装置如图所示。

①M极连接电源___________ (填“正极”或“负极”)。
②N极发生的电极反应式为___________ 。
(1)已知部分化学键的键能如下表:
| 化学键 | N≡N | H-H | N-H |
| 键能/(kJ/mol) | 946 | 436 | 391 |
(2)不同催化剂下合成氨反应的历程如下图,吸附在催化剂表面的物种用“*”表示。

①下列说法正确的是
a.工业合成氨的耗能高,寻找优良的催化剂依然是当前的重要课题
b.常温常压下,合成氨反应速率慢的根本原因是N≡N的键能太大
c.反应过程中增大压强能加快合成氨反应的速率
d.催化剂A的催化效率比B更好
②使用催化剂A时,根据反应历程决定总反应速率的步骤是第
(3)向某容器中充入物质的量之比为1:3的N2和H2,在不同条件下反应相同的时间,得到NH3的体积分数如下图所示。

①图中的曲线Ⅰ与Ⅱ
②若容器体积恒为1L,N2和H2的总物质的量为4mol,则T4K时该反应的平衡常数K为
 。
。(4)工业合成氨有工艺能耗高、转换率低等缺点,电化学合成氨借助电能突破了合成氨在热力学上的限制,能够在低温、常压下进行,从而引起研究者广泛关注,一种固态体系电化学合成氨装置如图所示。

①M极连接电源
②N极发生的电极反应式为
您最近一年使用:0次
名校
解题方法
5 . 某兴趣小组用镀锌铁皮按下列流程制备七水合硫酸锌(ZnSO4·7H2O)

相关信息如下:①金属离子形成氢氧化物沉淀的相关pH范围。
请回答:
(1)①镀锌铁皮上的油污可用Na2CO3溶液去除,理由是___________ 。
②步骤Ⅰ,可用于判断镀锌层完全反应的实验现象是___________ 。
(2)步骤Ⅱ,需加入H2O2,其作用是___________ (用离子方程式表示)。
(3)步骤Ⅲ,合适的pH范围是___________ 。
(4)步骤Ⅴ,某同学采用不同降温方式进行冷却结晶,测得ZnSO4·7H2O晶体颗粒大小分布如图1所示。根据该实验结果,为了得到颗粒大小相对均一的较大晶粒,宜选择___________ 方式进行冷却结晶。
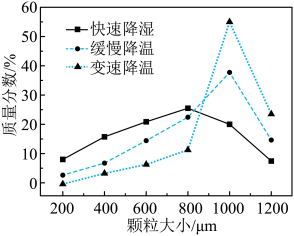
图1
A.快速降温 B.缓慢降温 C.变速降温
(5)ZnSO4·7H2O产品的纯度可用配位滴定法测定。
下列关于滴定分析,正确的是___________ 。

图2
A.图2中,应将凡士林涂在旋塞的a端和旋塞套内的c端
B.滴定前,锥形瓶和滴定管均须用标准溶液润洗
C.将标准溶液装入滴定管时,应借助烧杯或漏斗等玻璃仪器转移
D.滴定时,通常用左手控制旋塞滴加溶液,右手摇动锥形瓶,眼睛观察滴定管中液面变化
E.滴定前滴定管尖嘴内无气泡,滴定后尖嘴内有气泡,则测得的体积比实际消耗的小
(6)工业上利用磷矿石生产磷酸,现称取2.000 g磷酸粗产品,移入500 mL锥形瓶中,用160 mL的超纯水稀释,加入1 mL百里香酚酞指示剂,用0.500 0 mol·L-1的NaOH标准溶液滴定至溶液刚呈浅蓝色(生成Na2HPO4)即为终点,重复测量三次,所用标准溶液的体积分别为69.37 mL、65.65 mL、69.39 mL,则该磷酸的产品中H3PO4的质量分数是___________ (保留2位有效数字)。

相关信息如下:①金属离子形成氢氧化物沉淀的相关pH范围。
| 金属离子 | pH | |
| 开始沉淀 | 完全沉淀 | |
| Fe3+ | 1.5 | 2.8 |
| Fe2+ | 5.5 | 8.3 |
| Zn2+ | 5.4 | 8.2 |
(1)①镀锌铁皮上的油污可用Na2CO3溶液去除,理由是
②步骤Ⅰ,可用于判断镀锌层完全反应的实验现象是
(2)步骤Ⅱ,需加入H2O2,其作用是
(3)步骤Ⅲ,合适的pH范围是
(4)步骤Ⅴ,某同学采用不同降温方式进行冷却结晶,测得ZnSO4·7H2O晶体颗粒大小分布如图1所示。根据该实验结果,为了得到颗粒大小相对均一的较大晶粒,宜选择

图1
A.快速降温 B.缓慢降温 C.变速降温
(5)ZnSO4·7H2O产品的纯度可用配位滴定法测定。
下列关于滴定分析,正确的是

图2
A.图2中,应将凡士林涂在旋塞的a端和旋塞套内的c端
B.滴定前,锥形瓶和滴定管均须用标准溶液润洗
C.将标准溶液装入滴定管时,应借助烧杯或漏斗等玻璃仪器转移
D.滴定时,通常用左手控制旋塞滴加溶液,右手摇动锥形瓶,眼睛观察滴定管中液面变化
E.滴定前滴定管尖嘴内无气泡,滴定后尖嘴内有气泡,则测得的体积比实际消耗的小
(6)工业上利用磷矿石生产磷酸,现称取2.000 g磷酸粗产品,移入500 mL锥形瓶中,用160 mL的超纯水稀释,加入1 mL百里香酚酞指示剂,用0.500 0 mol·L-1的NaOH标准溶液滴定至溶液刚呈浅蓝色(生成Na2HPO4)即为终点,重复测量三次,所用标准溶液的体积分别为69.37 mL、65.65 mL、69.39 mL,则该磷酸的产品中H3PO4的质量分数是
您最近一年使用:0次
名校
解题方法
6 . 焦亚硫酸钠(Na2S2O5)是一种可溶于水的白色或淡黄色小晶体,食品级焦亚硫酸钠可作为贮存水果的保鲜剂等。某化学研究兴趣小组欲自制焦亚硫酸钠。
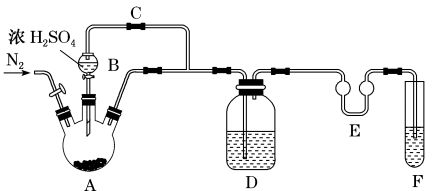
制备Na2S2O5,如图(夹持及加热装置略)
可用试剂:饱和Na2SO3溶液、浓NaOH溶液、浓H2SO4、苯、Na2SO3固体(试剂不重复使用)。
焦亚硫酸钠的析出原理:NaHSO3(饱和溶液)→Na2S2O5(晶体)+H2O(l)
(1)仪器B的名称___________
(2)装置A中发生反应的化学方程式为___________
(3)F中盛装的试剂是___________ ,作用是___________ 。
(4)通入N2的作用是___________ 。
(5)Na2S2O5晶体在___________ (填“A”“D”或“F”)中得到,再经离心分离,干燥后可得纯净的样品。
(6)若撤去E,则可能发生___________ 。

制备Na2S2O5,如图(夹持及加热装置略)
可用试剂:饱和Na2SO3溶液、浓NaOH溶液、浓H2SO4、苯、Na2SO3固体(试剂不重复使用)。
焦亚硫酸钠的析出原理:NaHSO3(饱和溶液)→Na2S2O5(晶体)+H2O(l)
(1)仪器B的名称
(2)装置A中发生反应的化学方程式为
(3)F中盛装的试剂是
(4)通入N2的作用是
(5)Na2S2O5晶体在
(6)若撤去E,则可能发生
您最近一年使用:0次
7 . W、X、Y、Z、Q、R是原子序数依次增大的六种元素,其结构或性质如下表:
请根据信息回答下列问题:
(1)元素W为___________ (填元素符号)。
(2)基态X原子的核外价电子轨道表示式为___________ ,该基态X原子中成对电子数与未成对电子数之比为___________ 。
(3)在 三种元素中,没有最高正价的为
三种元素中,没有最高正价的为___________ (填元素符号),从元素的性质角度分析其原因可能是___________ 。
(4)与Q同周期的元素中,最外层单电子数与Q相同的有___________ 种。
(5)①~③是原子序数相邻且依次增大的三种元素,它们和R元素的基态原子的各级电离能( )如下表,Q基态原子的电离能满足下表中的
)如下表,Q基态原子的电离能满足下表中的___________ (填“①”“②”或“③”)。
R元素的第四电离能( )比①~③的
)比①~③的 大的主要原因是
大的主要原因是___________ 。
| 元素 | 结构或性质 |
| W | 其一种核素常用于测定文物的年代 |
| X | 原子核外的未成对电子在同周期中最多 |
| Y | 短周期元素中原子核外第一次出现s能级电子总数等于p能级电子总数 |
| Z | 单质为单核分子,最高能级电子数为电子层数的2倍 |
| Q | 核电荷数是W与Z的核电荷数之和 |
| R | 原子序数是W与X之和的2倍 |
(1)元素W为
(2)基态X原子的核外价电子轨道表示式为
(3)在
 三种元素中,没有最高正价的为
三种元素中,没有最高正价的为(4)与Q同周期的元素中,最外层单电子数与Q相同的有
(5)①~③是原子序数相邻且依次增大的三种元素,它们和R元素的基态原子的各级电离能(
 )如下表,Q基态原子的电离能满足下表中的
)如下表,Q基态原子的电离能满足下表中的 |  |  |  |  |  | |
| ① | 650.9 | 1414 | 2830 | 4507 | 6298.7 | 12363 |
| ② | 652.9 | 1590.6 | 2987 | 4743 | 6702 | 8744.9 |
| ③ | 717.3 | 1509.0 | 3248 | 4940 | 6990 | 9220 |
| R | 762.5 | 1561.9 | 2957 | 5290 | 7240 | 9560 |
 )比①~③的
)比①~③的 大的主要原因是
大的主要原因是
您最近一年使用:0次
2023-12-24更新
|
266次组卷
|
4卷引用:重庆市巫溪县中学校2023-2024学年高二上学期期末模拟考试化学试题
名校
解题方法
8 . 某学习小组实验室模拟工业制备硫氰化钾(KSCN)。实验装置如图所示:

已知:①CS2不溶于水,密度比水大;NH3不溶于CS2;
②热稳定性;NH4HS低于NH4SCN。
实验步骤如下:
(1)制备NH4SCN溶液:
制备NH4SCN原理为CS2+3NH3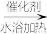 NH4SCN+NH4HS(该反应比较缓慢)。
NH4SCN+NH4HS(该反应比较缓慢)。
①实验前,经检验装置的气密性后装入试剂。其中,盛放碱石灰的玻璃仪器为_______ 仪器名称)。向三颈烧瓶内装入固体催化剂、CS2和水,三颈烧瓶左侧的进气管口必须浸没到CS2液体中,目的是_______ 。
②实验开始时打开K1,加热装置A、D,使装置A中产生的气体缓缓通入装置D中,当看到三颈烧瓶中_______ 现象时说明该反应接近完全,装置C的作用是_______ 。
(2)制备KSCN晶体:熄灭装置A中的酒精灯,关闭K1,移开水浴,将装置D继续加热至105℃一段时间,其目的是_______ ;然后打开K2,再趁热滴加适量的KOH溶液,制得较纯净的KSCN溶液,该反应的化学方程式为_______ ;最后提纯得到硫氰化钾晶体。
(3)装置E用来吸收尾气,防止污染环境,吸收NH3生成无色无味气体的离子方程式为_______ (铬元素被还原为Cr3+)
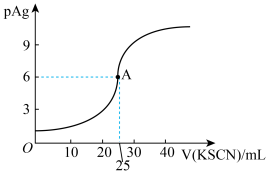
(4)使用制得的晶体配制成0.100mol/L的KSCN标准溶液来滴定25.00mL未知浓度的AgNO3溶液,以Fe(NO3)3溶液作指示剂,测得溶液中pAg=-lgc(Ag+)随加入KSCN溶液的体积变化如图所示。已知:SCN-+Ag+=AgSCN↓(白色),A点为滴定终点(滴定过程不考虑 氧化SCN-)。当加入15.00mLKSCN溶液时,溶液中c(SCN-)=
氧化SCN-)。当加入15.00mLKSCN溶液时,溶液中c(SCN-)=_______ 。

已知:①CS2不溶于水,密度比水大;NH3不溶于CS2;
②热稳定性;NH4HS低于NH4SCN。
实验步骤如下:
(1)制备NH4SCN溶液:
制备NH4SCN原理为CS2+3NH3
 NH4SCN+NH4HS(该反应比较缓慢)。
NH4SCN+NH4HS(该反应比较缓慢)。①实验前,经检验装置的气密性后装入试剂。其中,盛放碱石灰的玻璃仪器为
②实验开始时打开K1,加热装置A、D,使装置A中产生的气体缓缓通入装置D中,当看到三颈烧瓶中
(2)制备KSCN晶体:熄灭装置A中的酒精灯,关闭K1,移开水浴,将装置D继续加热至105℃一段时间,其目的是
(3)装置E用来吸收尾气,防止污染环境,吸收NH3生成无色无味气体的离子方程式为
(4)使用制得的晶体配制成0.100mol/L的KSCN标准溶液来滴定25.00mL未知浓度的AgNO3溶液,以Fe(NO3)3溶液作指示剂,测得溶液中pAg=-lgc(Ag+)随加入KSCN溶液的体积变化如图所示。已知:SCN-+Ag+=AgSCN↓(白色),A点为滴定终点(滴定过程不考虑
 氧化SCN-)。当加入15.00mLKSCN溶液时,溶液中c(SCN-)=
氧化SCN-)。当加入15.00mLKSCN溶液时,溶液中c(SCN-)=
您最近一年使用:0次
2023-12-24更新
|
170次组卷
|
2卷引用:重庆市巫溪县中学校2023-2024学年高二上学期期末模拟考试化学试题
名校
解题方法
9 . 在2L恒容密闭容器中充入2molX和1molY发生反应:Y(g)+2X(g) 3Z(g),测得混合体系中X的体积分数[ψ(X)]与温度的关系如图,下列推断正确的是
3Z(g),测得混合体系中X的体积分数[ψ(X)]与温度的关系如图,下列推断正确的是
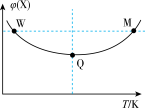
 3Z(g),测得混合体系中X的体积分数[ψ(X)]与温度的关系如图,下列推断正确的是
3Z(g),测得混合体系中X的体积分数[ψ(X)]与温度的关系如图,下列推断正确的是
| A.△H>0 |
| B.其他条件一定时,容器内压强不变时,反应达平衡状态 |
| C.W、Q、M三点中,Y的转化率最大的为Q点 |
| D.平衡时充入Z,达到新平衡时Z的体积分数比原平衡时大 |
您最近一年使用:0次
2023-12-24更新
|
181次组卷
|
2卷引用:重庆市巫溪县中学校2023-2024学年高二上学期期末模拟考试化学试题
名校
解题方法
10 . X、Y、Z、R、M为原子序数依次增大的短周期元素,其原子的最外层电子数与原子半径的关系如图所示。下列说法不正确的是


| A.X与Y形成的化合物只含极性共价键 |
B.简单离子半径比较: |
C.含氧酸酸性比较可能存在: |
| D.X与Z、M三种元素共同形成的化合物可能是离子化合物 |
您最近一年使用:0次
2023-12-21更新
|
779次组卷
|
5卷引用:重庆市巫溪县中学校2023-2024学年高二上学期期末模拟考试化学试题
重庆市巫溪县中学校2023-2024学年高二上学期期末模拟考试化学试题2024届四川省内江市高中高三上学期第一次模拟考试(一模)理综试题(已下线)热点12 元素推断与元素周期律河南省焦作市博爱县第一中学2023-2024学年高三下学期开学化学试题(已下线)专题04 物质结构与性质 元素推断-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)



