解答题-原理综合题
|
适中(0.65)
|
1 . 在已经发现的一百多种元素中,除稀有气体外,非金属元素只有十多种,但与生产生活有密切的联系。
(1)氮是动植物生长不可缺少的元素,合成氨的反应对人类解决粮食问题贡献巨大,反应如下:N2(g)+3H2(g) 2NH3(g)。
2NH3(g)。
已知相关物质化学键的键能如表所示,结合图,求x=___ 。
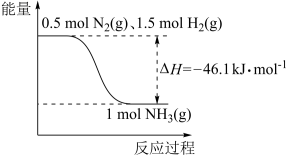
(2)将1molN2(g)和3molH2(g)放在一密闭容器中,进行反应,测得反应放出的热量小于92.2kJ,原因是___ ;若加入催化剂,ΔH__ (填“变大”、“不变”或“变小”)。
(3)某温度下,若将2mollN2和6molH2置于体积为2L的密闭容器内,反应达到平衡状态时,测得混合气体中氨的体积分数为20%,则该温度下的K=__ ,能说明反应达平衡状态的是__ 。
A.容器中混合气体的密度不随时间变化
B.单位时间内断裂3molH—H键的同时断裂6molN—H键
C.N2、H2、NH3的物质的量之比为1:3:2
D.容器中混合气体的平均相对分子质量不随时间变化
(4)①N2H4—空气燃料电池是一种高效低污染的新型电池,其结构如图所示。通入N2H4(肼)的一极的电极反应式为___ 。
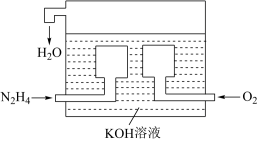
②在上述燃料电池中,若完全消耗16gN2H4,则理论上外电路中转移电子的物质的量为__ mol。
(1)氮是动植物生长不可缺少的元素,合成氨的反应对人类解决粮食问题贡献巨大,反应如下:N2(g)+3H2(g)
 2NH3(g)。
2NH3(g)。已知相关物质化学键的键能如表所示,结合图,求x=

| 化学键 | H—H | N—H | N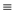 N N |
| 键能/(kJ·mol-1) | 436 | 391 | x |
(2)将1molN2(g)和3molH2(g)放在一密闭容器中,进行反应,测得反应放出的热量小于92.2kJ,原因是
(3)某温度下,若将2mollN2和6molH2置于体积为2L的密闭容器内,反应达到平衡状态时,测得混合气体中氨的体积分数为20%,则该温度下的K=
A.容器中混合气体的密度不随时间变化
B.单位时间内断裂3molH—H键的同时断裂6molN—H键
C.N2、H2、NH3的物质的量之比为1:3:2
D.容器中混合气体的平均相对分子质量不随时间变化
(4)①N2H4—空气燃料电池是一种高效低污染的新型电池,其结构如图所示。通入N2H4(肼)的一极的电极反应式为

②在上述燃料电池中,若完全消耗16gN2H4,则理论上外电路中转移电子的物质的量为
您最近一年使用:0次
名校
解题方法
2 . 化合物X是一种香料,可采用乙烯与甲苯为主要原料,按下列路线合成:

已知:RCHO+CH3COOR1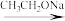 RCH=CHCOOR1。请回答:
RCH=CHCOOR1。请回答:
(1)D的名称为___ ;D→E的反应类型为___ ;A的分子式___ 。
(2)E+F→X的化学方程式___ 。
(3)D的芳香族化合物同分异构体有___ 种(不考虑立体异构),其中核磁共振氢谱为4组峰,且峰面积之比为3∶2∶2∶1的是__ 、__ (写结构简式)。
(4)以乙醇为起始原料,参照上述合成路线合成CH3CH=CHCOOCH2CH3,请写出合成路线___ 。

已知:RCHO+CH3COOR1
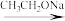 RCH=CHCOOR1。请回答:
RCH=CHCOOR1。请回答:(1)D的名称为
(2)E+F→X的化学方程式
(3)D的芳香族化合物同分异构体有
(4)以乙醇为起始原料,参照上述合成路线合成CH3CH=CHCOOCH2CH3,请写出合成路线
您最近一年使用:0次
2021-04-07更新
|
329次组卷
|
2卷引用:重庆市垫江第五中学2021届高三下学期4月月考化学试题
解题方法
3 . 用软锰矿(主要成分MnO2,含有SiO2、Fe2O3、Al2O3、MgCO3等杂质)制备MnSO4·H2O的流程如图:

已知:
回答下列问题:
(1)焙烧时,MnO2和Fe2O3在纤维素作用下分别转化为MnO、Fe3O4,则纤维素的作用是___ 。
(2)酸浸时,浸出液的pH与锰的浸出率关系如图所示,实际生产中,酸浸时控制硫酸的量不宜过多,使pH在2左右。请结合图示和制备硫酸锰的流程,说明硫酸的量不宜过多的原因:___ 。

(3)净化时,加入30%H2O2的目的是___ (用离子方程式表示);加氨水,调pH的范围是___ ,目的是___ 。
(4)结合MgSO4与MnSO4溶解度曲线,简述“结晶分离”的具体实验操作:___ 。

(5)产品MnSO4•H2O纯度测定:称取ag产品,在适宜的条件下用适量NH4NO3将Mn2+氧化为Mn3+,再用0.1000mol•L-1(NH4)2Fe(SO4)2溶液bmL刚好把Mn3+转化为Mn2+。通过计算可知,产品纯度为___ (用质量分数表示)。

已知:
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mn(OH)2 | Mg(OH)2 |
| 开始沉淀时的pH | 2.3 | 4.0 | 7.5 | 8.8 | 10.4 |
| 沉淀完全时的pH | 4.1 | 5.2 | 9.7 | 10.4 | 12.4 |
回答下列问题:
(1)焙烧时,MnO2和Fe2O3在纤维素作用下分别转化为MnO、Fe3O4,则纤维素的作用是
(2)酸浸时,浸出液的pH与锰的浸出率关系如图所示,实际生产中,酸浸时控制硫酸的量不宜过多,使pH在2左右。请结合图示和制备硫酸锰的流程,说明硫酸的量不宜过多的原因:

(3)净化时,加入30%H2O2的目的是
(4)结合MgSO4与MnSO4溶解度曲线,简述“结晶分离”的具体实验操作:

(5)产品MnSO4•H2O纯度测定:称取ag产品,在适宜的条件下用适量NH4NO3将Mn2+氧化为Mn3+,再用0.1000mol•L-1(NH4)2Fe(SO4)2溶液bmL刚好把Mn3+转化为Mn2+。通过计算可知,产品纯度为
您最近一年使用:0次
名校
4 . 室温时,将 0.10 mol/L 的 NaOH 溶液滴入 20.0 mL 未知浓度的某一元酸 HA 溶液中(c 点时二者恰好中和),溶液 pH 随加入 NaOH 溶液体积变化曲线如图。下列有关说法不正确的是

| A.该一元酸为弱酸,酸溶液的浓度为 0.10mol/L |
| B.d 点时: 2 c(HA) +2 c(A-) = 3c(Na+) |
| C.b 点 时 ,c(A-) =c(Na+) |
| D.a 点时:c(HA) < c(A-) |
您最近一年使用:0次
2021-03-16更新
|
168次组卷
|
2卷引用:重庆市垫江第五中学2021届高三下学期4月月考化学试题
名校
5 . 下列图示实验不能达成相应目的的是:
A.用苯萃取碘水中的碘单质 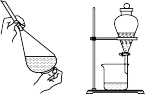 |
B.验证铁钉能发生吸氧腐蚀 |
C.实验室氨气 |
D.检验溴乙烷消去产物中的乙烯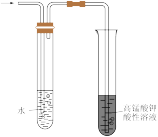 |
您最近一年使用:0次
2021-03-16更新
|
348次组卷
|
3卷引用:重庆市垫江第五中学2021届高三下学期4月月考化学试题
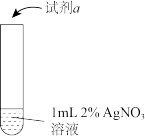
6 . 某小组同学探究银氨溶液的配制及银氨溶液的成分。
(1)银氨溶液称为Tollen试剂,在实验室中常用来检验醛基的存在。该反应中,通过“银镜”现象,可知银氨溶液做_______ 剂。
(2)探究制备银氨溶液过程中沉淀的颜色。
已知:常温下氢氧化银极不稳定,Ag+与OH-在溶液中会转化为棕褐色Ag2O沉淀。
[实验Ⅰ](实验中所用氨水均为新制):
①i中发生反应的离子方程式是____ 。
②经推断,上述实验中白色沉淀的主要成分是Ag2CO3.为进一步证明白色沉淀的组成,还可在上述实验中用___ 溶液(填化学式)作为试剂a。
③实验测得,ii中所用的氨水比i中所用氨水的pH小,可能原因有___ 。
(3)探究银氨溶液成分
[实验Ⅱ]向i所得浊液中继续滴加2%氨水,使沉淀溶解。将制得的银氨溶液进行如下操作(流程中酒精的作用是减小溶质的溶解度)。
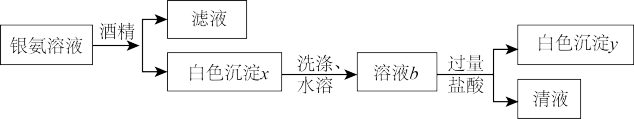
①通过实验可证明,白色沉淀x是Ag(NH3)2NO3,而不是Ag(NH3)2OH.将该实验方案和现象补充完整:溶液b滴加酚酞不变红,__ 。
②溶液b与盐酸反应的离子方程式是___ 。
③实验II中制银氨溶液的反应为Ag2O+4NH3·H2O=2[Ag(NH3)2]++2OH-+3H2O。结合实验I中i的反应,也可分析得出上述关于白色沉淀x成分的结论正确,说明理由:__ 。
(1)银氨溶液称为Tollen试剂,在实验室中常用来检验醛基的存在。该反应中,通过“银镜”现象,可知银氨溶液做
(2)探究制备银氨溶液过程中沉淀的颜色。
已知:常温下氢氧化银极不稳定,Ag+与OH-在溶液中会转化为棕褐色Ag2O沉淀。
[实验Ⅰ](实验中所用氨水均为新制):
实验操作 | 试剂a | 沉淀颜色 |
| i.2%氨水 | 棕褐色 |
| ii.2%氨水(经敞口放置48h) | 白色略暗 | |
| iii.2%氨水(瓶口装有盛碱石灰的干燥管,经放置48h) | 棕褐色 | |
| iv.2%氨水(事先通入少量CO2) | 白色 |
①i中发生反应的离子方程式是
②经推断,上述实验中白色沉淀的主要成分是Ag2CO3.为进一步证明白色沉淀的组成,还可在上述实验中用
③实验测得,ii中所用的氨水比i中所用氨水的pH小,可能原因有
(3)探究银氨溶液成分
[实验Ⅱ]向i所得浊液中继续滴加2%氨水,使沉淀溶解。将制得的银氨溶液进行如下操作(流程中酒精的作用是减小溶质的溶解度)。

①通过实验可证明,白色沉淀x是Ag(NH3)2NO3,而不是Ag(NH3)2OH.将该实验方案和现象补充完整:溶液b滴加酚酞不变红,
②溶液b与盐酸反应的离子方程式是
③实验II中制银氨溶液的反应为Ag2O+4NH3·H2O=2[Ag(NH3)2]++2OH-+3H2O。结合实验I中i的反应,也可分析得出上述关于白色沉淀x成分的结论正确,说明理由:
您最近一年使用:0次
2021-03-06更新
|
562次组卷
|
3卷引用:重庆市垫江第五中学2021届高三下学期4月月考化学试题
重庆市垫江第五中学2021届高三下学期4月月考化学试题北京市2021届高三下学期综合能力测试化学试题(已下线)第15讲 乙醛(word讲义)-【帮课堂】2021-2022学年高二化学同步精品讲义(人教2019选择性必修3)
7 . 短周期元素W、X、Y和Z在元素周期表中的相对位置如表所示,这四种元素原子的最外层电子数之和为21。下列关系正确的是
| W | X | |||
| Y | Z |
| A.氢化物沸点:W>X |
| B.简单离子的半径:Y<X |
| C.化合物熔点:Y2X3<YZ3 |
| D.氧化物对应水化物的酸性:Y>W |
您最近一年使用:0次
2021-01-22更新
|
430次组卷
|
4卷引用:重庆市垫江第五中学2021届高三下学期4月月考化学试题
重庆市垫江第五中学2021届高三下学期4月月考化学试题北京市丰台区2021届高三上学期期末考试化学试题天津市河东区2021届高三一模考试化学试题(已下线)第16讲 元素周期律和元素周期表(精讲)-2022年一轮复习讲练测
解题方法
8 . NA代表阿伏加德罗常数的值,下列说法正确的是
| A.常温常压下,124gP4中所含P-P键数目为4NA |
| B.100mL1mol·L-1FeCl3溶液中所含Fe3+的数目小于0.1NA |
| C.11.2L甲烷和乙烯混合物中含氢原子数目为2NA |
| D.密闭容器中,2molSO2和1molO2催化反应后分子总数为2NA |
您最近一年使用:0次
2021-01-04更新
|
146次组卷
|
3卷引用:重庆市垫江第五中学2021届高三下学期4月月考化学试题
名校
解题方法
9 . 某科研人员提出HCHO与O2在羟基磷灰石(HAP)表面催化氧化生成CO2、H2O的历程,该历程示意图如图(图中只画出了HAP的部分结构)。下列说法不正确 的是( )

| A.HAP能提高HCHO与O2的反应速率 |
| B.HCHO在反应过程中,有C—H键发生断裂 |
| C.根据图示信息,CO2分子中的氧原子全部来自O2 |
D.该反应可表示为:HCHO+O2 CO2+H2O CO2+H2O |
您最近一年使用:0次
2020-07-03更新
|
4378次组卷
|
78卷引用:重庆市垫江第五中学2021届高三下学期4月月考化学试题
重庆市垫江第五中学2021届高三下学期4月月考化学试题【区级联考】北京市朝阳区2019届高三下学期一模考试化学试题北京四中2018-2019学年高二下学期期中测试化学试题安徽省宣城市2018-2019学年高二下学期期末考试化学试题河南省驻马店市2018-2019学年第二学期期末考试高一化学试题浙江省杭州市西湖高级中学2019-2020学年高二10月月考化学试题辽宁省瓦房店市高级中学2020届高三10月月考化学试题河北省隆化县存瑞中学2020届高三上学期期中考试化学试题湖北省普通高中联考协作体2020届高三上学期期中考试理综化学试题山东省淄博市第十中学2020届高三上学期期末考试化学试题湖南师范大学附属中学2020届高三第五次月考化学试题(已下线)《2020年新高考政策解读与配套资源》模拟试题01-2020年北京新高考化学模拟试题北京101中学2019-2020学年高二上学期期末考试化学试题滕州一中2020届高三4月份线上化学模拟试题湖北省应城市第一高级中学2019-2020学年高二下学期期中考试化学试题湖北省武汉市钢城第四中学2019-2020高一下学期期中考试化学试题天津市第一百中学2020届高三4月模拟化学试题浙江省宁波市奉化高中、慈溪市三山高中等六校2019-2020学年高二下学期期中联考化学试题山东省泰安市2020届高三第四次模拟化学试题北京市朝阳区2020届高三三模化学试题浙江省杭州高级中学2020届高三仿真模拟考试化学试题河北省石家庄市第二中学本部2019-2020学年高一下学期期末结业考试化学试题山东省潍坊昌乐县第二中学2020届高三上学期期末化学模拟试题三湖南省长沙市湖南师范大学附属中学2020届高三第4次月考化学试题广东省广州大学附属中学等三校2021届高三上学期返校联考化学试题重庆市第二十九中学2021届高三上学期10月月考化学试题北京二中2020-2021学年高二上学期10月月考化学试题(已下线)2021年1月浙江省普通高中学业水平考试化学仿真模拟试卷03山西省太原市2020-2021学年高二上学期期中质量监测化学(理)试题贵州省北师大遵义附属高级中学2020-2021学年高二上学期期中考试化学试题福建省福州市格致中学2020-2021学年高三上学期第一学段质量检测化学试题北京市第五中学2021届高三上学期第二次阶段性考试化学试题吉林长春市第十一中学2021届高三上学期第二学程考试化学试题宁夏银川一中2021届高三第五次月考化学试题(已下线)专题10 化学平衡(速率、影响因素、图像、标志、平衡压强及常数)-2021年高考化学必做热点专题甘肃省天水市一中2021届高三上学期第四次考试理综化学试题山东省淄博市第十中学2021届高三上学期期末考试化学试题江西省赣州市十六县(市)十七校2020—2021学年高二下学期期中联考化学试题甘肃省武威第六中学2021届高三下学期第五次诊断考试化学试题(已下线)【浙江新东方】高中化学20210513-003【2021】【高二下】陕西省西安中学2021届高三第七次模拟考试化学试题(已下线)【浙江新东方】高三化学20210527-003【2021】【高二下】【期中考】【浙大附玉泉+丁兰】【高中化学】【赵燕丽收集】(人教2019)选择性必修3第三章 第三节 醛酮(鲁科版2019)选3第2章 第3节醛和酮糖类和核酸 课时1河南省原阳县2020-2021学年高二上学期期末考试化学试题江西省九江一中2020-2021学年高二上学期月考化学试题(已下线)第11周 晚练题-备战2022年高考化学周测与晚练(新高考专用)宁夏海原第一中学2022届高三上学期第一次月考化学试题天津市静海区第一中学2021-2022学年高二上学期(9月)学生学业能力调研化学试题福建省厦门外国语学校石狮分校2021-2022学年高三上学期第一次月考化学试题天津市红桥区2021-2022学年高三上学期期中考试化学试题山西省怀仁市2021-2022学年高二上学期期中化学试题(已下线)北京市第四中学2021-2022学年高三上学期期中考试化学试题四川省南充高级中学2021-2022学年高二上学期期中考试化学试题宁夏六盘山高级中学2021-2022学年高二上学期期中考试化学试题甘肃省民乐县第一中学2021-2022学年上学期高三第二次诊断(12月)考试化学试题湖南省新高考教学教研联盟2021-2022学年高三下学期第二次联考化学试题(已下线)卷07 有机物的结构、性质及应用-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)湖南省长沙市第一中学2021-2022学年高一下学期期中考试化学试题(已下线)卷03 小题仿真卷-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)广东省大联考2021-2022学年高一下学期期中检测化学试题辽宁省渤海大学附属高级中学2021-2022学年高二下学期阶段性考试化学试题广东省东莞市七校2021-2022学年高二下学期期中联考化学试题(已下线)押广东卷化学第14题 化学反应速率与化学平衡-备战2022年高考化学临考题号押题湖北省枣阳市第一中学2022届高三下学期5月第三次模拟考试化学试题内蒙古包头市第四中学2020-2021学年高三上学期期中考试理科综合化学试题湖南省蓝山县第二中学2021-2022学年高三下学期4月月考化学试题云南省罗平县第二中学2021-2022学年高二上学期期中化学试题黑龙江省大兴安岭呼玛县高级中学2021-2022学年高二上学期期末考试化学试题天津市河东区2022-2023学年高三上学期期中检测化学试题河南省南乐县第一高级中学2021-2022学年高二上学期9月半月考化学试题天津市静海区第一中学2020-2021学年高三下学期第三次模拟考试化学试题河南省商丘市宁陵县高级中学2023-2024学年高二上学期第一次考试化学试题山西省阳泉市第一中学校2022-2023学年高二上学期11月期中考试化学试题湖北省华中师范大学第一附属中学2024届高三上学期化学独立作业(9月23日)试题安徽省合肥市肥东县综合高中2022-2023学年高三上学期期末考试化学试题北京理工大学附属中学2021-2022学年高二下学期期中考试化学试题重庆十八中两江实验中学校2023-2024学年高三下学期一诊模拟检测化学试题
名校
10 . 已知镓(31Ga)和溴(35Br)是第四周期的主族元素。下列分析正确的是
| A.原子半径:Br>Ga>Cl>Al | B.镓元素为第四周期第ⅣA元素 |
| C.7935Br与8135Br得电子能力不同 | D.碱性:Ga(OH)3>Al(OH)3 ,酸性:HClO4>HBrO4 |
您最近一年使用:0次
2019-06-20更新
|
174次组卷
|
2卷引用:重庆市垫江第五中学2021届高三下学期4月月考化学试题

 +
+

