1 . 短周期主族元素组成的中学化学常见物质,发生如图所示的转化关系(部分反应物、产物和反应条件已略去),常温下,A、E为气体单质,分别呈黄绿色、无色,C为两性氢氧化物,F为淡黄色固体,固态G可用于人工降雨,H为生活中最常见的无色无味液体。
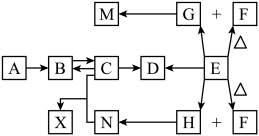
回答下列问题:
(1)组成物质A的元素,在元素周期表中的位置是_______ 。
(2)G的电子式为________ ,F中含有的化学键为______ (填“离子键”“极性键”或“非极性键”)。
(3)下列转化中属于氧化还原反应的是_______ (填标号)。
①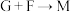 ②
②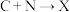 ③
③
(4)上述转化关系的方框中,属于盐类物质的有_________ (填化学式)。
(5)D和N溶液反应的化学方程式为_________ ;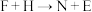 对应的离子方程式为
对应的离子方程式为_______ 。
(6)实验室中检验B溶液中阴离子的方法为_________ 。

回答下列问题:
(1)组成物质A的元素,在元素周期表中的位置是
(2)G的电子式为
(3)下列转化中属于氧化还原反应的是
①
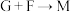 ②
②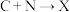 ③
③
(4)上述转化关系的方框中,属于盐类物质的有
(5)D和N溶液反应的化学方程式为
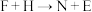 对应的离子方程式为
对应的离子方程式为(6)实验室中检验B溶液中阴离子的方法为
您最近一年使用:0次
名校
2 . 从1869年俄国化学家门捷列夫编制出第一张元素周期表到现在形成的周期表经过了众多化学家的艰辛努力。元素周期表体现了元素“位-构-性”的关系,揭示了元素间的内在联系。下表列出①~⑧八种元素在周期表中的位置,回答下列问题:
(1)②③④的原子半径由大到小的顺序是_______ (填元素符号)。
(2)⑧的元素符号是_______ ,它的最高价含氧酸的分子式是_______ 。
(3)④能形成多种同素异形体,如_______ 、_______ 等,它们之间的转化是_______ 变化(填“物理”或“化学”)。
(4)①与⑤形成的化合物可做野外生氢剂,写出该物质与水反应的化学方程式_______ ,其中氧化剂是_______ 。
(5)⑥与⑦的简单氢化物更稳定的是_______ (填化学式)。
(6)门捷列夫编制元素周期表时预言了几种当时还没有发现的元素,并在表中留了空位,其中铝元素正下方的“类铝”后来被发现并命名为“镓”,元素符号为 ,镓的金属性比铝
,镓的金属性比铝_______ (填“强”或“弱”),其氢氧化物与盐酸反应的化学方程式为_______ 。
族 周期 | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(2)⑧的元素符号是
(3)④能形成多种同素异形体,如
(4)①与⑤形成的化合物可做野外生氢剂,写出该物质与水反应的化学方程式
(5)⑥与⑦的简单氢化物更稳定的是
(6)门捷列夫编制元素周期表时预言了几种当时还没有发现的元素,并在表中留了空位,其中铝元素正下方的“类铝”后来被发现并命名为“镓”,元素符号为
 ,镓的金属性比铝
,镓的金属性比铝
您最近一年使用:0次
2023-01-01更新
|
241次组卷
|
2卷引用:四川省内江市第六中学2022-2023学年高一下学期入学考试化学试题
名校
解题方法
3 . 元素周期表是学习和研究化学的重要工具。
(1)原子序数为 1~18 的元素在元素周期表中的位置如下表所示。
①Al原子的核电荷数为____ 。②钠离子的结构示意图为____ 。
③周期表中磷元素的有关信息为 ,图中“30.97”所表示的含义是
,图中“30.97”所表示的含义是____ 。
(2)根据周期表体现的结构与性质之间的关系,某同学构建了铜及其化合物的“化合价﹣物质类别”关系图。
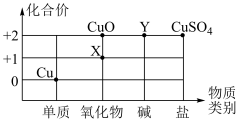
①写出物质 X 的化学式:________________ 。
②写出由物质 Y 转化为 CuSO4的化学反应方程式:_______________ 。
③氧化还原反应是化学学习中的核心概念,对氧化还原反应的定义为有化合价升降的反应,下列转化中属于氧化还原反应的是_________________ 。
A、Cu—X B、X—CuO C、CuO—Y D、Y—CuSO4
(1)原子序数为 1~18 的元素在元素周期表中的位置如下表所示。
| 第1周期 | H | He | ||||||
| 第2周期 | Li | Be | B | C | N | O | F | Ne |
| 第3周期 | Na | Mg | Al | Si | P | S | Cl | Ar |
①Al原子的核电荷数为
③周期表中磷元素的有关信息为
 ,图中“30.97”所表示的含义是
,图中“30.97”所表示的含义是(2)根据周期表体现的结构与性质之间的关系,某同学构建了铜及其化合物的“化合价﹣物质类别”关系图。

①写出物质 X 的化学式:
②写出由物质 Y 转化为 CuSO4的化学反应方程式:
③氧化还原反应是化学学习中的核心概念,对氧化还原反应的定义为有化合价升降的反应,下列转化中属于氧化还原反应的是
A、Cu—X B、X—CuO C、CuO—Y D、Y—CuSO4
您最近一年使用:0次
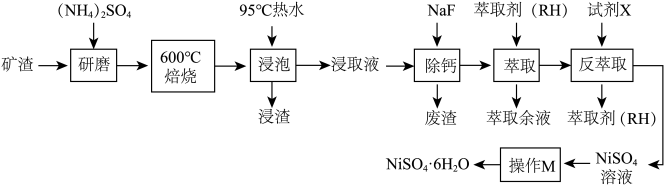
4 . 从某矿渣[成分为 (铁酸镍)、
(铁酸镍)、 、
、 、
、 、
、 等]中回收
等]中回收 的工艺流程如下:
的工艺流程如下:
已知:① 在350℃以上会分解生成
在350℃以上会分解生成 和
和 ;
;
②萃取剂(RH)萃取 的原理为
的原理为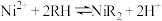 。
。
回答下列问题:
(1) 在元素周期表中的位置是
在元素周期表中的位置是___________ 。
(2)600℃焙烧时, 几乎不发生反应,
几乎不发生反应, 、
、 、
、 转化为相应的硫酸盐。
转化为相应的硫酸盐。 生成
生成 、
、 ,发生该反应的化学方程式为
,发生该反应的化学方程式为___________ 。
(3)“浸渣”的成分除了有 、
、 、
、 外,还含有
外,还含有___________ (填化学式)。为检验浸出液中是否含有 ,可选用的化学试剂是
,可选用的化学试剂是___________ 。
(4)将“浸取液”冷却到室温,测得溶液中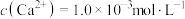 ,向其中加入一定量的
,向其中加入一定量的 晶体,搅拌,当溶液中
晶体,搅拌,当溶液中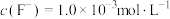 时,除钙率为
时,除钙率为___________ %[室温时,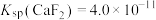 ,
,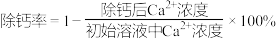 ]。
]。
(5)反萃取试剂X为___________ (填化学式)。
(6)资料显示,硫酸镍结晶水合物的形态与温度有如表所示关系:
从 溶液中获得稳定的
溶液中获得稳定的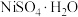 晶体的操作是
晶体的操作是___________ 、___________ 、过滤、洗涤、干燥等多步操作。
 (铁酸镍)、
(铁酸镍)、 、
、 、
、 、
、 等]中回收
等]中回收 的工艺流程如下:
的工艺流程如下:
已知:①
 在350℃以上会分解生成
在350℃以上会分解生成 和
和 ;
;②萃取剂(RH)萃取
 的原理为
的原理为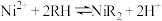 。
。回答下列问题:
(1)
 在元素周期表中的位置是
在元素周期表中的位置是(2)600℃焙烧时,
 几乎不发生反应,
几乎不发生反应, 、
、 、
、 转化为相应的硫酸盐。
转化为相应的硫酸盐。 生成
生成 、
、 ,发生该反应的化学方程式为
,发生该反应的化学方程式为(3)“浸渣”的成分除了有
 、
、 、
、 外,还含有
外,还含有 ,可选用的化学试剂是
,可选用的化学试剂是(4)将“浸取液”冷却到室温,测得溶液中
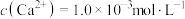 ,向其中加入一定量的
,向其中加入一定量的 晶体,搅拌,当溶液中
晶体,搅拌,当溶液中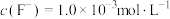 时,除钙率为
时,除钙率为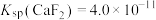 ,
,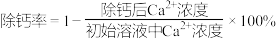 ]。
]。(5)反萃取试剂X为
(6)资料显示,硫酸镍结晶水合物的形态与温度有如表所示关系:
| 温度 | 低于30.8℃ | 30.8~53.8℃ | 53.8~280℃ | 高于280℃ |
| 晶体形态 |  | 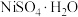 | 多种结晶水合物 |  |
 溶液中获得稳定的
溶液中获得稳定的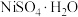 晶体的操作是
晶体的操作是
您最近一年使用:0次
2023-08-11更新
|
200次组卷
|
2卷引用:四川省绵阳市2023-2024学年高三理科突击班上学期第一次诊断性考试模拟考试理科综合化学试题
名校
5 . 1869年俄国化学家门捷列夫制出第一张元素周期表,到现在形成的周期表经过了众多化学家的艰辛努力,历经142年。元素周期表体现了元素位、构、性的关系,揭示了元素间的内在联系。如图是元素周期表的一部分,回答下列问题:
(1)元素 在元素周期表中的位置为第
在元素周期表中的位置为第_______ 周期第_______ 族。
(2)分别写出由第二周期元素与H元素形成的含10电子的一个分子和一个离子_______ 、_______ 。
(3)有以下几种粒子: 、
、 、
、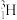 、
、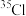 、
、 、
、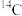 、
、 。其中含有
。其中含有_______ 种核素,互为同位素的有_______ 。由 、
、 、
、 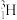 与
与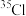 、
、  形成的氯化氢分子相对分子质量有
形成的氯化氢分子相对分子质量有_______ 种。
(4)以下说法正确的是_______。
(1)元素
 在元素周期表中的位置为第
在元素周期表中的位置为第(2)分别写出由第二周期元素与H元素形成的含10电子的一个分子和一个离子
(3)有以下几种粒子:
 、
、 、
、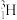 、
、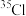 、
、 、
、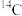 、
、 。其中含有
。其中含有 、
、 、
、 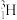 与
与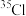 、
、  形成的氯化氢分子相对分子质量有
形成的氯化氢分子相对分子质量有(4)以下说法正确的是_______。
| A.碱金属单质和卤素单质随着核电荷数的增加,熔沸点依次升高,密度依次增大 |
| B.由于F、Cl、Br、I的非金属性依次减弱,可推出HF、HCl、HBr、HI的还原性及热稳定性依次减弱 |
| C.第85号元素砹At是核电荷数最大的卤素,其单质At2可能是一种有色固体,难溶于水易溶于有机溶剂 |
| D.在新制氯水中加入少量铁粉,发生2Fe+3Cl2=2FeCl3 |
您最近一年使用:0次
名校
6 . 部分短周期主族元素原子半径与原子序数的关系如图,根据所学知识回答下列问题。

(1)c、d、e、i四种元素的最简单氢化物中,最稳定的是___________ (填化学式)。
(2)d与f能形成一种淡黄色的物质,其电子式为___________ 。
(3)g的最高价氧化物对应的水化物与f的最高价氧化物对应的水化物反应的离子方程式为___________ 。
(4)由a的单质制成的电池需要注意防水,其原因为___________ (用化学方程式表示)。
(5)门捷列夫在研究元素周期表时,科学地预言了11种当时尚未发现的元素,他认为g的下一周期存在一种“类g”元素,该元素多年后被法国化学家发现,命名为镓(Ga),镓在元素周期表中的位置为___________ 。预测g与Ga的最高价氧化物对应水化物的碱性较强的是___________ (填最高价氧化物对应水化物的化学式)。
(6)使用下列装置再添加合适的药品,可以证明b和h两种元素的非金属性强弱顺序,可供选择的药品为:①浓硫酸②稀硫酸③盐酸④ 固体⑤
固体⑤ ⑥澄清石灰水⑦NaOH溶液
⑥澄清石灰水⑦NaOH溶液

请选择装置丙、丁两处应该加入的药品代号:丙___________ 、丁___________ 。
(7)某实验小组向100mL 溶液中通入气体单质
溶液中通入气体单质 ,溶液中
,溶液中 、
、 的物质的量随通入的
的物质的量随通入的 的物质的量变化如图所示(不考虑与水的反应)。
的物质的量变化如图所示(不考虑与水的反应)。

从开始通入 到
到 时,溶液中
时,溶液中
___________ 。

(1)c、d、e、i四种元素的最简单氢化物中,最稳定的是
(2)d与f能形成一种淡黄色的物质,其电子式为
(3)g的最高价氧化物对应的水化物与f的最高价氧化物对应的水化物反应的离子方程式为
(4)由a的单质制成的电池需要注意防水,其原因为
(5)门捷列夫在研究元素周期表时,科学地预言了11种当时尚未发现的元素,他认为g的下一周期存在一种“类g”元素,该元素多年后被法国化学家发现,命名为镓(Ga),镓在元素周期表中的位置为
(6)使用下列装置再添加合适的药品,可以证明b和h两种元素的非金属性强弱顺序,可供选择的药品为:①浓硫酸②稀硫酸③盐酸④
 固体⑤
固体⑤ ⑥澄清石灰水⑦NaOH溶液
⑥澄清石灰水⑦NaOH溶液
请选择装置丙、丁两处应该加入的药品代号:丙
(7)某实验小组向100mL
 溶液中通入气体单质
溶液中通入气体单质 ,溶液中
,溶液中 、
、 的物质的量随通入的
的物质的量随通入的 的物质的量变化如图所示(不考虑与水的反应)。
的物质的量变化如图所示(不考虑与水的反应)。
从开始通入
 到
到 时,溶液中
时,溶液中
您最近一年使用:0次
2024-01-15更新
|
141次组卷
|
2卷引用:四川省成都市第七中学2023-2024学年高一上学期12月月考化学试题
7 . 已知一个碳原子上连有两个羟基时,易发生下列转化:

请根据下图回答:
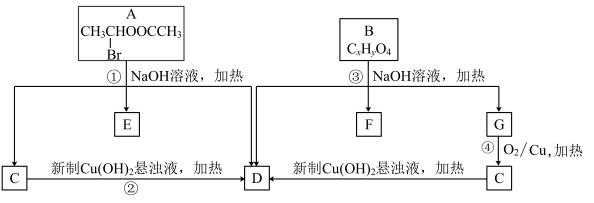
(1)A中所含官能团的名称为________ 。
(2)质谱分析发现B的最大质荷比为208;红外光谱显示B分子中含有苯环结构和两个酯基;核磁共振氢谱中有五个吸收峰,峰面积之比为2∶2∶2∶3∶3,其中苯环上的一氯代物只有两种。则B的结构简式为________________ 。
(3)写出下列反应的方程式:
①_____________________________________________________________ ;
④_____________________________________________________________ 。
(4)符合下列条件的B的同分异构体共有________ 种。
①属于芳香族化合物;
②含有三个取代基,其中只有一个烃基,另两个取代基相同且处于相同的位置;
③能发生水解反应和银镜反应。
(5)已知:2RCH2COOC2H5
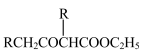 +C2H5OH
+C2H5OH
请以G为唯一有机试剂合成乙酰乙酸乙酯(CH3COCH2COOC2H5),设计合成路线(其他试剂任选)。
合成路线流程图示例:CH3CH2Cl CH3CH2OH
CH3CH2OH CH3COOC2H5
CH3COOC2H5
_____________________________________________ 。

请根据下图回答:

(1)A中所含官能团的名称为
(2)质谱分析发现B的最大质荷比为208;红外光谱显示B分子中含有苯环结构和两个酯基;核磁共振氢谱中有五个吸收峰,峰面积之比为2∶2∶2∶3∶3,其中苯环上的一氯代物只有两种。则B的结构简式为
(3)写出下列反应的方程式:
①
④
(4)符合下列条件的B的同分异构体共有
①属于芳香族化合物;
②含有三个取代基,其中只有一个烃基,另两个取代基相同且处于相同的位置;
③能发生水解反应和银镜反应。
(5)已知:2RCH2COOC2H5

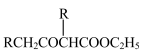 +C2H5OH
+C2H5OH请以G为唯一有机试剂合成乙酰乙酸乙酯(CH3COCH2COOC2H5),设计合成路线(其他试剂任选)。
合成路线流程图示例:CH3CH2Cl
 CH3CH2OH
CH3CH2OH CH3COOC2H5
CH3COOC2H5
您最近一年使用:0次
8 . 下表是元素周期表中前四周期的部分元素,表中所列字母分别代表一种元素。
回答下列问题:
(1)i在元素周期表中的位置是__________ 。
(2)a、e、g、l形成的简单离子其半径由大到小的顺序为__________ (填写离子符号)。
(3)n与o形成的化合物为__________ (填写化学式),将该化合物进行焰色试验,火焰呈__________ 色。
(4)用电子式表示g和m形成化合物的过程__________ 。
(5)将足量d的氢化物溶于水,再取少量 的水溶液滴入其中,反应的离子方程式为
的水溶液滴入其中,反应的离子方程式为__________ 。
(6)某同学欲探究元素性质递变规律与原子结构的关系,进行如下实验:
实验操作:取已除去氧化膜且表面积相等的镁条和铝条,分别投入 盐酸中。
盐酸中。
实验现象:镁与盐酸反应比铝更剧烈。
①比较金属性:
______  (选填“>”或“<”);
(选填“>”或“<”);
②利用元素周期律对上述实验结论进行解释__________ 。
(7)向 的碱性溶液中通入m单质,可得到
的碱性溶液中通入m单质,可得到 ,反应的离子方程式为:
,反应的离子方程式为:__________ 。
a | b | |||||||
c | d | e | f | |||||
g | h | i | j | k | l | m | ||
o | n | |||||||
(1)i在元素周期表中的位置是
(2)a、e、g、l形成的简单离子其半径由大到小的顺序为
(3)n与o形成的化合物为
(4)用电子式表示g和m形成化合物的过程
(5)将足量d的氢化物溶于水,再取少量
 的水溶液滴入其中,反应的离子方程式为
的水溶液滴入其中,反应的离子方程式为(6)某同学欲探究元素性质递变规律与原子结构的关系,进行如下实验:
实验操作:取已除去氧化膜且表面积相等的镁条和铝条,分别投入
 盐酸中。
盐酸中。实验现象:镁与盐酸反应比铝更剧烈。
①比较金属性:

 (选填“>”或“<”);
(选填“>”或“<”);②利用元素周期律对上述实验结论进行解释
(7)向
 的碱性溶液中通入m单质,可得到
的碱性溶液中通入m单质,可得到 ,反应的离子方程式为:
,反应的离子方程式为:
您最近一年使用:0次
2023-02-17更新
|
196次组卷
|
3卷引用:四川省眉山市2022-2023学年高一上学期期末考试化学试题
名校
9 . Ⅰ.2019年是元素周期表诞生150周年,元素周期表(律)在学习、研究和生产实践中有很重要的作用。
(1)中国青年化学家姜雪峰被国际组织推选为“元素硫代言人”,元素硫在周期表中的位置是___ ;它与短周期中金属性最强的元素形成的常见化合物的电子式是___ 。
(2)X是周期表中原子半径最小的元素,Y的一种同位素常用于考古,Z的最外层电子数是次外层电子数的3倍,厨房中有两种常见的调味品都是由这三种元素组成,一定条件下,这两种物质可反应生成一种具有水果香味的物质,写出该反应的方程式:___ 。
Ⅱ.氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法。
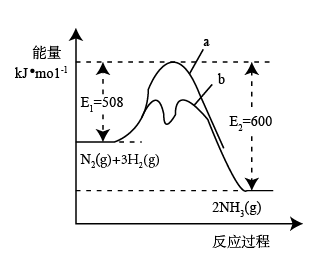
(1)根据如图提供的信息,写出该反应的热化学方程式___ ,如图的曲线中___ (填“a”或“b”)表示加入了催化剂的能量变化曲线。
已知H—H键能:436kJ/mol;N—H键能:391kJ/mol,则N≡N的键能为___ 。
(2)科学处理NOx、SO2等大气污染物,对改善人们的生存环境具有重要的现实意义。
①利用甲烷催化还原氮氧化物。已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g);△H=-574kJ•mol-1
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g);△H=-867kJ•mol-1
则CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H=____ 。
②利用氮氧化物的流程如图:
NO NO2
NO2 N2
N2
已知反应I的化学方程式为2NO+ClO2+H2O=NO2+HNO3+HCl,若反应I中转移3mol电子,则反应Ⅱ中可生成N2的体积为____ L(标准状况下)。
(3)已知下列反应:2CO(g)+O2(g)=2CO2(g)ΔH=-566kJ·mol-1
Na2O2(s)+CO2(g)=Na2CO3(s)+ O2(g)ΔH=-266kJ·mol-1
O2(g)ΔH=-266kJ·mol-1
在催化剂作用下,一氧化碳可与过氧化钠反应生成固体碳酸钠。该反应的热化学方程式为___ 。
(1)中国青年化学家姜雪峰被国际组织推选为“元素硫代言人”,元素硫在周期表中的位置是
(2)X是周期表中原子半径最小的元素,Y的一种同位素常用于考古,Z的最外层电子数是次外层电子数的3倍,厨房中有两种常见的调味品都是由这三种元素组成,一定条件下,这两种物质可反应生成一种具有水果香味的物质,写出该反应的方程式:
Ⅱ.氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法。
(1)根据如图提供的信息,写出该反应的热化学方程式
已知H—H键能:436kJ/mol;N—H键能:391kJ/mol,则N≡N的键能为

(2)科学处理NOx、SO2等大气污染物,对改善人们的生存环境具有重要的现实意义。
①利用甲烷催化还原氮氧化物。已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g);△H=-574kJ•mol-1
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g);△H=-867kJ•mol-1
则CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H=
②利用氮氧化物的流程如图:
NO
 NO2
NO2 N2
N2已知反应I的化学方程式为2NO+ClO2+H2O=NO2+HNO3+HCl,若反应I中转移3mol电子,则反应Ⅱ中可生成N2的体积为
(3)已知下列反应:2CO(g)+O2(g)=2CO2(g)ΔH=-566kJ·mol-1
Na2O2(s)+CO2(g)=Na2CO3(s)+
 O2(g)ΔH=-266kJ·mol-1
O2(g)ΔH=-266kJ·mol-1在催化剂作用下,一氧化碳可与过氧化钠反应生成固体碳酸钠。该反应的热化学方程式为
您最近一年使用:0次
名校
10 .  年是元素周期表诞生
年是元素周期表诞生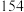 周年,元素周期表
周年,元素周期表 律
律 在学习、研究和生产实践中有很重要的作用。下表为元素周期表的一部分,回答下列问题。
在学习、研究和生产实践中有很重要的作用。下表为元素周期表的一部分,回答下列问题。
(1)元素①~⑧中,金属性最强的元素的最高价氧化物对应的水化物中含有的化学键类型为___________ ,该物质与⑥的最高价氧化物对应的水化物反应的离子方程式为___________ 。
(2)元素①和④可形成两种常见分子,写出分子量较大的分子的电子式___________ 。
已知A、B、C几种纯净物至少含元素①~⑧中一种共同的元素,它们之间有如下转化关系(部分条件和产物省略)。回答下列问题:

(3)若A为金属单质,C为浅黄色粉末,Y为液态氧化物(常温常压),则C→D的化学方程式为___________ 。
(4)若A是酸性氧化物,向空气中大量排放A,会加剧温室效应的形成,强碱X的焰色呈黄色,则B的化学式为___________ 。
(5)若A为黄绿色气体,X为金属单质,B为X在A中燃烧生成的棕褐色烟,为探究C中阳离子具有还原性,设计如下方案:
取适量的C固体溶于水,将溶液分成甲、乙、丙三份,进行如下实验:
丙实验中溶液里的氧化还原反应是___________ (用离子方程式表示)。
 年是元素周期表诞生
年是元素周期表诞生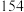 周年,元素周期表
周年,元素周期表 律
律 在学习、研究和生产实践中有很重要的作用。下表为元素周期表的一部分,回答下列问题。
在学习、研究和生产实践中有很重要的作用。下表为元素周期表的一部分,回答下列问题。 |  | |||||||
 |  | |||||||
 |  |  |  | |||||
 |  |  | 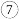 |  |
(2)元素①和④可形成两种常见分子,写出分子量较大的分子的电子式
已知A、B、C几种纯净物至少含元素①~⑧中一种共同的元素,它们之间有如下转化关系(部分条件和产物省略)。回答下列问题:

(3)若A为金属单质,C为浅黄色粉末,Y为液态氧化物(常温常压),则C→D的化学方程式为
(4)若A是酸性氧化物,向空气中大量排放A,会加剧温室效应的形成,强碱X的焰色呈黄色,则B的化学式为
(5)若A为黄绿色气体,X为金属单质,B为X在A中燃烧生成的棕褐色烟,为探究C中阳离子具有还原性,设计如下方案:
取适量的C固体溶于水,将溶液分成甲、乙、丙三份,进行如下实验:
| 实验 | 操作 | 现象 |
| 甲 | 加入镁粉 | 溶液颜色逐渐变为无色 |
| 乙 | 依次滴加KSCN溶液、新制氯水 | 开始不变色,后变红色 |
| 丙 | 先滴加KSCN溶液,后滴加酸化的双氧水 | 开始不变色,后变红色 |
您最近一年使用:0次



