名校
解题方法
1 . 采用氧化沉淀法可以利用绿矾制取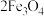 ,其制取流程如图所示:
,其制取流程如图所示:___________ (填写化学式),由溶液 获得该副产品的操作是:蒸发浓缩→
获得该副产品的操作是:蒸发浓缩→___________ →过滤洗涤 晶体加热至完全失去结晶水。
晶体加热至完全失去结晶水。
(2)某兴趣小组模仿如图流程制取 ,在实验前要测定绿矾的含量:称取
,在实验前要测定绿矾的含量:称取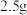 工业绿矾,配制成
工业绿矾,配制成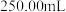 溶液。量取
溶液。量取 溶液于锥形瓶中,用
溶液于锥形瓶中,用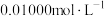 酸性
酸性 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液的平均体积为
溶液的平均体积为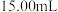 。(滴定时发生反应的离子方程式为
。(滴定时发生反应的离子方程式为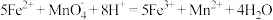 )则绿矾的质量分数为
)则绿矾的质量分数为___________ (计算结果保留三位小数)。
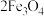 ,其制取流程如图所示:
,其制取流程如图所示:
 获得该副产品的操作是:蒸发浓缩→
获得该副产品的操作是:蒸发浓缩→ 晶体加热至完全失去结晶水。
晶体加热至完全失去结晶水。(2)某兴趣小组模仿如图流程制取
 ,在实验前要测定绿矾的含量:称取
,在实验前要测定绿矾的含量:称取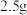 工业绿矾,配制成
工业绿矾,配制成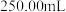 溶液。量取
溶液。量取 溶液于锥形瓶中,用
溶液于锥形瓶中,用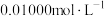 酸性
酸性 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液的平均体积为
溶液的平均体积为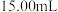 。(滴定时发生反应的离子方程式为
。(滴定时发生反应的离子方程式为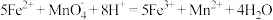 )则绿矾的质量分数为
)则绿矾的质量分数为
您最近一年使用:0次
名校
解题方法
2 . 某处工厂排出的烟道气中含氮氧化物(主要为NO、 )、粉尘和少量水蒸气.课外兴趣活动小组对该工厂排出的烟道气进行处理,并检测其氮氧化物含量,实验装置如图:
)、粉尘和少量水蒸气.课外兴趣活动小组对该工厂排出的烟道气进行处理,并检测其氮氧化物含量,实验装置如图: 混合气体按一定比例被
混合气体按一定比例被 溶液完全吸收生成
溶液完全吸收生成 和
和 ,写出该反应的化学方程式
,写出该反应的化学方程式______________ ;若反应后尾气无残留,则参加反应的 、NO物质的量比值为
、NO物质的量比值为_____ (填字母)。
a.≥1 b.≤1 c.任意值
(2)可使用适量酸性 溶液,将溶液中的
溶液,将溶液中的 全部氧化为
全部氧化为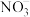 ,发生反应的离子方程式是
,发生反应的离子方程式是_______________ 。
(3)气囊用来储存处理后气体,其中可能含少量NO气体,可用酸性 溶液来处理。
溶液来处理。 氧化NO生成
氧化NO生成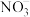 和
和 ,发生反应的离子方程式是
,发生反应的离子方程式是_______________ 。
(4)有氧条件下,NO在催化剂作用下可被 还原为
还原为 。在钒基催化剂
。在钒基催化剂 作用下的脱硝反应机理如图所示:
作用下的脱硝反应机理如图所示: 在有氧条件下的总化学方程式是
在有氧条件下的总化学方程式是___________ 。
(5)羟基自由基( )也可以用于脱硫脱硝。如图表示光催化氧化技术可生成
)也可以用于脱硫脱硝。如图表示光催化氧化技术可生成 ﹔光照时,价带失去电子产生有强氧化性的空穴,价带上
﹔光照时,价带失去电子产生有强氧化性的空穴,价带上 直接转化为
直接转化为 ;描述产生
;描述产生 的另一种过程:
的另一种过程:______________ 。 等杂质,可以采用
等杂质,可以采用 测定含量。称取
测定含量。称取 该亚硝酸钠产品溶于水配制成
该亚硝酸钠产品溶于水配制成 的样品溶液。取
的样品溶液。取 该样品溶液于锥形瓶中,用稀
该样品溶液于锥形瓶中,用稀 酸化后,再向锥形瓶中滴加
酸化后,再向锥形瓶中滴加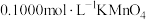 溶液,至恰好完全反应时,消耗
溶液,至恰好完全反应时,消耗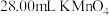 溶液。计算该产品中
溶液。计算该产品中 的质量分数
的质量分数__________ 。(写出计算过程)
 )、粉尘和少量水蒸气.课外兴趣活动小组对该工厂排出的烟道气进行处理,并检测其氮氧化物含量,实验装置如图:
)、粉尘和少量水蒸气.课外兴趣活动小组对该工厂排出的烟道气进行处理,并检测其氮氧化物含量,实验装置如图: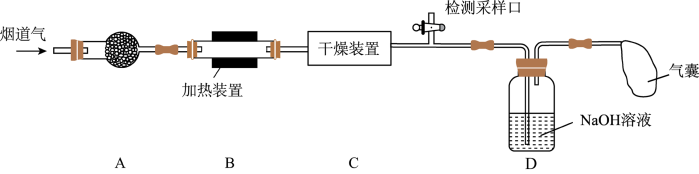
 混合气体按一定比例被
混合气体按一定比例被 溶液完全吸收生成
溶液完全吸收生成 和
和 ,写出该反应的化学方程式
,写出该反应的化学方程式 、NO物质的量比值为
、NO物质的量比值为a.≥1 b.≤1 c.任意值
(2)可使用适量酸性
 溶液,将溶液中的
溶液,将溶液中的 全部氧化为
全部氧化为 ,发生反应的离子方程式是
,发生反应的离子方程式是(3)气囊用来储存处理后气体,其中可能含少量NO气体,可用酸性
 溶液来处理。
溶液来处理。 氧化NO生成
氧化NO生成 和
和 ,发生反应的离子方程式是
,发生反应的离子方程式是(4)有氧条件下,NO在催化剂作用下可被
 还原为
还原为 。在钒基催化剂
。在钒基催化剂 作用下的脱硝反应机理如图所示:
作用下的脱硝反应机理如图所示: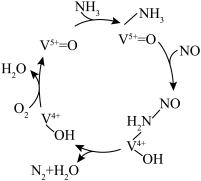
 在有氧条件下的总化学方程式是
在有氧条件下的总化学方程式是(5)羟基自由基(
 )也可以用于脱硫脱硝。如图表示光催化氧化技术可生成
)也可以用于脱硫脱硝。如图表示光催化氧化技术可生成 ﹔光照时,价带失去电子产生有强氧化性的空穴,价带上
﹔光照时,价带失去电子产生有强氧化性的空穴,价带上 直接转化为
直接转化为 ;描述产生
;描述产生 的另一种过程:
的另一种过程: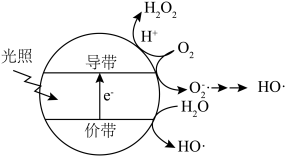
 等杂质,可以采用
等杂质,可以采用 测定含量。称取
测定含量。称取 该亚硝酸钠产品溶于水配制成
该亚硝酸钠产品溶于水配制成 的样品溶液。取
的样品溶液。取 该样品溶液于锥形瓶中,用稀
该样品溶液于锥形瓶中,用稀 酸化后,再向锥形瓶中滴加
酸化后,再向锥形瓶中滴加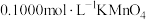 溶液,至恰好完全反应时,消耗
溶液,至恰好完全反应时,消耗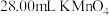 溶液。计算该产品中
溶液。计算该产品中 的质量分数
的质量分数
您最近一年使用:0次
2024-05-03更新
|
256次组卷
|
3卷引用:河南省焦作市博爱县第一中学2023-2024学年高一下学期4月期中考试化学试题
名校
解题方法
3 . 维生素C(分子式为 )能防治坏血病,又称抗坏血酸。某课外学习小组测定某维生素C 药片中维生素C的含量。取一片质量为0.100g的维生素C药片碾碎后配成溶液,加入
)能防治坏血病,又称抗坏血酸。某课外学习小组测定某维生素C 药片中维生素C的含量。取一片质量为0.100g的维生素C药片碾碎后配成溶液,加入 碘溶液45ml将维生素C氧化,用
碘溶液45ml将维生素C氧化,用 的
的 溶液与剩余
溶液与剩余 反应,消耗
反应,消耗 溶液体积为16mL。
溶液体积为16mL。
实验过程中发生如下反应: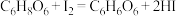 ;
;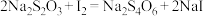
请回答下列问题:
(1)配制 的
的 溶液500mL,需称取
溶液500mL,需称取 固体
固体________ g。
(2)0.100g维生素C药片消耗 的物质的量为
的物质的量为________ mol。
(3)药品中维生素C的质量分数为________ 。
 )能防治坏血病,又称抗坏血酸。某课外学习小组测定某维生素C 药片中维生素C的含量。取一片质量为0.100g的维生素C药片碾碎后配成溶液,加入
)能防治坏血病,又称抗坏血酸。某课外学习小组测定某维生素C 药片中维生素C的含量。取一片质量为0.100g的维生素C药片碾碎后配成溶液,加入 碘溶液45ml将维生素C氧化,用
碘溶液45ml将维生素C氧化,用 的
的 溶液与剩余
溶液与剩余 反应,消耗
反应,消耗 溶液体积为16mL。
溶液体积为16mL。实验过程中发生如下反应:
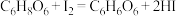 ;
;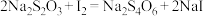
请回答下列问题:
(1)配制
 的
的 溶液500mL,需称取
溶液500mL,需称取 固体
固体(2)0.100g维生素C药片消耗
 的物质的量为
的物质的量为(3)药品中维生素C的质量分数为
您最近一年使用:0次
名校
解题方法
4 . 过二硫酸钾( )具有强氧化性,常用于水池及封闭循环处理水中有害物质的氧化降解。请回答下列问题:
)具有强氧化性,常用于水池及封闭循环处理水中有害物质的氧化降解。请回答下列问题:
Ⅰ. 中含有过氧键,与过氧化氢相似,可以和
中含有过氧键,与过氧化氢相似,可以和 发生氧化还原反应,由此构成原电池装置(质子交换膜只允许
发生氧化还原反应,由此构成原电池装置(质子交换膜只允许 通过),如图。
通过),如图。______ (填“a”或“b”)极,b极的电极反应式为______________________ 。
(2)下列关于a,b极的电极材料合理的是________ (填标号)。
Ⅱ.制备过二硫酸钾( )。
)。
往 溶液中加入硫酸及硫酸钾粉末,搅拌,常温下反应半小时,然后在搅拌下使物料冷却至14℃,
溶液中加入硫酸及硫酸钾粉末,搅拌,常温下反应半小时,然后在搅拌下使物料冷却至14℃, 以结晶析出,溶液中含有硫酸氢盐。
以结晶析出,溶液中含有硫酸氢盐。
(3)制备 的化学方程式为
的化学方程式为_____________________ 。
Ⅲ.产品提纯。
在450mL 0.5 KOH水溶液中,边搅拌边加入
KOH水溶液中,边搅拌边加入 粗产品,缓慢加热到70℃,待结晶完全溶解后,冷却到14℃,使
粗产品,缓慢加热到70℃,待结晶完全溶解后,冷却到14℃,使 重新结晶,再在90~95℃下气流干燥,即得成品。
重新结晶,再在90~95℃下气流干燥,即得成品。
(4)现用KOH固体配制上述KOH水溶液,需称量_________ g KOH固体,所需仪器如图所示,其中不需要的仪器是________________ (填标号),还缺少的仪器为_______________________ (写仪器名称)。 (
(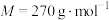 )含量测定。
)含量测定。
取a g样品全部溶解在烧杯中,加入20.00mL 0.1
 溶液,恰好完全反应。
溶液,恰好完全反应。
(5)反应生成 写出该反应的离子方程式:
写出该反应的离子方程式:________________ 。
(6)此样品中 的质量分数为
的质量分数为________________ 。
 )具有强氧化性,常用于水池及封闭循环处理水中有害物质的氧化降解。请回答下列问题:
)具有强氧化性,常用于水池及封闭循环处理水中有害物质的氧化降解。请回答下列问题:Ⅰ.
 中含有过氧键,与过氧化氢相似,可以和
中含有过氧键,与过氧化氢相似,可以和 发生氧化还原反应,由此构成原电池装置(质子交换膜只允许
发生氧化还原反应,由此构成原电池装置(质子交换膜只允许 通过),如图。
通过),如图。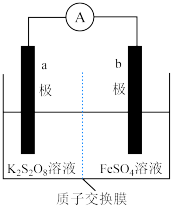
(2)下列关于a,b极的电极材料合理的是
选项 | a极 | b极 |
A | Pt | Pt |
B | 石墨 | 石墨 |
C | 石墨 | Zn |
D | Al | Cu |
Ⅱ.制备过二硫酸钾(
 )。
)。往
 溶液中加入硫酸及硫酸钾粉末,搅拌,常温下反应半小时,然后在搅拌下使物料冷却至14℃,
溶液中加入硫酸及硫酸钾粉末,搅拌,常温下反应半小时,然后在搅拌下使物料冷却至14℃, 以结晶析出,溶液中含有硫酸氢盐。
以结晶析出,溶液中含有硫酸氢盐。(3)制备
 的化学方程式为
的化学方程式为Ⅲ.产品提纯。
在450mL 0.5
 KOH水溶液中,边搅拌边加入
KOH水溶液中,边搅拌边加入 粗产品,缓慢加热到70℃,待结晶完全溶解后,冷却到14℃,使
粗产品,缓慢加热到70℃,待结晶完全溶解后,冷却到14℃,使 重新结晶,再在90~95℃下气流干燥,即得成品。
重新结晶,再在90~95℃下气流干燥,即得成品。(4)现用KOH固体配制上述KOH水溶液,需称量

 (
(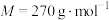 )含量测定。
)含量测定。取a g样品全部溶解在烧杯中,加入20.00mL 0.1

 溶液,恰好完全反应。
溶液,恰好完全反应。(5)反应生成
 写出该反应的离子方程式:
写出该反应的离子方程式:(6)此样品中
 的质量分数为
的质量分数为
您最近一年使用:0次
名校
5 . 阅读下列短文,并回答相关问题。
宴会上有一道菜肴烤鲜鱼。服务员手捧一个 内盛一条被
内盛一条被 严严实实裹着的烤熟了的鲑鱼。为了保温,服务员在瓷盘内倒一点
严严实实裹着的烤熟了的鲑鱼。为了保温,服务员在瓷盘内倒一点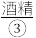 ,然后用火柴将酒精点着。此时,服务员在铝箔上撒一点
,然后用火柴将酒精点着。此时,服务员在铝箔上撒一点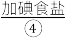 ,只见火焰呈现鲜明的橙黄色。
,只见火焰呈现鲜明的橙黄色。
(1)物质①~④中,属于单质的有______ (填序号,下同),属于化合物的有______ ,属于混合物的有______ 。
(2)酒精的分子式为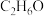 ,燃烧时的化学方程式为
,燃烧时的化学方程式为______ ,酒精中 的质量分数为
的质量分数为______ (用百分数表示,保留3位数字),已知物质碳元素含量较高时,在空气中燃烧时冒黑烟。乙醇在空气中充分燃烧时火焰为淡蓝色的原因可能是______ 。
(3)已知铝燃烧发出耀眼的白光,撒一点食盐后火焰呈黄色与化学定性操作______ 有关。
(4)已知淀粉遇碘单质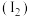 会变为蓝色,某学生为了检验食盐中的碘酸钾
会变为蓝色,某学生为了检验食盐中的碘酸钾 ,往食盐中加入少量
,往食盐中加入少量 溶液与醋酸
溶液与醋酸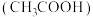 ,再加入淀粉溶液,发现溶液变为蓝色,试写出发生反应的离子方程式:
,再加入淀粉溶液,发现溶液变为蓝色,试写出发生反应的离子方程式:______ 。
宴会上有一道菜肴烤鲜鱼。服务员手捧一个
 内盛一条被
内盛一条被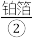 严严实实裹着的烤熟了的鲑鱼。为了保温,服务员在瓷盘内倒一点
严严实实裹着的烤熟了的鲑鱼。为了保温,服务员在瓷盘内倒一点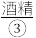 ,然后用火柴将酒精点着。此时,服务员在铝箔上撒一点
,然后用火柴将酒精点着。此时,服务员在铝箔上撒一点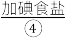 ,只见火焰呈现鲜明的橙黄色。
,只见火焰呈现鲜明的橙黄色。(1)物质①~④中,属于单质的有
(2)酒精的分子式为
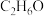 ,燃烧时的化学方程式为
,燃烧时的化学方程式为 的质量分数为
的质量分数为(3)已知铝燃烧发出耀眼的白光,撒一点食盐后火焰呈黄色与化学定性操作
(4)已知淀粉遇碘单质
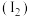 会变为蓝色,某学生为了检验食盐中的碘酸钾
会变为蓝色,某学生为了检验食盐中的碘酸钾 ,往食盐中加入少量
,往食盐中加入少量 溶液与醋酸
溶液与醋酸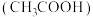 ,再加入淀粉溶液,发现溶液变为蓝色,试写出发生反应的离子方程式:
,再加入淀粉溶液,发现溶液变为蓝色,试写出发生反应的离子方程式:
您最近一年使用:0次
2023-12-26更新
|
57次组卷
|
2卷引用:江西省鹰潭市2023-2024学年高一上学期11月期中化学试题
解题方法
6 . 六氨合氯化镁(MgCl2•6NH3)具有极好的可逆吸、放氨特性,是一种优良的储氨材料。某研究小组以MgCl2•6H2O为原料在实验室制备MgCl2•6NH3,并测定所得产品中氯化镁的含量。
I.制备无水MgCl2。利用SOCl2与MgCl2•6H2O混合并加热,可制得无水MgCl2,实验装置如图(加热及夹持装置略去):
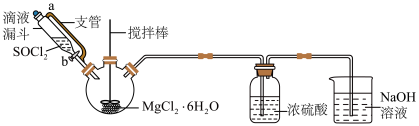
已知:SOCl2:熔点 105℃、沸点76℃;遇水剧烈水解生成两种酸性气体。
105℃、沸点76℃;遇水剧烈水解生成两种酸性气体。
(1)三颈瓶中发生反应的化学方程式为_____________ 。
(2)该实验装置中的不足之处为_______________________________ 。
(3)改进装置后,向三颈瓶中缓慢滴加SOCl2时,需打开活塞b,此时_________ (填“需要”或“不需要”)打开玻璃塞a,原因为______________ 。
Ⅱ.制备MgCl2·6NH3。将NH3通入无水MgCl2的乙醇溶液中,充分反应后,过滤、洗涤并自然风干,制得粗品。相关物质在不同溶剂中的溶解性如表:
(4)洗涤产品时,应选择的洗涤剂为___________(填字母)。
Ⅲ.测定产品中氯化镁的含量,步骤如下:
①称取1.80g样品,加入足量稀硝酸溶解,配成250mL溶液;②取25.00mL待测液于锥形瓶中,以K2CrO4为指示剂,用0.20mol/L的AgNO3标准液滴定溶液中Cl-,记录消耗标准液的体积;③重复步骤2操作2~3次,平均消耗标准液10.00 mL。
(5)步骤1中,用稀硝酸溶解样品的目的为________________ 。
(6)该样品中MgCl2的质量分数为___________ (保留小数点后2位)。
I.制备无水MgCl2。利用SOCl2与MgCl2•6H2O混合并加热,可制得无水MgCl2,实验装置如图(加热及夹持装置略去):

已知:SOCl2:熔点
 105℃、沸点76℃;遇水剧烈水解生成两种酸性气体。
105℃、沸点76℃;遇水剧烈水解生成两种酸性气体。(1)三颈瓶中发生反应的化学方程式为
(2)该实验装置中的不足之处为
(3)改进装置后,向三颈瓶中缓慢滴加SOCl2时,需打开活塞b,此时
Ⅱ.制备MgCl2·6NH3。将NH3通入无水MgCl2的乙醇溶液中,充分反应后,过滤、洗涤并自然风干,制得粗品。相关物质在不同溶剂中的溶解性如表:
NH3 | MgCl2 | MgCl2·6NH3 | |
水 | 易溶 | 易溶 | 易溶 |
甲醇(沸点65℃) | 易溶 | 易溶 | 难溶 |
乙二醇(沸点197℃) | 易溶 | 易溶 | 难溶 |
(4)洗涤产品时,应选择的洗涤剂为___________(填字母)。
| A.冰浓氨水 | B.乙二醇和水的混合液 |
| C.氨气饱和的甲醇溶液 | D.氨气饱和的乙二醇溶液 |
Ⅲ.测定产品中氯化镁的含量,步骤如下:
①称取1.80g样品,加入足量稀硝酸溶解,配成250mL溶液;②取25.00mL待测液于锥形瓶中,以K2CrO4为指示剂,用0.20mol/L的AgNO3标准液滴定溶液中Cl-,记录消耗标准液的体积;③重复步骤2操作2~3次,平均消耗标准液10.00 mL。
(5)步骤1中,用稀硝酸溶解样品的目的为
(6)该样品中MgCl2的质量分数为
您最近一年使用:0次
7 . 从海水中可提取多种化工原料,如图是工业上对海水的几项综合利用过程的示意图:
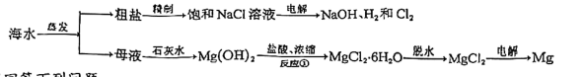
试回答下列问题:
(1)海水中按照质量分数,元素含量最多的前四位元素是___________。
(2)已知海水在浓缩过程中析出盐的种类和质量(单位:g·L-1)
根据上表信息,海水晒盐___________ (选填“需要”或“不需要”)将海水晒干,若选不需要,海水密度应该控制在___________ (选填范围)之内。
(3)如果粗盐中 含量较高,必须添加钡试剂除去
含量较高,必须添加钡试剂除去 ,该钡试剂可以是___________。
,该钡试剂可以是___________。
(4)有效除去 、
、 、
、 ,入试剂不合理的操作顺序为___________。
,入试剂不合理的操作顺序为___________。
(5)写出电解饱和氯化钠溶液的化学方程式:___________ 。
(6)阴极区的产物是___________ 。
(7)如何检验阳极产物?___________ 。(结合方程式解释)
(8)请写出反应①的反应方程式___________ 。
(9)工业上用电解饱和食盐水后的产物来制备氯化氢,其中___________ (填物质)稍微过量,火焰的颜色为___________ 。
(10)海水中硫元素为高价态,而在自然界中硫有各种价态,Na2S2O3中S的价态为___________ ;连多硫酸钠(Na2SmO6)中S的价态为___________ 。

试回答下列问题:
(1)海水中按照质量分数,元素含量最多的前四位元素是___________。
| A.O、H、Cl、Na | B.H、O、Na、Cl |
| C.Cl、Na、S、Ca | D.Na、Cl、Mg、S |
| 海水密度(g·mL-1) | CaSO4 | NaCl | MgCl2 | MgSO4 | NaBr |
| 1.13 | 0.56 | ||||
| 1.20 | 0.91 | ||||
| 1.21 | 0.05 | 3.26 | 0.004 | 0.008 | |
| 1.22 | 0.015 | 9.65 | 0.01 | 0.04 | |
| 1.26 | 0.01 | 2.64 | 0.02 | 0.02 | 0.04 |
(3)如果粗盐中
 含量较高,必须添加钡试剂除去
含量较高,必须添加钡试剂除去 ,该钡试剂可以是___________。
,该钡试剂可以是___________。| A.Ba(OH)2 | B.Ba(NO3)2 | C.BaCl2 | D.BaSO4 |
 、
、 、
、 ,入试剂不合理的操作顺序为___________。
,入试剂不合理的操作顺序为___________。| A.NaOH、Na2CO3、钡试剂、盐酸、过滤 |
| B.NaOH、钡试剂、Na2CO3、过滤、盐酸 |
| C.钡试剂、NaOH、Na2CO3、过滤、盐酸 |
| D.钡试剂、Na2CO3、NaOH、过滤、盐酸 |
(6)阴极区的产物是
(7)如何检验阳极产物?
(8)请写出反应①的反应方程式
(9)工业上用电解饱和食盐水后的产物来制备氯化氢,其中
(10)海水中硫元素为高价态,而在自然界中硫有各种价态,Na2S2O3中S的价态为
您最近一年使用:0次
8 . 为倡导“节能减排”和“低碳经济”,降低大气中CO2的含量,有效地开发利用CO2,工业上可以用CO2来生产甲醇燃料。在体积为2L的密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)。经测得CH3OH和CO2的物质的量随时间变化如图所示。
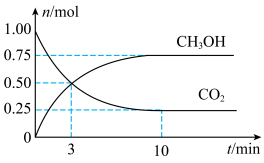
(1)从反应开始到平衡,CO2的平均反应速率v(CO2)=___________ 。
(2)达到平衡时,H2的浓度为___________ mol·L-1。
(3)改变条件后,化学反应速率会减小的是___________(填字母)
(4)平衡时,CO2的体积分数为___________ %
(5)工业上也可以用CO和H2为原料制备CH3OH,反应方程式为CO(g)+2H2(g)⇌CH3OH(g),在一体积固定的密闭容器中投入一定量的CO和H2进行上述反应。下列叙述中能说明上述反应达到平衡状态的是___________。(填字母)

(1)从反应开始到平衡,CO2的平均反应速率v(CO2)=
(2)达到平衡时,H2的浓度为
(3)改变条件后,化学反应速率会减小的是___________(填字母)
| A.降低温度 | B.加入催化剂 | C.增大容器容积 | D.恒容下充入He |
(5)工业上也可以用CO和H2为原料制备CH3OH,反应方程式为CO(g)+2H2(g)⇌CH3OH(g),在一体积固定的密闭容器中投入一定量的CO和H2进行上述反应。下列叙述中能说明上述反应达到平衡状态的是___________。(填字母)
| A.反应中CO与CH3OH的物质的量之比为1∶1 |
| B.混合气体的压强不随时间的变化而变化 |
| C.单位时间内每消耗1molCO,同时生成1molCH3OH |
| D.CH3OH的质量分数在混合气体中保持不变 |
您最近一年使用:0次
名校
9 . 依据研究,含氯消毒剂可以有效灭活新冠病毒,为阻断疫情做出了巨大贡献。二氧化氯( )就是其中一种高效消毒灭菌剂。但其稳定性较差,可转化为
)就是其中一种高效消毒灭菌剂。但其稳定性较差,可转化为 保存。分别利用吸收法和电解法两种方法得到较稳定的
保存。分别利用吸收法和电解法两种方法得到较稳定的 。其工艺流程示意图如图所示:
。其工艺流程示意图如图所示:

已知:
①纯 易分解爆炸,一般用稀有气体或空气稀释到10%以下。
易分解爆炸,一般用稀有气体或空气稀释到10%以下。
②长期放置或高于60℃时 易分解生成
易分解生成 和NaCl。
和NaCl。
(1)步骤1中,生成 的离子方程式是
的离子方程式是___________ ,通入空气的作用是___________ 。
(2)方法1中,反应的离子方程式是___________ ,利用方法1制 时,温度不能超过20℃,可能的原因是
时,温度不能超过20℃,可能的原因是___________ 。
(3)方法2中, 是被
是被___________ (填“氧化”或“还原”)而生成。
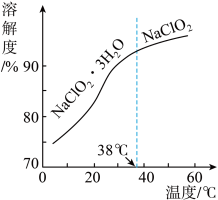
(4) 的溶解度曲线如图所示,步骤3中从
的溶解度曲线如图所示,步骤3中从 溶液中获得
溶液中获得 晶体的操作是
晶体的操作是___________ 。
(5)为测定制得的晶体中 的含量,做如下操作:
的含量,做如下操作:
①称取a g样品于烧杯中,加入适量蒸馏水溶解后加过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知: 。将所得混合液配成100mL待测溶液。
。将所得混合液配成100mL待测溶液。
②取25.00mL待测溶液,用b
 反应消耗,测得消耗标准溶液的体积为cmL(已知:
反应消耗,测得消耗标准溶液的体积为cmL(已知: )。
)。
样品中 的质量分数为
的质量分数为___________ (用含a、b、c的代数式表示)。
 )就是其中一种高效消毒灭菌剂。但其稳定性较差,可转化为
)就是其中一种高效消毒灭菌剂。但其稳定性较差,可转化为 保存。分别利用吸收法和电解法两种方法得到较稳定的
保存。分别利用吸收法和电解法两种方法得到较稳定的 。其工艺流程示意图如图所示:
。其工艺流程示意图如图所示:
已知:
①纯
 易分解爆炸,一般用稀有气体或空气稀释到10%以下。
易分解爆炸,一般用稀有气体或空气稀释到10%以下。②长期放置或高于60℃时
 易分解生成
易分解生成 和NaCl。
和NaCl。(1)步骤1中,生成
 的离子方程式是
的离子方程式是(2)方法1中,反应的离子方程式是
 时,温度不能超过20℃,可能的原因是
时,温度不能超过20℃,可能的原因是(3)方法2中,
 是被
是被(4)
 的溶解度曲线如图所示,步骤3中从
的溶解度曲线如图所示,步骤3中从 溶液中获得
溶液中获得 晶体的操作是
晶体的操作是
(5)为测定制得的晶体中
 的含量,做如下操作:
的含量,做如下操作:①称取a g样品于烧杯中,加入适量蒸馏水溶解后加过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:
 。将所得混合液配成100mL待测溶液。
。将所得混合液配成100mL待测溶液。②取25.00mL待测溶液,用b

 反应消耗,测得消耗标准溶液的体积为cmL(已知:
反应消耗,测得消耗标准溶液的体积为cmL(已知: )。
)。样品中
 的质量分数为
的质量分数为
您最近一年使用:0次
10 . 地球海洋是巨大的物质资源宝库,有待于人们进一步开发、利用和保护。氯化钠在海水中的质量分数为2.72%,是海水中含量最多的盐。从远古时代开始,人们就掌握了从海水中获取食盐的方法。近代以来,随着科学技术和化学工业的发展,人们在工业上以氯化钠为原料进一步制备金属钠、氯气、烧碱、碳酸氢钠和碳酸钠,并以氯气、烧碱等为原料进一步从海洋中提取出溴、碘、镁。这些海洋化工产品为化学工业生产体系输送了大量的基础原料,为人类的可持续发展做出了重要贡献。下列提取海洋资源的方法不正确 的是
| A.将海水蒸发结晶得到氯化钠晶体 | B.利用熟石灰从海水中沉淀氢氧化镁 |
| C.在海带浸取液中通入氯气制备碘 | D.利用空气从浓缩的海水中氧化出溴 |
您最近一年使用:0次



