名校
解题方法
1 . 结构决定性质是元素周期律和有机化学中展现的淋漓尽致,是高中化学重要思想。
Ⅰ.一种扇形元素周期表的一部分如图所示。字母a~n表示元素周期表中的对应元素。
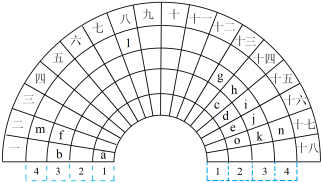
(1)元素n在元素周期表中的位置___________ 。
(2)比较f、o、k简单离子的半径,由大到小的顺序是___________ (用离子符号表示)。
(3)b与e组成的化合物中,含有非极性共价键的化合物的电子式___________ 。
(4)i的最高价氧化物对应水化物的化学式___________ ,i、d的最简单氢化物中稳定性更高的为___________ (用化学式表示)。
Ⅱ.A、B、C、D是四种常见的有机物,其中A的产量通常用来衡量一个国家的石油化工发展水平,B与C在浓硫酸和加热条件下发生反应,生成的有机物有特殊香味;A、B、C、D在一定条件下的转化关系如图所示(反应条件已省略):
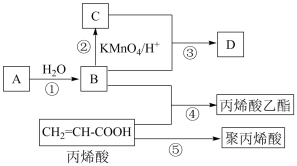
(5)A的结构简式为___________ ,C中官能团的名称为___________ 。
(6)丙烯酸乙酯的结构简式为___________ 。
(7)写出反应①化学方程式和有机反应基本类型:___________ ,___________ 反应。
(8)写出反应⑤化学方程式和有机反应基本类型:___________ ,___________ 反应。
Ⅰ.一种扇形元素周期表的一部分如图所示。字母a~n表示元素周期表中的对应元素。

(1)元素n在元素周期表中的位置
(2)比较f、o、k简单离子的半径,由大到小的顺序是
(3)b与e组成的化合物中,含有非极性共价键的化合物的电子式
(4)i的最高价氧化物对应水化物的化学式
Ⅱ.A、B、C、D是四种常见的有机物,其中A的产量通常用来衡量一个国家的石油化工发展水平,B与C在浓硫酸和加热条件下发生反应,生成的有机物有特殊香味;A、B、C、D在一定条件下的转化关系如图所示(反应条件已省略):

(5)A的结构简式为
(6)丙烯酸乙酯的结构简式为
(7)写出反应①化学方程式和有机反应基本类型:
(8)写出反应⑤化学方程式和有机反应基本类型:
您最近一年使用:0次
名校
解题方法
2 . A、B、C、X是中学化学常见化合物或单质,均由短周期元素组成,转化关系如图。请据图回答下列问题:

(1)若A、B、C中均含同一种常见金属元素R,R在C中以阴离子形式存在,B为白色胶状沉淀。
①R在元素周期表中的位置为______________ 。
②若A的溶液中混有Fe3+,当向该混合液中加入氨水,生成R(OH)n及Fe(OH)3共沉淀时,溶液中c(Fe3+)/ c(Rn+)=____ 。[已知:Fe(OH)3的 Ksp=4.00×10-38,沉淀B的Ksp=1.32×10-33 ]
(2)若A、B、C的焰色反应均为黄色,水溶液均呈碱性。
①A中含有的化学键是________________________ 。
②将672 mL(标准状况下)X通入100 mL 0.4mol·L- 1 A的溶液后,溶液中离子浓度由大到小的顺序为_______________________ 。
③自然界中存在B、C和H2O按一定比例形成的固体。取一定量该固体制成100mL溶液,测得溶液中金属阳离子的浓度为0.5mol·L-1。若取相同质量的固体加热至恒重,剩余固体的质量为_______ 。
(3)若A、B、C中均含同一种常见非金属元素,其中A为黑色固体单质。已知298K下,1mol A、1 mol B完全燃烧生成稳定氧化物放出的热量分别为393.5 kJ,283 kJ。写出该温度下A与C反应生成B的热化学方程式:______________________ 。

(1)若A、B、C中均含同一种常见金属元素R,R在C中以阴离子形式存在,B为白色胶状沉淀。
①R在元素周期表中的位置为
②若A的溶液中混有Fe3+,当向该混合液中加入氨水,生成R(OH)n及Fe(OH)3共沉淀时,溶液中c(Fe3+)/ c(Rn+)=
(2)若A、B、C的焰色反应均为黄色,水溶液均呈碱性。
①A中含有的化学键是
②将672 mL(标准状况下)X通入100 mL 0.4mol·L- 1 A的溶液后,溶液中离子浓度由大到小的顺序为
③自然界中存在B、C和H2O按一定比例形成的固体。取一定量该固体制成100mL溶液,测得溶液中金属阳离子的浓度为0.5mol·L-1。若取相同质量的固体加热至恒重,剩余固体的质量为
(3)若A、B、C中均含同一种常见非金属元素,其中A为黑色固体单质。已知298K下,1mol A、1 mol B完全燃烧生成稳定氧化物放出的热量分别为393.5 kJ,283 kJ。写出该温度下A与C反应生成B的热化学方程式:
您最近一年使用:0次
名校
解题方法
3 . A、B、C、D、E、F、G、H是元素周期表前四周期常见元素,且原子序数依次增大,相关信息如下表:
请用化学用语填空:
(1)A元素在元素周期表中的位置___________ ;C元素和F元素的电负性比较,较小的是___________ (填元素符号)。
(2)B元素与宇宙中含量最丰富的元素形成的最简单化合物的电子式为___________ ,B元素所形成的单质分子中σ键与π键数目之比为___________ 。
(3)F元素原子的价电子的轨道表示式是___________ ;G的高价阳离子的溶液与H单质反应的离子方程式为___________ ;元素X与元素E在周期表中呈对角线关系,且元素X的最高价氧化物的水化物也具有两性,试写出X元素的最高价氧化物的水化物与D元素的最高价氧化物的水化物反应的化学方程式___________ 。
| 元素 | 元素相关信息 |
| A | 原子核外有6种不同运动状态的电子 |
| C | 基态原子中s电子总数与p电子总数相等 |
| D | 原子半径在同周期元素中最大 |
| E | 基态原子最外层电子排布式为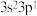 |
| F | 基态原子的最外层p轨道有两个电子的自旋方向与其他电子的自旋方向相反 |
| G | 基态原子核外有7个能级且能量最高的能级上有6个电子 |
| H | 是我国使用最早的合金中的最主要元素 |
(1)A元素在元素周期表中的位置
(2)B元素与宇宙中含量最丰富的元素形成的最简单化合物的电子式为
(3)F元素原子的价电子的轨道表示式是
您最近一年使用:0次
名校
解题方法
4 . 某油脂厂废弃的油脂加氢镍催化剂 主要含金属 、
、 、
、 及其氧化物,还有少量其他不溶性物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体(
及其氧化物,还有少量其他不溶性物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体( ):
):
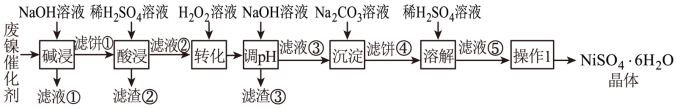
回答下列问题:
(1)“碱浸”中NaOH的两个作用分别是①溶解铝及其氧化物,②___________ 。
(2)“转化”过程中反应的离子方程式为___________ ,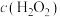 随时间t的变化关系如图所示,反应开始10~20min内
随时间t的变化关系如图所示,反应开始10~20min内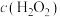 迅速减小,原因可能是
迅速减小,原因可能是___________ (不考虑溶液温度变化)。
(3)为除去溶液中的 、
、 元素,“转化”后加入适量NaOH溶液调节pH,也可以用___________(从下面四个选项选择)代替。
元素,“转化”后加入适量NaOH溶液调节pH,也可以用___________(从下面四个选项选择)代替。
(4)利用上述表格数据,计算 的
的
___________ 。如果“转化”后的溶液中 浓度为
浓度为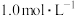 ,则“调pH”应控制的pH范围是
,则“调pH”应控制的pH范围是___________ 。
(5)硫酸镍结晶水合物的形态与温度的关系如下表。
从滤液⑤中获得稳定 晶体的操作1依次是蒸发浓缩、
晶体的操作1依次是蒸发浓缩、___________ 、过滤、洗涤、干燥。
(6)分离出 晶体后的剩余液体要循环使用,则应该回流到流程中滤液
晶体后的剩余液体要循环使用,则应该回流到流程中滤液___________ 的位置(填②、③、⑤),其目的是___________ 。
 、
、 、
、 及其氧化物,还有少量其他不溶性物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体(
及其氧化物,还有少量其他不溶性物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体( ):
):
金属离子 |
|
|
|
|
开始沉淀时( | 7.2 | 3.7 | 2.2 | 7.5 |
沉淀完全时( | 8.7 | 4.7 | 3.2 | 9.0 |

回答下列问题:
(1)“碱浸”中NaOH的两个作用分别是①溶解铝及其氧化物,②
(2)“转化”过程中反应的离子方程式为
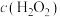 随时间t的变化关系如图所示,反应开始10~20min内
随时间t的变化关系如图所示,反应开始10~20min内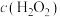 迅速减小,原因可能是
迅速减小,原因可能是(3)为除去溶液中的
 、
、 元素,“转化”后加入适量NaOH溶液调节pH,也可以用___________(从下面四个选项选择)代替。
元素,“转化”后加入适量NaOH溶液调节pH,也可以用___________(从下面四个选项选择)代替。A. | B. | C. | D.氨水 |
 的
的
 浓度为
浓度为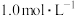 ,则“调pH”应控制的pH范围是
,则“调pH”应控制的pH范围是(5)硫酸镍结晶水合物的形态与温度的关系如下表。
温度 | 低于30.8℃ | 30.8℃~53.8℃ | 53.8℃~280℃ | 高于280℃ |
晶体形态 |
|
| 多种结晶水合物 |
|
 晶体的操作1依次是蒸发浓缩、
晶体的操作1依次是蒸发浓缩、(6)分离出
 晶体后的剩余液体要循环使用,则应该回流到流程中滤液
晶体后的剩余液体要循环使用,则应该回流到流程中滤液
您最近一年使用:0次
2022-12-25更新
|
364次组卷
|
2卷引用:福建省福州市福建师范大学附属中学2022-2023学年高二上学期期末考试化学试题
名校
解题方法
5 . 药物Targretin(F)能治疗顽固性皮肤T细胞淋巴瘤,其合成路线如图所示:

已知:
ⅰ.
ⅱ.
ⅲ.RCOOH RCOCl(R表示烃基)
RCOCl(R表示烃基)
(1)反应①的反应类型是__ 。
(2)反应②的化学方程式:__ 。
(3)C的核磁共振氢谱图中有__ 个峰。
(4)反应③的化学方程式:__ 。
(5)F的分子式是C24H28O2。F中含有的官能团:__ 。
(6)写出满足下列条件A的两种同分异构体的结构简式(不考虑-O-O-或 结构):
结构):__ 。
a.苯环上的一氯代物有两种
b.既能发生银镜反应又能发生水解反应
(7)已知: (R、R′为烃基)。以2-溴丙烷和乙烯为原料,选用必要的无机试剂合成
(R、R′为烃基)。以2-溴丙烷和乙烯为原料,选用必要的无机试剂合成 ,写出合成路线
,写出合成路线__ (用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件。

已知:
ⅰ.

ⅱ.

ⅲ.RCOOH
 RCOCl(R表示烃基)
RCOCl(R表示烃基)(1)反应①的反应类型是
(2)反应②的化学方程式:
(3)C的核磁共振氢谱图中有
(4)反应③的化学方程式:
(5)F的分子式是C24H28O2。F中含有的官能团:
(6)写出满足下列条件A的两种同分异构体的结构简式(不考虑-O-O-或
 结构):
结构):a.苯环上的一氯代物有两种
b.既能发生银镜反应又能发生水解反应
(7)已知:
 (R、R′为烃基)。以2-溴丙烷和乙烯为原料,选用必要的无机试剂合成
(R、R′为烃基)。以2-溴丙烷和乙烯为原料,选用必要的无机试剂合成 ,写出合成路线
,写出合成路线
您最近一年使用:0次
2020-04-13更新
|
257次组卷
|
6卷引用:福建省福州市2018届高三下学期5月模拟考试理综化学试题
6 . 短周期元素W、X、Y、Z在元素周期表中的位置如图所示。

其中Z的单质是一种重要半导体材料,广泛应用于电子工业的各个领域。
(1)W在元素周期表中的位置是__________ 。
(2)Z的原子结构示意图为___________________ 。
(3)下列选项中,能证明元素非金属性X强于W的是_______ 。
(4)元素周期表中与Z同周期的某金属元素形成的单质A,可发生如下图所示的转化:

其中化合物D是一种白色沉淀,则B中溶质的化学式为_____________ ;
C转化生成D的离子方程式为____________________________________ 。
(5)表中Y的最高价氧化物对应水化物的化学式为Y(OH)n ,在T℃时,其饱和溶液能使酚酞试液变红,原因是其溶液中的c(OH—) =___________ mol·L—1 (填计算数值,已知:T℃,Ksp[Y(OH) n]=4.0×l0-12)。

其中Z的单质是一种重要半导体材料,广泛应用于电子工业的各个领域。
(1)W在元素周期表中的位置是
(2)Z的原子结构示意图为
(3)下列选项中,能证明元素非金属性X强于W的是
| A.原子序数:X>W |
| B.最低化合价:X>W |
| C.最简单氢化物的稳定性:X>W |
| D.最高价氧化物的水化物酸性:X>W |
(4)元素周期表中与Z同周期的某金属元素形成的单质A,可发生如下图所示的转化:

其中化合物D是一种白色沉淀,则B中溶质的化学式为
C转化生成D的离子方程式为
(5)表中Y的最高价氧化物对应水化物的化学式为Y(OH)n ,在T℃时,其饱和溶液能使酚酞试液变红,原因是其溶液中的c(OH—) =
您最近一年使用:0次
2016-12-09更新
|
190次组卷
|
2卷引用:2015届福建省漳州市高三3月质量检查化学试卷1
名校
7 . 2020年2月17日下午,在国务院联防联控机制发布会上,科技部生物中心副主任孙燕荣告诉记者:磷酸氯喹对“COVID-19”的治疗有明确的疗效,该药是上市多年的老药,用于广泛人群治疗的安全性是可控的。其合成路线如图所示:

已知:醛基在一定条件下可以还原成甲基。回答下列问题:
(1)有机物A为糠醛,它广泛存在于各种农副产品中。A中含氧官能团的名称为______ ,A与新制氢氧化铜悬浊液反应的化学方程式为_______ 。
(2)C的结构简式为________ ,D与E之间的关系为_______ 。
(3)反应⑦的反应类型为_______ ;反应⑤若温度过高会发生副反应,其有机副产物的结构简式为____ 。
(4)有机物E有多种同分异构体,其中属于羧酸和酯的有______ 种,在这些同分异构体中,有一种是羧酸,且含有手性碳原子,其名称为_________ 。
(5)以2—丙醇和必要的试剂合成2—丙胺[CH3CH(NH2)CH3]:_________ (用箭头表示转化关系,箭头上注明试剂)。

已知:醛基在一定条件下可以还原成甲基。回答下列问题:
(1)有机物A为糠醛,它广泛存在于各种农副产品中。A中含氧官能团的名称为
(2)C的结构简式为
(3)反应⑦的反应类型为
(4)有机物E有多种同分异构体,其中属于羧酸和酯的有
(5)以2—丙醇和必要的试剂合成2—丙胺[CH3CH(NH2)CH3]:
您最近一年使用:0次
2020-05-09更新
|
425次组卷
|
3卷引用:福建省建瓯市芝华中学2019-2020学年高二下学期居家学习检测化学试题
名校
8 . 某芳香烃A有如下转化关系:
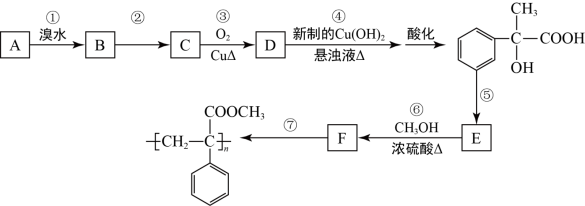
(1)写出反应②和⑤的反应条件:②______________ ;⑤_______________ .
(2)写出A的结构简式:____________________ ;
(3)写出反应⑥的化学方程式:________________________________________ .
(4)反应③的反应类型_________________ .
(5)根据已学知识和获取的信息,写出以CH3COOH,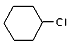 为原料合成重要的化工产品
为原料合成重要的化工产品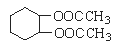 的路线流程图(无机试剂任选) 合成路线流程图示例如下:
的路线流程图(无机试剂任选) 合成路线流程图示例如下:
_________________________________________________________________________________

(1)写出反应②和⑤的反应条件:②
(2)写出A的结构简式:
(3)写出反应⑥的化学方程式:
(4)反应③的反应类型
(5)根据已学知识和获取的信息,写出以CH3COOH,
 为原料合成重要的化工产品
为原料合成重要的化工产品 的路线流程图(无机试剂任选) 合成路线流程图示例如下:
的路线流程图(无机试剂任选) 合成路线流程图示例如下:
您最近一年使用:0次
9 . 苯的同系物X是一种重要的有机化工原料,其摩尔质量为92g·mol-1,某课题小组以它为原料设计出如下转化关系图(部分产物、合成路线、反应条件略去)。已知A是一氯代物,H是一种功能高分子,链节组成为C7H5NO。
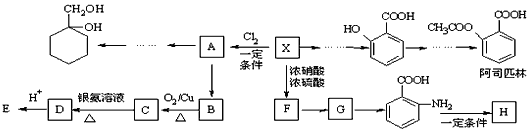
已知:
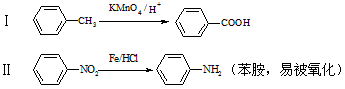
回答下列问题:
(1)对于阿司匹林,下列说法正确的是______ 。
(2)H的结构简式是__________________ ,F→G的反应类型是__________________ 。
(3)写出C→D的化学方程式_________________________________________________ 。
(4)写出符合下列条件的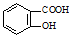 的同分异构体的结构简式
的同分异构体的结构简式__________________ 。(写出2种)
①属于芳香族化合物,且能发生银镜反应;②核磁共振氢谱图中峰面积之比为1:2:2:1
③分子中有2个羟基
(5)以A为原料可合成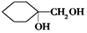 ,请设计合成路线,要求不超过4步(无机试剂任选)
,请设计合成路线,要求不超过4步(无机试剂任选)_______ 。注:合成路线的书写格式参照如下示例流程图:
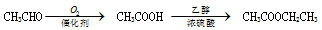

已知:

回答下列问题:
(1)对于阿司匹林,下列说法正确的是
| A.是乙酸的同系物 |
| B.能发生酯化反应 |
| C.1mol阿司匹林最多能消耗2molNaOH |
| D.不能发生加成反应 |
(3)写出C→D的化学方程式
(4)写出符合下列条件的
 的同分异构体的结构简式
的同分异构体的结构简式①属于芳香族化合物,且能发生银镜反应;②核磁共振氢谱图中峰面积之比为1:2:2:1
③分子中有2个羟基
(5)以A为原料可合成
 ,请设计合成路线,要求不超过4步(无机试剂任选)
,请设计合成路线,要求不超过4步(无机试剂任选)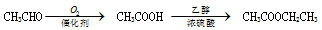
您最近一年使用:0次
解题方法
10 . A、B、C、D均为中学化学常见物质,且均含有同一种元素,它们之间有如下转化关系,其中A是单质。
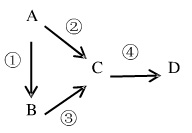
(1)若A是一种淡黄色固体,B是气态氢化物,C、D为气态氧化物,C是形成酸雨的主要物质。请写出C与B 反应的化学方程式___________________________ 。
(2)若B是气态氢化物,C、D为气态氧化物,且C、D是形成光化学烟雾的一个重要原因。请写出反应③的化学方程式_________________________ 。实验室中检验气体B用的试剂或用品为________________ 。
(3)若B、D既能溶于强酸溶液,又能溶于强碱溶液,反应②③均需要强碱性溶液,反应④可以通过滴加少量稀盐酸实现。据此判断A元素在周期表中的位置是_________________ 。请写出②的离子方程式_____________________________ 。
(4)若C是一种淡黄色固体,常用于呼吸面具中的供氧剂,D是一种强碱。则C作供氧剂时氧化产物和还原产物的物质的量之比为________________ ;焰色反应时,D的火焰呈________ 色。

(1)若A是一种淡黄色固体,B是气态氢化物,C、D为气态氧化物,C是形成酸雨的主要物质。请写出C与B 反应的化学方程式
(2)若B是气态氢化物,C、D为气态氧化物,且C、D是形成光化学烟雾的一个重要原因。请写出反应③的化学方程式
(3)若B、D既能溶于强酸溶液,又能溶于强碱溶液,反应②③均需要强碱性溶液,反应④可以通过滴加少量稀盐酸实现。据此判断A元素在周期表中的位置是
(4)若C是一种淡黄色固体,常用于呼吸面具中的供氧剂,D是一种强碱。则C作供氧剂时氧化产物和还原产物的物质的量之比为
您最近一年使用:0次




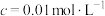 )的pH
)的pH )的pH
)的pH



