名校
解题方法
1 . 硫元素是动植物生长不可缺少的元素,图1是自然界中硫元素的存在示意图。图是硫元素的常见化合价与部分物质类别的对应关系。回答下列问题。

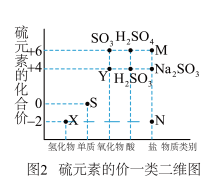
(1)图1中与图2中M、N对应的物质分别是___________ 、___________ 。(各写一个)
(2)写出物质X的电子式___________ 。
(3)SO2的排放是造成酸雨的主要因素,同时SO2在生活中也有多种用途。请回答下列问题:
①从环境保护的角度看,人们通常把pH<5.6的降水称为酸雨。已知pH=-lgc(H+)。经测定某次雨水中只含硫酸。且浓度为5×10-5mol/L,这次降雨___________ (填“是”或“不是”)酸雨。
②石灰石——石膏(CaSO4·2H2O)法是处理含SO2烟气脱硫的常见方法,该工艺原理是,将石灰石粉末加水制成浆液作为吸收剂与烟气充分混合并接触氧化。最终生成石膏。写出该过程发生反应的化学方程式___________ 。
③在酸酒时人工添加SO2有两个目的:抗氧化和抗菌,实验室模拟二氧化硫抗氧化过程,向溴水中通入SO2,请用离子方程式表示该反应原理___________ 。
④发酵酒卫生标准中对葡萄酒中的二氧化硫含量有要求:总SO2小于250mg/L,若在室温下。每升溶液中最多通入___________ mLSO2.(室温下Vm=24L/mol)
(4)向BaCl2溶液中通入SO2至饱和,此过程看不到现象,再向溶液中加入一种物质。溶液变浑浊。加入的这种物质不可能是___________。


(1)图1中与图2中M、N对应的物质分别是
(2)写出物质X的电子式
(3)SO2的排放是造成酸雨的主要因素,同时SO2在生活中也有多种用途。请回答下列问题:
①从环境保护的角度看,人们通常把pH<5.6的降水称为酸雨。已知pH=-lgc(H+)。经测定某次雨水中只含硫酸。且浓度为5×10-5mol/L,这次降雨
②石灰石——石膏(CaSO4·2H2O)法是处理含SO2烟气脱硫的常见方法,该工艺原理是,将石灰石粉末加水制成浆液作为吸收剂与烟气充分混合并接触氧化。最终生成石膏。写出该过程发生反应的化学方程式
③在酸酒时人工添加SO2有两个目的:抗氧化和抗菌,实验室模拟二氧化硫抗氧化过程,向溴水中通入SO2,请用离子方程式表示该反应原理
④发酵酒卫生标准中对葡萄酒中的二氧化硫含量有要求:总SO2小于250mg/L,若在室温下。每升溶液中最多通入
(4)向BaCl2溶液中通入SO2至饱和,此过程看不到现象,再向溶液中加入一种物质。溶液变浑浊。加入的这种物质不可能是___________。
| A.Cl2 | B.NH3 | C.CO2 | D.H2S |
您最近一年使用:0次
名校
解题方法
2 . 下列化学实验中的操作、现象及解释有正确对应关系的是
| 选项 | 操作 | 现象 | 解释 |
| A | 向蓝色的 稀溶液中加入食盐 稀溶液中加入食盐 | 溶液由蓝色变为绿色 | 颜色变化与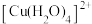 、 、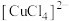 相对量多少有关 相对量多少有关 |
| B | 向 溶液中加入KSCN溶液 溶液中加入KSCN溶液 | 溶液变为红色 | 生成红色的离子化合物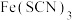 |
| C | 用毛皮摩擦过的带电橡胶棒靠近 液流 液流 |  液流方向不改变 液流方向不改变 |  中不含非极性键 中不含非极性键 |
| D | 向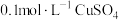 溶液里逐滴加入 溶液里逐滴加入 氨水至过量 氨水至过量 | 先形成蓝色沉淀,后溶解得到深蓝色溶液 | 沉淀溶解时主要反应: |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-07-20更新
|
358次组卷
|
2卷引用:福建省厦门第六中学2023-2024学年高二下学期4月月考化学试卷
名校
解题方法
3 . 下列化学实验中的操作、现象及解释有正确对应关系的是
| 选项 | 操作 | 现象 | 解释 |
| A | 向酸性KMnO4溶液中加入甲苯 向酸性KMnO4溶液中加入苯 | 溶液褪色 溶液不褪色 | 甲基对苯环有影响 |
| B | 将含有稀硫酸的蔗糖溶液水浴加热后,加入新制氢氧化铜悬浊液并加热 | 没有产生红色沉淀 | 蔗糖未水解 |
| C | 向碳酸钠固体中加入乙酸,将产生的气体通入苯酚钠溶液中 | 苯酚钠溶液变浑浊 | 酸性:乙酸>碳酸>苯酚 |
| D | 将乙醇与浓硫酸的混合溶液加热至170℃,产生的气体直接通入酸性KMnO4液中 | 酸性KMnO4溶液褪色 | 不能证明生成了乙烯 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-04-28更新
|
580次组卷
|
2卷引用:福建省福清西山学校高中部2022-2023学年高二下学期期末考试化学试题
名校
解题方法
4 . 利用元素的化合价推测物质的性质是化学研究的重要手段,氮元素的常见化合价与部分物质类别的对应关系如图所示。

(1)从氮元素化合价的角度分析,X、Y、Z、W中既具有氧化性又具有还原性的有______ (填化学式)。
(2) N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与O2在加热和催化剂作用下生成N2O的化学方程式为_______________ 。尾气中的NO用酸性NaClO溶液吸收,其原理是HClO氧化NO生成Cl−和NO3-,其离子方程式为______________________________________ 。
(3)将集满红棕色气体Z的试管倒置于盛有水的水槽中,观察到的现象为_______________________ 。
(4)W的稀溶液与铜单质发生反应的离子方程式为__________________________ 。
(5)已知NaNO2能被酸性KMnO4溶液氧化为NaNO3,则50mL0.01 mol·L-1 NaNO2溶液与10mL0.02 mol·L-1 KMnO4溶液恰好完全反应时,还原产物中Mn元素的化合价为__________________________ 。

(1)从氮元素化合价的角度分析,X、Y、Z、W中既具有氧化性又具有还原性的有
(2) N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与O2在加热和催化剂作用下生成N2O的化学方程式为
(3)将集满红棕色气体Z的试管倒置于盛有水的水槽中,观察到的现象为
(4)W的稀溶液与铜单质发生反应的离子方程式为
(5)已知NaNO2能被酸性KMnO4溶液氧化为NaNO3,则50mL0.01 mol·L-1 NaNO2溶液与10mL0.02 mol·L-1 KMnO4溶液恰好完全反应时,还原产物中Mn元素的化合价为
您最近一年使用:0次
2020-01-09更新
|
481次组卷
|
6卷引用:福建省泉州第一中学2020-2021学年高一下学期第一次月考化学试题
12-13高三上·福建福州·期末
名校
解题方法
5 . 下列实验“操作和现象”与“结论"对应关系正确的是
| 操作和现象 | 结论 | |
| A | 向装有Fe(NO3)2溶液的试管中加入稀H2SO4,在管口观察到红棕色气体 | HNO3分解成了NO2 |
| B | 向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再加入新制Cu(OH)2浊液,加热,没有红色沉淀生成 | 淀粉没有水解成葡萄糖 |
| C | 甲烷和氯气混合后在光照下,颜色逐渐褪去 | 甲烷和氯气发生了化合反应 |
| D | 向饱和Na2CO3中通入足量CO2,溶液变浑浊 | 析出了NaHCO3 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2016-12-09更新
|
434次组卷
|
3卷引用:2012届福建省福州市高三第一学期期末质量检查考试化学试卷
名校
6 . 硼、氮、铁、钴、镍等元素可形成结构、性质各异的物质,在生产、科研中发挥着重要用途。回答下列问题:
(1)下列不同状态的硼中,失去一个电子需要吸收能量最多的是______(填标号)。
(2)硼酸( )为片层状白色晶体,层内
)为片层状白色晶体,层内 分子间通过氢键相连,如图所示。
分子间通过氢键相连,如图所示。 水溶液中存在
水溶液中存在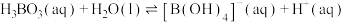 的平衡,回答下列问题。
的平衡,回答下列问题。__________ 。
②下列关于硼酸的说法正确的是__________ (填序号)。
a. 是一元酸 b.硼酸水溶液中水的电离平衡受到抑制
是一元酸 b.硼酸水溶液中水的电离平衡受到抑制
c.硼酸分子的稳定性与氢键有关 d.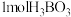 晶体中有
晶体中有 氢键
氢键
(3)叠氮化合物在化工上有重要应用, 为叠氮离子,写出与
为叠氮离子,写出与 互为等电子体的微粒的化学式
互为等电子体的微粒的化学式__________ (写出一种即可),其立体构型为__________ 。
(4) 的结构如图所示,
的结构如图所示, 中
中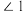 、
、 、
、 由大到小的顺序是
由大到小的顺序是____________________ 。 )晶胞沿
)晶胞沿 、
、 或
或 轴任意一个方向的投影如下图所示。晶胞中
轴任意一个方向的投影如下图所示。晶胞中 处于各顶角位置,则O处于
处于各顶角位置,则O处于__________ 位置。
①从该晶胞中能分割出来的结构图有_______ (填标号)。 ,
, 为阿伏加德罗常数的值。该晶胞中镍离子周围与其等距离且最近的镍离子有
为阿伏加德罗常数的值。该晶胞中镍离子周围与其等距离且最近的镍离子有__________ 个,该距离为__________ pm(仅列式不计算)。
(1)下列不同状态的硼中,失去一个电子需要吸收能量最多的是______(填标号)。
A.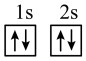 | B. |
C.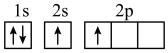 | D.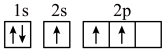 |
(2)硼酸(
 )为片层状白色晶体,层内
)为片层状白色晶体,层内 分子间通过氢键相连,如图所示。
分子间通过氢键相连,如图所示。 水溶液中存在
水溶液中存在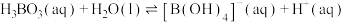 的平衡,回答下列问题。
的平衡,回答下列问题。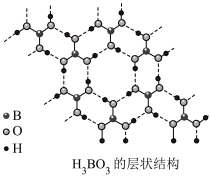
②下列关于硼酸的说法正确的是
a.
 是一元酸 b.硼酸水溶液中水的电离平衡受到抑制
是一元酸 b.硼酸水溶液中水的电离平衡受到抑制c.硼酸分子的稳定性与氢键有关 d.
 晶体中有
晶体中有 氢键
氢键(3)叠氮化合物在化工上有重要应用,
 为叠氮离子,写出与
为叠氮离子,写出与 互为等电子体的微粒的化学式
互为等电子体的微粒的化学式(4)
 的结构如图所示,
的结构如图所示, 中
中 、
、 、
、 由大到小的顺序是
由大到小的顺序是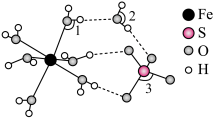
 )晶胞沿
)晶胞沿 、
、 或
或 轴任意一个方向的投影如下图所示。晶胞中
轴任意一个方向的投影如下图所示。晶胞中 处于各顶角位置,则O处于
处于各顶角位置,则O处于
①从该晶胞中能分割出来的结构图有
a.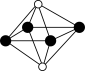 b.
b.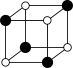 c.
c.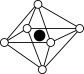 d.
d. e.
e.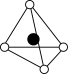
 ,
, 为阿伏加德罗常数的值。该晶胞中镍离子周围与其等距离且最近的镍离子有
为阿伏加德罗常数的值。该晶胞中镍离子周围与其等距离且最近的镍离子有
您最近一年使用:0次
名校
7 .  是一种无色有刺激性气味的液体,在生产生活中有重要用途,也是一种重要的化工原料。
是一种无色有刺激性气味的液体,在生产生活中有重要用途,也是一种重要的化工原料。
(1)已知利用合成气(主要成分 和
和 )在催化剂的作用下合成甲醇,发生反应为:
)在催化剂的作用下合成甲醇,发生反应为: 。反应过程中的能量变化如图所示,该反应为
。反应过程中的能量变化如图所示,该反应为_____________________ (填“放热”或“吸热”)反应。 (
( ,石墨)与适量
,石墨)与适量 反应生成
反应生成 和
和 ,吸收
,吸收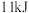 热量,请写出热化学方程式:
热量,请写出热化学方程式:_____________________________________________________ 。
(3)现在实验室中用 和
和 反应模拟甲醇合成反应,在
反应模拟甲醇合成反应,在 恒容密闭容器内,
恒容密闭容器内,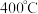 时发生反应:
时发生反应: ,体系中
,体系中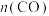 随时间的变化如表:
随时间的变化如表:
①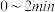 内,以
内,以 表示的该反应速率
表示的该反应速率
_____________________ 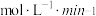 ;
;
②下列措施不能提高反应速率的有_____________________ (请用相应字母填空);
 升高温度
升高温度  恒
恒 、恒
、恒 下充入
下充入
 及时分离出
及时分离出
 恒
恒 、恒
、恒 下充入
下充入
 加入高效催化剂
加入高效催化剂
③下列叙述能说明反应达到平衡状态的是_____________________ (请用相应字母填空);
 和
和 的浓度保持不变
的浓度保持不变 
 每生成
每生成 的同时有
的同时有 键形成
键形成
 容器内气体密度保持不变
容器内气体密度保持不变
 容器内质量保持不变
容器内质量保持不变
 是一种无色有刺激性气味的液体,在生产生活中有重要用途,也是一种重要的化工原料。
是一种无色有刺激性气味的液体,在生产生活中有重要用途,也是一种重要的化工原料。(1)已知利用合成气(主要成分
 和
和 )在催化剂的作用下合成甲醇,发生反应为:
)在催化剂的作用下合成甲醇,发生反应为: 。反应过程中的能量变化如图所示,该反应为
。反应过程中的能量变化如图所示,该反应为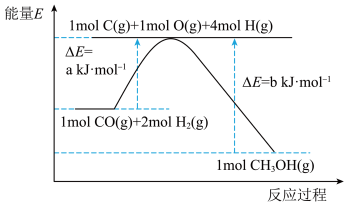
 (
( ,石墨)与适量
,石墨)与适量 反应生成
反应生成 和
和 ,吸收
,吸收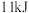 热量,请写出热化学方程式:
热量,请写出热化学方程式:(3)现在实验室中用
 和
和 反应模拟甲醇合成反应,在
反应模拟甲醇合成反应,在 恒容密闭容器内,
恒容密闭容器内,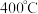 时发生反应:
时发生反应: ,体系中
,体系中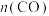 随时间的变化如表:
随时间的变化如表:时间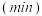 | 0 | 1 | 2 | 3 | 5 |
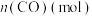 | 0.020 | 0.011 | 0.008 | 0.007 | 0.007 |
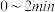 内,以
内,以 表示的该反应速率
表示的该反应速率
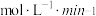 ;
;②下列措施不能提高反应速率的有
 升高温度
升高温度  恒
恒 、恒
、恒 下充入
下充入
 及时分离出
及时分离出
 恒
恒 、恒
、恒 下充入
下充入
 加入高效催化剂
加入高效催化剂③下列叙述能说明反应达到平衡状态的是
 和
和 的浓度保持不变
的浓度保持不变 
 每生成
每生成 的同时有
的同时有 键形成
键形成 容器内气体密度保持不变
容器内气体密度保持不变 容器内质量保持不变
容器内质量保持不变
您最近一年使用:0次
2024·福建·模拟预测
8 . 氙及其化合物在工业生产中有重要用途。
(1)1962年,化学家巴特利特合成了氙的第一个化合物 ,其在熔化时电离出
,其在熔化时电离出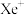 和
和 。Xe和
。Xe和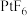 混合制得
混合制得 的反应可以表示如下:
的反应可以表示如下: )和1mol气态阴离子(
)和1mol气态阴离子( )所需要的能量叫做晶格能,
)所需要的能量叫做晶格能, 的晶格能为
的晶格能为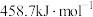 。
。
②Xe的第一电离能为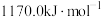 。
。
③
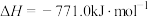 。
。
根据以上信息,计算反应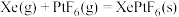

___________  。
。
(2)不久,在三个不同实验室里又分别合成了 、
、 、
、 三种简单化合物。其中一种化合物的晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,
三种简单化合物。其中一种化合物的晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°, 表示阿伏伽德罗常数的值。则该化合物的化学式为
表示阿伏伽德罗常数的值。则该化合物的化学式为___________ ,中心原子的价层电子对数为___________ 。 混合气体,反应体系中存在的平衡及相应部分数据如下表所示。
混合气体,反应体系中存在的平衡及相应部分数据如下表所示。
已知:分压=总压×该组分物质的量分数;
对于反应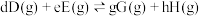
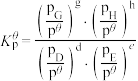
其中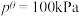 ,
,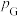 、
、 、
、 、
、 为各组分的平衡分压。
为各组分的平衡分压。
①
___________ 0(填“>”或“<”)。为提高平衡混合物中 的含量,应
的含量,应___________ 投料比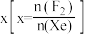 (填“增大”或“减小”)。
(填“增大”或“减小”)。
②673K时充入23.77molXe和 ,达平衡时容器内总压强
,达平衡时容器内总压强 ,各产物的物质的量如下表所示:
,各产物的物质的量如下表所示:
则 平衡转化率
平衡转化率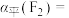
___________ (保留三位有效数字),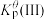
___________ 。
(1)1962年,化学家巴特利特合成了氙的第一个化合物
 ,其在熔化时电离出
,其在熔化时电离出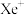 和
和 。Xe和
。Xe和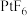 混合制得
混合制得 的反应可以表示如下:
的反应可以表示如下:
 )和1mol气态阴离子(
)和1mol气态阴离子( )所需要的能量叫做晶格能,
)所需要的能量叫做晶格能, 的晶格能为
的晶格能为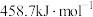 。
。②Xe的第一电离能为
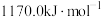 。
。③

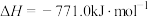 。
。根据以上信息,计算反应
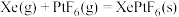

 。
。(2)不久,在三个不同实验室里又分别合成了
 、
、 、
、 三种简单化合物。其中一种化合物的晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,
三种简单化合物。其中一种化合物的晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°, 表示阿伏伽德罗常数的值。则该化合物的化学式为
表示阿伏伽德罗常数的值。则该化合物的化学式为
 混合气体,反应体系中存在的平衡及相应部分数据如下表所示。
混合气体,反应体系中存在的平衡及相应部分数据如下表所示。已知:分压=总压×该组分物质的量分数;
对于反应
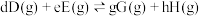
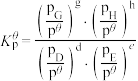
其中
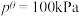 ,
,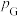 、
、 、
、 、
、 为各组分的平衡分压。
为各组分的平衡分压。标准压强平衡常数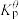 反应平衡 | 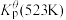 | 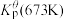 |
反应I: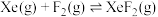  | 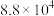 | 360 |
反应II: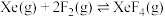  | ||
反应III:  | 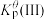 |

 的含量,应
的含量,应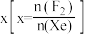 (填“增大”或“减小”)。
(填“增大”或“减小”)。②673K时充入23.77molXe和
 ,达平衡时容器内总压强
,达平衡时容器内总压强 ,各产物的物质的量如下表所示:
,各产物的物质的量如下表所示:| 化学式 |  |  |  |
| 物质的量/mol | 3.60 | 19.80 | 0.36 |
 平衡转化率
平衡转化率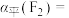
您最近一年使用:0次
名校
解题方法
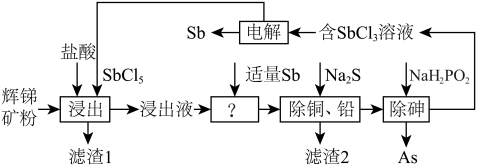
9 . 锑(Sb)及其化合物在工业上有许多用途。以辉锑矿(主要成分为Sb2S3,还含有 PbS、As2S3、CuO、SiO2等)为原料制备金属锑的工艺流程如图所示:
②常温下:Ksp(CuS)=1.27×10-36,Ksp(PbS)=9.04×10-29;
③溶液中离子浓度小于或等于1.0×10-5mol/L时,认为该离子沉淀完全。
(1)将辉锑矿粉碎的目的为___________ ,滤渣1中除了S之外,还有___________ (填化学式)。
(2)“浸出”时,Sb2S3发生反应的化学方程式为___________ 。
(3)浸出液中加入适量 Sb 的目的是___________ 。
(4)常温下,“除铜、铅”时Cu2+和Pb2+均沉淀完全,此时溶液中c(S2-)不低于___________ mol/L。Na2S也不宜过多,其原因为___________ 。
(5)“电解”时,被氧化的Sb元素与被还原的Sb元素的质量之比为___________ 。
②常温下:Ksp(CuS)=1.27×10-36,Ksp(PbS)=9.04×10-29;
③溶液中离子浓度小于或等于1.0×10-5mol/L时,认为该离子沉淀完全。
(1)将辉锑矿粉碎的目的为
(2)“浸出”时,Sb2S3发生反应的化学方程式为
(3)浸出液中加入适量 Sb 的目的是
(4)常温下,“除铜、铅”时Cu2+和Pb2+均沉淀完全,此时溶液中c(S2-)不低于
(5)“电解”时,被氧化的Sb元素与被还原的Sb元素的质量之比为
您最近一年使用:0次
2023-08-20更新
|
119次组卷
|
2卷引用:福建省八县(市)一中2022-2023学年高三上学期11月期中联考化学试题
名校
解题方法
10 . 铬(Cr)及其化合物用途广泛。请回答:
(1)基态铬原子的价层电子排布式_______ ,属于周期表的_______ 区。同周期的基态原子中,与Cr最高能层电子数相同的还有_______ (写元素符号)。
(2) 的三种结构:①
的三种结构:①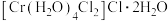 、②
、② 、③
、③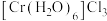 ,下列说法正确的是_______。
,下列说法正确的是_______。
(3)对配合物 进行加热时,配体
进行加热时,配体 比
比 更容易失去,请解释原因
更容易失去,请解释原因_______ 。
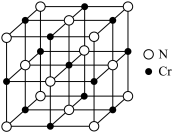
(4)铬的一种氮化物晶体的立方晶胞结构如图所示,若该晶体的密度为 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则晶胞中Cr原子之间的最近核间距为
,则晶胞中Cr原子之间的最近核间距为_______ pm(写出表达式即可)。
(1)基态铬原子的价层电子排布式
(2)
 的三种结构:①
的三种结构:①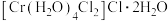 、②
、② 、③
、③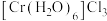 ,下列说法正确的是_______。
,下列说法正确的是_______。| A.①②③中Cr的配位数都是6 |
B.①中配合离子空间结构为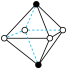 或 或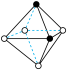 (已略去位于正八面体中心的Cr) (已略去位于正八面体中心的Cr) |
| C.②中存在的化学键有离子键、共价键、配位键和氢键 |
D.等物质的量的①②③分别与足量 溶液反应,得到AgCl物质的量也相等 溶液反应,得到AgCl物质的量也相等 |
 进行加热时,配体
进行加热时,配体 比
比 更容易失去,请解释原因
更容易失去,请解释原因(4)铬的一种氮化物晶体的立方晶胞结构如图所示,若该晶体的密度为
 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则晶胞中Cr原子之间的最近核间距为
,则晶胞中Cr原子之间的最近核间距为
您最近一年使用:0次
2023-04-11更新
|
868次组卷
|
5卷引用:福建省德化一中、永安一中、漳平一中三校协作2023届高三下学期5月适应性考试化学试题
福建省德化一中、永安一中、漳平一中三校协作2023届高三下学期5月适应性考试化学试题浙江省嘉兴市2023届高三二模考试化学试题(已下线)浙江省嘉兴市2023届高三下学期二模化学试题(已下线)山东省枣庄市2022-2023学年高三下学期二模考试化学试题变式题(结构与性质)浙江省金华第一中学2022-2023学年高二下学期6月月考化学试题



