名校
解题方法
1 . 向1L含0.01molNaAlO2和 的溶液中缓慢通入二氧化碳,随
的溶液中缓慢通入二氧化碳,随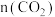 增大,先后发生三个不同的反应,当0.01mol < n(CO2)≤0.015mol 时发生的反应是: 2NaAlO2 + CO2 + 3H2O=2Al(OH)3↓+Na2CO3,下列对应关系正确的是( )
增大,先后发生三个不同的反应,当0.01mol < n(CO2)≤0.015mol 时发生的反应是: 2NaAlO2 + CO2 + 3H2O=2Al(OH)3↓+Na2CO3,下列对应关系正确的是( )
 的溶液中缓慢通入二氧化碳,随
的溶液中缓慢通入二氧化碳,随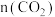 增大,先后发生三个不同的反应,当0.01mol < n(CO2)≤0.015mol 时发生的反应是: 2NaAlO2 + CO2 + 3H2O=2Al(OH)3↓+Na2CO3,下列对应关系正确的是( )
增大,先后发生三个不同的反应,当0.01mol < n(CO2)≤0.015mol 时发生的反应是: 2NaAlO2 + CO2 + 3H2O=2Al(OH)3↓+Na2CO3,下列对应关系正确的是( )| 选项 | 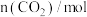 | 溶液中离子的物质的量浓度 |
| A | 0 |  |
| B | 0.01 |  |
| C | 0.015 | 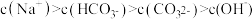 |
| D | 0.03 |  |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020-03-10更新
|
607次组卷
|
12卷引用:天津市耀华中学2023-2024学年高二上学期12月月考化学试卷
天津市耀华中学2023-2024学年高二上学期12月月考化学试卷安徽省亳州市2019-2020学年高三上学期期末教学质量检测化学试题(已下线)解密10 水溶液中离子反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密10 水溶液中离子反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)黑龙江省密山四中2020-2021学年高二下学期期末考试化学试题(已下线)考点25 盐类的水解-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点25 盐类的水解-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)课时43 粒子浓度大小比较-2022年高考化学一轮复习小题多维练(全国通用)(已下线)解密10 水溶液中的离子平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密10 水溶液中的离子平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)考点28 盐类的水解-备战2023年高考化学一轮复习考点帮(全国通用)第三章 第三节 盐类的水解 第2课时 影响盐类水解的因素 水解原理的应用
名校
2 . 下列实验操作、现象与结论对应关系正确的是
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向盛有Fe(NO3)2溶液的试管中加入0.1 mol·L-1H2SO4溶液 | 试管口出现红棕色气体 | 溶液中NO 被Fe2+还原为NO2 被Fe2+还原为NO2 |
| B | 向2 mL 1 mol/L NaOH溶液中先加入3滴1 mol/L MgCl2溶液,再加入3滴1 mol/L FeCl3溶液 | 先出现白色沉淀后又生成红褐色沉淀 | 证明Mg(OH)2沉淀可以转化为Fe(OH)3沉淀 |
| C | 在滴有酚酞的Na2CO3溶液中, 加入BaC12 | 溶液红色褪去 | CO32-在溶液中存在水解平衡 |
| D | 常温下,测定盐酸和醋酸溶液的pH | 盐酸pH小于醋酸pH | 证明相同条件下,在水中HCl电离程度大于CH3COOH |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020-01-27更新
|
277次组卷
|
2卷引用:天津市静海一中2019-2020学年高二第一学期(12月)学生学业能力调研考试化学试题
3 . 四氧化三铁( )磁性纳米颗粒稳定、容易生产且用途广泛,是临床诊断、生物技术和环境化学领域多种潜在应用的有力工具。
)磁性纳米颗粒稳定、容易生产且用途广泛,是临床诊断、生物技术和环境化学领域多种潜在应用的有力工具。
(1) 能和稀硫酸反应,生成的两种盐是
能和稀硫酸反应,生成的两种盐是___________ 。验证反应后溶液中含有 的最恰当的试剂是
的最恰当的试剂是___________ 。
A.氯水 B.酸性 溶液 C.KSCN溶液 D.NaOH溶液
溶液 C.KSCN溶液 D.NaOH溶液
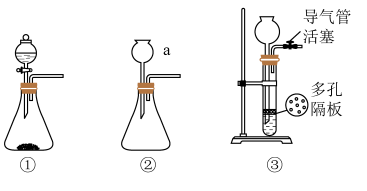
(2)铁粉在氧气中燃烧是制取 最为快捷的方法。A~D是制取四氧化三铁的系列装置,A装置用于制取二氧化碳气体,并要求气流稳定,流速可控。
最为快捷的方法。A~D是制取四氧化三铁的系列装置,A装置用于制取二氧化碳气体,并要求气流稳定,流速可控。___________ 。(从下图①、②、③中选择)
②在加入试剂之前,需对装置进行气密性检查。写出检查①的气密性的操作,___________ ,向分液漏斗中加足量水,塞紧玻璃塞,打开玻璃旋塞,过一会儿,水不再下滴,说明装置①的气密性良好。如果把分液漏斗改成恒压滴液漏斗,___________ (填“是”或“否”)可以用上述步骤检验装置的气密性?
③写出B装置中反应的化学方程式___________ 。
(3)氧化沉淀法也是制取 的一种常见方法,其制取流程如下图所示,
的一种常见方法,其制取流程如下图所示,___________ (填写化学式),由溶液N获得该副产品的操作是:加热浓缩→___________ →过滤洗涤→晶体加热至完全失去结晶水。
(4)某兴趣小组模仿上述流程制取 并测定其产率、具体操作如下:
并测定其产率、具体操作如下:
I.测定绿矾的含量:称取3.0g工业绿矾,配制成250.00mL溶液。量取25.00mL溶液于锥形瓶中,用0.01000 酸性
酸性 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液的平均体积为20.00mL。写出滴定时发生反应的离子方程式为
溶液的平均体积为20.00mL。写出滴定时发生反应的离子方程式为___________ 。
Ⅱ.称取300g工业绿矾,通过上述流程最终制得:50g 计算产品
计算产品 的产率为
的产率为___________ 。(保留4位有效数字)
 )磁性纳米颗粒稳定、容易生产且用途广泛,是临床诊断、生物技术和环境化学领域多种潜在应用的有力工具。
)磁性纳米颗粒稳定、容易生产且用途广泛,是临床诊断、生物技术和环境化学领域多种潜在应用的有力工具。(1)
 能和稀硫酸反应,生成的两种盐是
能和稀硫酸反应,生成的两种盐是 的最恰当的试剂是
的最恰当的试剂是A.氯水 B.酸性
 溶液 C.KSCN溶液 D.NaOH溶液
溶液 C.KSCN溶液 D.NaOH溶液(2)铁粉在氧气中燃烧是制取
 最为快捷的方法。A~D是制取四氧化三铁的系列装置,A装置用于制取二氧化碳气体,并要求气流稳定,流速可控。
最为快捷的方法。A~D是制取四氧化三铁的系列装置,A装置用于制取二氧化碳气体,并要求气流稳定,流速可控。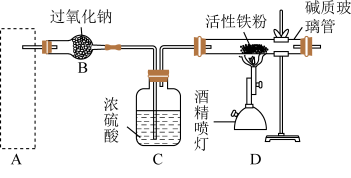
②在加入试剂之前,需对装置进行气密性检查。写出检查①的气密性的操作,
③写出B装置中反应的化学方程式
(3)氧化沉淀法也是制取
 的一种常见方法,其制取流程如下图所示,
的一种常见方法,其制取流程如下图所示,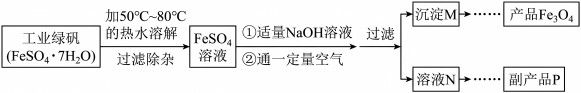
(4)某兴趣小组模仿上述流程制取
 并测定其产率、具体操作如下:
并测定其产率、具体操作如下:I.测定绿矾的含量:称取3.0g工业绿矾,配制成250.00mL溶液。量取25.00mL溶液于锥形瓶中,用0.01000
 酸性
酸性 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液的平均体积为20.00mL。写出滴定时发生反应的离子方程式为
溶液的平均体积为20.00mL。写出滴定时发生反应的离子方程式为Ⅱ.称取300g工业绿矾,通过上述流程最终制得:50g
 计算产品
计算产品 的产率为
的产率为
您最近一年使用:0次
名校
4 . 下列物质用途或操作正确且与盐类水解有关的一组是
①用热饱和硫酸铵溶液清洗铁器表面的铁锈
②用 水溶液制备
水溶液制备
③用氯化铁溶液和氨水制备氢氧化铁胶体
④实验室通常使用热的纯碱溶液去除油污
⑤在氯化氢氛围中灼烧氯化镁晶体制备无水氯化镁
⑥配制 溶液时将
溶液时将 晶体溶于浓硝酸中并加蒸馏水稀释至指定浓度
晶体溶于浓硝酸中并加蒸馏水稀释至指定浓度
⑦刻蚀印刷电路板用氯化铁作腐蚀液
⑧用泡沫灭火器灭火
①用热饱和硫酸铵溶液清洗铁器表面的铁锈
②用
 水溶液制备
水溶液制备
③用氯化铁溶液和氨水制备氢氧化铁胶体
④实验室通常使用热的纯碱溶液去除油污
⑤在氯化氢氛围中灼烧氯化镁晶体制备无水氯化镁
⑥配制
 溶液时将
溶液时将 晶体溶于浓硝酸中并加蒸馏水稀释至指定浓度
晶体溶于浓硝酸中并加蒸馏水稀释至指定浓度⑦刻蚀印刷电路板用氯化铁作腐蚀液
⑧用泡沫灭火器灭火
| A.①②④⑤⑧ | B.③④⑤⑦⑧ | C.①②④⑤⑥ | D.②③④⑤⑥ |
您最近一年使用:0次
5 . 配合物在许多方面有着广泛的用途,目前我国科学家利用配合物在能源转化与储存方面有着杰出的贡献,请根据题意回答下列问题:
(1)将 1 mol TiCl3·4H2O 溶于水,加入足量 AgNO3 溶液,得到 1 mol AgCl 沉淀,已知Ti3+的配位数为6,TiCl3·4H2O的化学式用配合物的形式表示为___ 。
(2)有下列实验:___ 。深蓝色晶体的化学式为___ 。
②写出蓝色沉淀溶解成深蓝色溶液的离子方程式___ 。
③[Cu(NH3)4]2+中H−N−H键角比NH3分子中H−N−H键角___ (填“大”或“小”)。[Cu(NH3)4]SO4中存在的化学键类型有___ (填标号)。
A.离子键 B.共价键 C.氢键 D.配位键
④物质在外磁场的作用下会发生磁化现象,在磁场中物质的磁性可分为顺磁性、反磁性和铁磁性,中心离子或原子上含有未成对电子的物质具有顺磁性,下列配离子中具有顺磁性的是___ (填标号)。
A.[Cr(OH)4] − B.[Cu(CN)4]3− C.[ZnCl4]2− D.[Fe(CN)6]4−
画出[Cu(CN)4]2−的结构:___ (用“→”或“—”将配位键表示出来)。
(1)将 1 mol TiCl3·4H2O 溶于水,加入足量 AgNO3 溶液,得到 1 mol AgCl 沉淀,已知Ti3+的配位数为6,TiCl3·4H2O的化学式用配合物的形式表示为
(2)有下列实验:

②写出蓝色沉淀溶解成深蓝色溶液的离子方程式
③[Cu(NH3)4]2+中H−N−H键角比NH3分子中H−N−H键角
A.离子键 B.共价键 C.氢键 D.配位键
④物质在外磁场的作用下会发生磁化现象,在磁场中物质的磁性可分为顺磁性、反磁性和铁磁性,中心离子或原子上含有未成对电子的物质具有顺磁性,下列配离子中具有顺磁性的是
A.[Cr(OH)4] − B.[Cu(CN)4]3− C.[ZnCl4]2− D.[Fe(CN)6]4−
画出[Cu(CN)4]2−的结构:
您最近一年使用:0次
名校
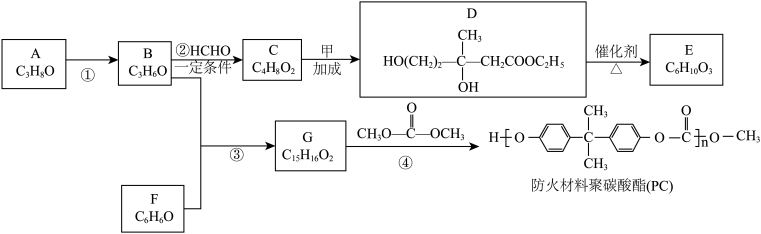
6 . A为重要的有机化工原料,B分子的核磁共振氢谱图中只有一个吸收峰,下列是合成防火材料聚碳酸酯(PC)和有广泛用途的内酯 的路线:
的路线:
已知:i: (
(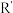 、
、 为氢原子或烃基)
为氢原子或烃基)
ii: (R、
(R、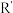 、
、 代表烃基)
代表烃基)
请回答下列问题:
(1)A的名称为___________ 。
(2)反应①的反应类型为___________ 。
(3)C分子含有的官能团是___________ 。
(4)化合物甲的分子式为___________ 。
(5)反应④的方程式为___________ 。
(6)E分子内含有六元环,可发生水解反应,其结构简式是___________ 。
(7)X是 的同分异构体,符合下列条件的
的同分异构体,符合下列条件的 的结构简式是
的结构简式是___________ 。
①
 能与足量银氨溶液生成
能与足量银氨溶液生成
 ;
;
② 中核磁共振氢谱中出现3组吸收峰,峰面积比为
中核磁共振氢谱中出现3组吸收峰,峰面积比为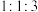 。
。
(8)以物质B为原料选用必要的无机试剂经过以下3步反应合成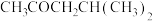 。
。
B CH3OCH2CH(CH3)2
CH3OCH2CH(CH3)2
写出中间产物1和中间产物2的结构简式:中间产物1_______ 、中间产物2________ 。
 的路线:
的路线:
已知:i:
 (
(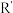 、
、 为氢原子或烃基)
为氢原子或烃基)ii:
 (R、
(R、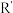 、
、 代表烃基)
代表烃基)请回答下列问题:
(1)A的名称为
(2)反应①的反应类型为
(3)C分子含有的官能团是
(4)化合物甲的分子式为
(5)反应④的方程式为
(6)E分子内含有六元环,可发生水解反应,其结构简式是
(7)X是
 的同分异构体,符合下列条件的
的同分异构体,符合下列条件的 的结构简式是
的结构简式是①

 能与足量银氨溶液生成
能与足量银氨溶液生成
 ;
;②
 中核磁共振氢谱中出现3组吸收峰,峰面积比为
中核磁共振氢谱中出现3组吸收峰,峰面积比为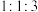 。
。(8)以物质B为原料选用必要的无机试剂经过以下3步反应合成
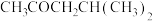 。
。B
 CH3OCH2CH(CH3)2
CH3OCH2CH(CH3)2写出中间产物1和中间产物2的结构简式:中间产物1
您最近一年使用:0次
名校
解题方法
7 . Ⅰ.化学来源于生活又服务于生活,请用化学用语回答下列问题:
(1)明矾 [ ]可用于净水。往明矾溶液中逐滴加
]可用于净水。往明矾溶液中逐滴加 溶液,若使
溶液,若使 恰好完全沉淀,发生反应的离子方程式为:
恰好完全沉淀,发生反应的离子方程式为:_______ ;若使 恰好完全沉淀,发生反应的离子方程式为:
恰好完全沉淀,发生反应的离子方程式为:_______ 。
(2)饮用水中的 对人类健康产生危害,为了降低饮用水中
对人类健康产生危害,为了降低饮用水中 的浓度,可以在碱性条件下用铝粉将
的浓度,可以在碱性条件下用铝粉将 还原为
还原为 。补充完整下列化学方程式,并在方程式上用单线桥标出该反应中电子转移的方向和数目:
。补充完整下列化学方程式,并在方程式上用单线桥标出该反应中电子转移的方向和数目:_________
_______Al+_______ _______NaOH=_______+_______
_______NaOH=_______+_______ _______
_______
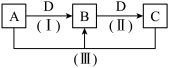
Ⅱ.A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素。在一定条件下相互转化的关系如下图所示。
请回答下列问题。
(3)若A是一种黄绿色气体,可用于自来水消毒,D是生产、生活中用量最大、用途最广的金属单质。写出实验室用 制备A的离子方程式:
制备A的离子方程式:_______ ;写出反应(Ⅲ)的离子方程式:_______ 。
(4)若A、B、C的溶液均显碱性,C为焙制糕点的发酵粉的主要成分之一
①写出反应(Ⅲ)的离子方程式:_______ 。
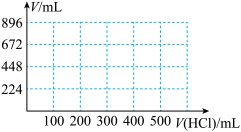
②取100mL B、C的混合溶液,其中B、C浓度均为0.1mol/L,向溶液中缓慢滴加0.1mol/L盐酸至过量,收集并测量产生气体的体积。刚开始滴加盐酸时,反应的离子方程式为_______ 。请将产生气体的体积(标准状况下且不考虑产生气体在水中的溶解)随滴加盐酸的体积变化的曲线绘制在下图坐标系中。______
(1)明矾 [
 ]可用于净水。往明矾溶液中逐滴加
]可用于净水。往明矾溶液中逐滴加 溶液,若使
溶液,若使 恰好完全沉淀,发生反应的离子方程式为:
恰好完全沉淀,发生反应的离子方程式为: 恰好完全沉淀,发生反应的离子方程式为:
恰好完全沉淀,发生反应的离子方程式为:(2)饮用水中的
 对人类健康产生危害,为了降低饮用水中
对人类健康产生危害,为了降低饮用水中 的浓度,可以在碱性条件下用铝粉将
的浓度,可以在碱性条件下用铝粉将 还原为
还原为 。补充完整下列化学方程式,并在方程式上用单线桥标出该反应中电子转移的方向和数目:
。补充完整下列化学方程式,并在方程式上用单线桥标出该反应中电子转移的方向和数目:_______Al+_______
 _______NaOH=_______+_______
_______NaOH=_______+_______ _______
_______
Ⅱ.A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素。在一定条件下相互转化的关系如下图所示。

请回答下列问题。
(3)若A是一种黄绿色气体,可用于自来水消毒,D是生产、生活中用量最大、用途最广的金属单质。写出实验室用
 制备A的离子方程式:
制备A的离子方程式:(4)若A、B、C的溶液均显碱性,C为焙制糕点的发酵粉的主要成分之一
①写出反应(Ⅲ)的离子方程式:
②取100mL B、C的混合溶液,其中B、C浓度均为0.1mol/L,向溶液中缓慢滴加0.1mol/L盐酸至过量,收集并测量产生气体的体积。刚开始滴加盐酸时,反应的离子方程式为

您最近一年使用:0次
解题方法
8 . VIA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
(1)基态Se原子的的核外电子排布式为___________
(2)O、S、Se原子的第一电离能由大到小的顺序为___________ 。
(3)H2O、H2S、H2Se、H2Te的键角依次减小,其主要原因可能是___________ 。
(4)H2Se的酸性比H2S________ (填“强”或“弱”),气态 分子的立体构型为
分子的立体构型为_______ , 离子的中心原子的杂化类型为
离子的中心原子的杂化类型为___________ ;
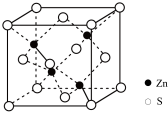
(5) 在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方
在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方 晶体结构如下图所示,S原子的配位数是
晶体结构如下图所示,S原子的配位数是___________ ,已知晶胞边长为 ,NA代表阿伏加德罗常数,则其密度为
,NA代表阿伏加德罗常数,则其密度为___________ (列式并计算)。
(6)定影液的主要成分是 ,它能溶解胶皮上为感光的
,它能溶解胶皮上为感光的 ,从而起到一定影响作用,为使定影液再生,进行如下的处理:
,从而起到一定影响作用,为使定影液再生,进行如下的处理:
① 在
在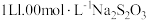 溶液中溶解的质量为
溶液中溶解的质量为___________ g。[已知 ,
,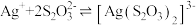 的平衡常数
的平衡常数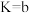 ]
]
②写定影液再生的离子方程式为___________ 。
(1)基态Se原子的的核外电子排布式为
(2)O、S、Se原子的第一电离能由大到小的顺序为
(3)H2O、H2S、H2Se、H2Te的键角依次减小,其主要原因可能是
(4)H2Se的酸性比H2S
 分子的立体构型为
分子的立体构型为 离子的中心原子的杂化类型为
离子的中心原子的杂化类型为(5)
 在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方
在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方 晶体结构如下图所示,S原子的配位数是
晶体结构如下图所示,S原子的配位数是 ,NA代表阿伏加德罗常数,则其密度为
,NA代表阿伏加德罗常数,则其密度为
(6)定影液的主要成分是
 ,它能溶解胶皮上为感光的
,它能溶解胶皮上为感光的 ,从而起到一定影响作用,为使定影液再生,进行如下的处理:
,从而起到一定影响作用,为使定影液再生,进行如下的处理:
①
 在
在 溶液中溶解的质量为
溶液中溶解的质量为 ,
,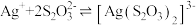 的平衡常数
的平衡常数 ]
]②写定影液再生的离子方程式为
您最近一年使用:0次
名校
9 . 下列表格是元素周期表的一部分。请按要求填空(用化学用语填写)
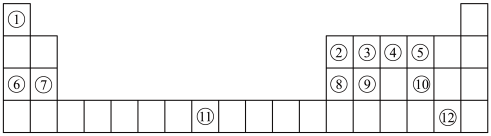
(1)元素①和⑥形成的化合物中存在的化学键类型为_______ 。
(2)用化学方程式表示④的简单氢化物的工业制法_______ 。
(3)写出由③④⑥形成的化合物的电子式_______ 。
(4)列举元素⑨形成的氧化物的一种用途_______ ,元素⑪在周期表中的位置_______ 。
(5)①⑤⑦⑧的简单离子半径由大到小的顺序为_______ 。
(6)写出⑧⑫的最高价氧化物的水化物发生反应的化学方程式为_______ 。
(7)X是由①④⑤⑧⑩形成的复盐,向含0.01 mol X的溶液中加入0.024 mol ,生成沉淀的物质的量的总和为
,生成沉淀的物质的量的总和为_______ 。

(1)元素①和⑥形成的化合物中存在的化学键类型为
(2)用化学方程式表示④的简单氢化物的工业制法
(3)写出由③④⑥形成的化合物的电子式
(4)列举元素⑨形成的氧化物的一种用途
(5)①⑤⑦⑧的简单离子半径由大到小的顺序为
(6)写出⑧⑫的最高价氧化物的水化物发生反应的化学方程式为
(7)X是由①④⑤⑧⑩形成的复盐,向含0.01 mol X的溶液中加入0.024 mol
 ,生成沉淀的物质的量的总和为
,生成沉淀的物质的量的总和为
您最近一年使用:0次
2022-11-28更新
|
340次组卷
|
2卷引用:天津市南开中学2022-2023学年高三上学期第二次月考化学试题
解题方法
10 . I.请根据下列相关信息,回答问题。
(1)请把B以及B同周期且原子序数比B小的原子按第一电离能从大到小的顺序排列:______ (用相应的元素符号表示);A、D两种元素中,电负性A______ D(填“>”或“<”)。
(2)基态B原子的价电子排布图为______ ,占据最高能级的电子云轮廓图形状为______ 。
(3)C的最高价含氧酸根离子的空间构型为______ ,中心原子杂化轨道类型为______ 。
(4)元素E与镍的第二电离能分别为:I2(E)=1959kJ/mol,I2(Ni)=1753kJ/mol,从原子结构知识解释I2(E)>I2(Ni)的原因是______ 。
Ⅱ.回答下列问题:
(5)第四周期的金属钴及其化合物在工业上有重要用途。请回答下列问题:
①基态Co原子的核外电子占据的最高能层符号为______ 。
②下列状态的钴中,电离最外层一个电子所需能量最大的是______ (填标号)。
A.[Ar]3d74s1 B.[Ar]3d74s2 C.[Ar]3d74s14p1 D.[Ar]3d74p1
③[Co(NH3)5Cl]Cl2是Co3+的一种重要配合物。该配合物的一种配体是NH3,NH3的空间结构呈______ 形,是______ (填“极性”或“非极性”)分子。
(6)根据第VA族元素及其化合物的结构和性质回答:
①N原子的基态原子核外电子排布式为______ 。
②NH3、PH3、AsH3的沸点由高到低的顺序为______ (填化学式,下同),键角由大到小的顺序为______ 。
(7)立方ZnS晶体结构如图所示,S周围紧邻且等距的Zn有______ 个,晶胞棱长为apm,密度为______ g•cm-3(NA表示阿伏加德罗常数的值,以含a、NA的代数式表示)。

| A | 基态原子最外层电子数是次外层的三倍 |
| B | 基态原子核外有13种不同运动状态的电子 |
| C | 与B同一周期,原子中未成对电子数是同周期中最多 |
| D | D2-的核外电子排布与氩原子相同 |
| E | 是ds区原子序数最小的元素 |
(2)基态B原子的价电子排布图为
(3)C的最高价含氧酸根离子的空间构型为
(4)元素E与镍的第二电离能分别为:I2(E)=1959kJ/mol,I2(Ni)=1753kJ/mol,从原子结构知识解释I2(E)>I2(Ni)的原因是
Ⅱ.回答下列问题:
(5)第四周期的金属钴及其化合物在工业上有重要用途。请回答下列问题:
①基态Co原子的核外电子占据的最高能层符号为
②下列状态的钴中,电离最外层一个电子所需能量最大的是
A.[Ar]3d74s1 B.[Ar]3d74s2 C.[Ar]3d74s14p1 D.[Ar]3d74p1
③[Co(NH3)5Cl]Cl2是Co3+的一种重要配合物。该配合物的一种配体是NH3,NH3的空间结构呈
(6)根据第VA族元素及其化合物的结构和性质回答:
①N原子的基态原子核外电子排布式为
②NH3、PH3、AsH3的沸点由高到低的顺序为
(7)立方ZnS晶体结构如图所示,S周围紧邻且等距的Zn有

您最近一年使用:0次



