名校
1 . 葡萄糖酸钙是一种有机钙盐,外观为白色结晶性或颗粒性粉末,无臭,无味,易溶于沸水,微溶于冷水,不溶于乙醇或乙醚等有机溶剂。葡萄糖酸钙临床上用于治疗骨质疏松症。实验室制备葡萄糖酸钙主要步骤如下:
I.葡萄糖酸溶液的制备
称取适量的葡萄糖[CH2OH(CHOH)4CHO],置于三颈烧瓶中,加入足量的溴水,在磁力搅拌器中沸水浴加热、搅拌得到无色透明的葡萄糖酸溶液。当氧化率达 80%以上时(60min),停止反应,把反应液冷却至 60-70℃待用。
Ⅱ.葡萄糖酸钙的制备
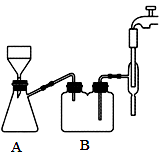
在搅拌下,分批加入足量的碳酸钙至葡萄糖酸溶液中。反应完全后,趁热用下图装置抽滤,得到澄清透明的葡萄糖酸钙溶液。将葡萄糖酸钙溶液转入 100ml 烧杯中冷却至室温,向烧杯中添加适量的无水乙醇,静置 10min 得到悬浊液,抽滤、洗涤、干燥得到白色的葡萄糖酸钙固体。
回答下列问题:
(1)步骤Ⅰ中,滴入溴水后,反应的化学方程式为_______ 。
(2)步骤 Ⅱ 中,判断碳酸钙已经足量的实验现象是_______ 。
(3)步骤Ⅱ抽滤时自来水流的作用是使瓶内与大气形成压强差,与普通过滤操作相比,抽滤的优点是_______ ;装置 B 的作用是_______ 。
(4)洗涤操作洗涤剂最合适的是_______ _(填序号),理由是_______ 。
A.冷水 B. 热水 C.乙醇
Ⅲ.葡萄糖酸钙中钙质量分数的测定
测定步骤:
(i)准确称取葡萄糖酸钙 m g,加入去离子水溶解,定容,配成 250mL 溶液。
(ii)用 c mol/L EDTA(H2Y2-)标准溶液润洗滴定管后,装入 EDTA 标准液,调至零刻度。
(iii)向 250mL 锥形瓶中加入 10mL 水、10mL NH3-NH4Cl 缓冲溶液和 5 mL 硫酸镁溶液。滴加 4 滴铬黑 T(HIn2-)指示剂,摇匀。用 EDTA 标准液滴定至终点。记录消耗的 EDTA 标准液的体积。
滴定过程中发生的反应如下:
Mg2+ + HIn2-(蓝色) MgIn-(酒红色)+ H+
MgIn-(酒红色)+ H+
Mg2+ + H2Y2- MgY2- + 2H+
MgY2- + 2H+
MgIn-(酒红色)+ H2Y2- MgY2- + H+ + HIn2-(蓝色)
MgY2- + H+ + HIn2-(蓝色)
(iv)向上述锥形瓶中加入 25.00 mL 葡萄糖酸钙溶液,摇匀,继续用 EDTA 标准液滴定至终点,记录消耗的 EDTA 标准液的总体积。平行滴定三次,测得步骤 iii 中消耗 EDTA 标准液的平均体积为 V1 L,步骤 iv 中 EDTA 标准液的平均总体积为 V2 L。
已知:配合物的稳定常数类似于化学平衡常数,如反应 Fe3+ + 3SCN- Fe(SCN)3 的平衡常数可以看做是 Fe(SCN)3 的稳定常数 K稳,一般情况下,配合物的稳定常数越大,配合物越稳定,两种离子更容易结合。已知下列化合物稳定常数的大小顺序为 CaY2- > MgY2- > MgIn- > CaIn-,其中CaIn-的稳定常数很小,CaIn-不稳定,易导致滴定终点提前。
Fe(SCN)3 的平衡常数可以看做是 Fe(SCN)3 的稳定常数 K稳,一般情况下,配合物的稳定常数越大,配合物越稳定,两种离子更容易结合。已知下列化合物稳定常数的大小顺序为 CaY2- > MgY2- > MgIn- > CaIn-,其中CaIn-的稳定常数很小,CaIn-不稳定,易导致滴定终点提前。
回答下列问题:
(5)步骤 iii 中加入硫酸镁的作用是_______ 。
(6)滴定终点的颜色变化为_______ 。
(7)步骤 iv 中,加入葡萄糖酸钙后发生反应的离子方程式为_______ ,_______ 。
(8)葡萄糖酸钙中钙的质量分数为_______ 。(用 V1、V2、m、c 的代数式表示)
I.葡萄糖酸溶液的制备
称取适量的葡萄糖[CH2OH(CHOH)4CHO],置于三颈烧瓶中,加入足量的溴水,在磁力搅拌器中沸水浴加热、搅拌得到无色透明的葡萄糖酸溶液。当氧化率达 80%以上时(60min),停止反应,把反应液冷却至 60-70℃待用。
Ⅱ.葡萄糖酸钙的制备
在搅拌下,分批加入足量的碳酸钙至葡萄糖酸溶液中。反应完全后,趁热用下图装置抽滤,得到澄清透明的葡萄糖酸钙溶液。将葡萄糖酸钙溶液转入 100ml 烧杯中冷却至室温,向烧杯中添加适量的无水乙醇,静置 10min 得到悬浊液,抽滤、洗涤、干燥得到白色的葡萄糖酸钙固体。

回答下列问题:
(1)步骤Ⅰ中,滴入溴水后,反应的化学方程式为
(2)步骤 Ⅱ 中,判断碳酸钙已经足量的实验现象是
(3)步骤Ⅱ抽滤时自来水流的作用是使瓶内与大气形成压强差,与普通过滤操作相比,抽滤的优点是
(4)洗涤操作洗涤剂最合适的是
A.冷水 B. 热水 C.乙醇
Ⅲ.葡萄糖酸钙中钙质量分数的测定
测定步骤:
(i)准确称取葡萄糖酸钙 m g,加入去离子水溶解,定容,配成 250mL 溶液。
(ii)用 c mol/L EDTA(H2Y2-)标准溶液润洗滴定管后,装入 EDTA 标准液,调至零刻度。
(iii)向 250mL 锥形瓶中加入 10mL 水、10mL NH3-NH4Cl 缓冲溶液和 5 mL 硫酸镁溶液。滴加 4 滴铬黑 T(HIn2-)指示剂,摇匀。用 EDTA 标准液滴定至终点。记录消耗的 EDTA 标准液的体积。
滴定过程中发生的反应如下:
Mg2+ + HIn2-(蓝色)
 MgIn-(酒红色)+ H+
MgIn-(酒红色)+ H+ Mg2+ + H2Y2-
 MgY2- + 2H+
MgY2- + 2H+ MgIn-(酒红色)+ H2Y2-
 MgY2- + H+ + HIn2-(蓝色)
MgY2- + H+ + HIn2-(蓝色) (iv)向上述锥形瓶中加入 25.00 mL 葡萄糖酸钙溶液,摇匀,继续用 EDTA 标准液滴定至终点,记录消耗的 EDTA 标准液的总体积。平行滴定三次,测得步骤 iii 中消耗 EDTA 标准液的平均体积为 V1 L,步骤 iv 中 EDTA 标准液的平均总体积为 V2 L。
已知:配合物的稳定常数类似于化学平衡常数,如反应 Fe3+ + 3SCN-
 Fe(SCN)3 的平衡常数可以看做是 Fe(SCN)3 的稳定常数 K稳,一般情况下,配合物的稳定常数越大,配合物越稳定,两种离子更容易结合。已知下列化合物稳定常数的大小顺序为 CaY2- > MgY2- > MgIn- > CaIn-,其中CaIn-的稳定常数很小,CaIn-不稳定,易导致滴定终点提前。
Fe(SCN)3 的平衡常数可以看做是 Fe(SCN)3 的稳定常数 K稳,一般情况下,配合物的稳定常数越大,配合物越稳定,两种离子更容易结合。已知下列化合物稳定常数的大小顺序为 CaY2- > MgY2- > MgIn- > CaIn-,其中CaIn-的稳定常数很小,CaIn-不稳定,易导致滴定终点提前。回答下列问题:
(5)步骤 iii 中加入硫酸镁的作用是
(6)滴定终点的颜色变化为
(7)步骤 iv 中,加入葡萄糖酸钙后发生反应的离子方程式为
(8)葡萄糖酸钙中钙的质量分数为
您最近一年使用:0次
2 . 羟基自由基(·OH)是自然界中氧化性仅次于氟的氧化剂。我国科学家设计了一种能将苯酚氧化为 CO2 和 H2O 的原电池-电解池组合装置(如下图所示),该装置能实现发电、环保二位一体。下列说法错误的是
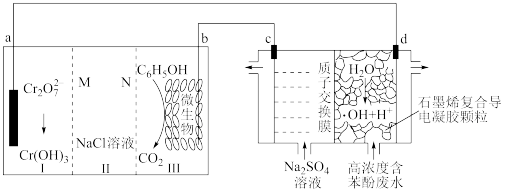

| A.系统工作时,电流由 b 极经 III、II、I 室流向 a 极 |
| B.d 极区苯酚被氧化的化学方程式为 C6H5OH+28·OH = 6 CO2↑+17 H2O |
| C.系统工作时,每转移 28mol e-消耗 1mol 苯酚 |
D.a 电极的电极反应式:7H2O + Cr2O + 6 e-=2 Cr(OH)3 + 8 OH- + 6 e-=2 Cr(OH)3 + 8 OH- |
您最近一年使用:0次
名校
解题方法
3 . 如图所示,在注射器里吸入20mL NO,然后吸入5mL水。若再吸入30mL空气(按O2体积占1/5计算),夹住弹簧夹,观察现象(不考虑摩擦力)。已知常温常压下,气体摩尔体积为24.5 L·mol-1,则下列叙述不正确的是
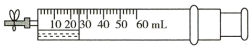

| A.最终剩余气体体积约为36mL |
| B.可观察到注射器的活塞缓缓向右移动 |
| C.可观察到注射器内气体由无色变成红棕色,最后变成无色 |
| D.若反应前后液体体积不变,所得硝酸溶液的浓度约为0.07mol/L |
您最近一年使用:0次
2022-05-03更新
|
1809次组卷
|
6卷引用:黑龙江省佳木斯市第十二中学2022-2023学年高三上学期期中考试化学试题
名校
解题方法
4 . 有关 反应的叙述正确的为
反应的叙述正确的为
 反应的叙述正确的为
反应的叙述正确的为| A.还原剂与氧化剂物质的量之比为5:3 |
| B.生成lmolO2,反应共转移4mol电子 |
C.若有5mol水做还原剂时,被BrF3还原的BrF3为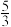 mol mol |
| D.若有5mol水参与反应时,被水还原的BrF3为2mol |
您最近一年使用:0次
2019-11-24更新
|
2662次组卷
|
7卷引用:黑龙江农垦建三江管理局第一高级中学2021届高三上学期12月月考化学试题
5 . 将由FeSO4、Ba(OH)2、AlCl3三种固体组成的混合物溶于足量的水中,用玻璃棒搅拌,充分溶解,一段时间后,向稳定的混合物溶液中滴加1mol·L-1的稀硫酸,加入稀硫酸的体积与生成沉淀的物质的量关系如图所示。下列有关判断不正确的是( )


| A.AB段发生反应的离子方程式为:Ba2++SO42-+2H++2OH-=BaSO4↓+2H2O |
| B.D点表示的溶液呈酸性 |
| C.C点表示的沉淀的化学式为Al(OH)3、BaSO4、Fe(OH)2 |
| D.混合物中FeSO4和AlCl3的物质的量相等 |
您最近一年使用:0次
6 . MgCO3和CaCO3的能量关系如图所示(M=Ca、Mg):不正确 的是

| A.ΔH1(MgCO3)>ΔH1(CaCO3)>0 |
| B.ΔH2(MgCO3)=ΔH2(CaCO3)>0 |
| C.ΔH1(CaCO3)-ΔH1(MgCO3)=ΔH3(CaO)-ΔH3(MgO) |
| D.对于MgCO3和CaCO3,ΔH1+ΔH2>ΔH3 |
您最近一年使用:0次
2019-04-12更新
|
7412次组卷
|
49卷引用:黑龙江省富锦市第一中学2022-2023学年高二下学期第一次考试化学试题
黑龙江省富锦市第一中学2022-2023学年高二下学期第一次考试化学试题2019年4月浙江省普通高校招生选考科目考试化学试题天津市第一中学2018-2019学年高一下学期期末考试化学试题黑龙江省鹤岗市第一中学2020届高三11月月考化学试题内蒙古第一机械制造(集团)有限公司第一中学2019-2020学年高二10月月考化学试题(已下线)【南昌新东方】江西省南昌市第三中学2019-2020学年度高二上学期期中化学试题浙江省宁波市余姚中学2019-2020学年高二上学期期中考试化学试题2019年秋高三化学复习强化练习—— 盖斯定律及其应用河南省洛阳市2019-2020学年高三上学期尖子生第一次考试化学试题山东省滕州市第一中学2020届高三3月线上模拟考试化学试题(已下线)专题九 化学能与热能(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训人教版(2019)高二选择性必修第一册 第一章 化学反应的热效应 第二节 反应热的计算 高考帮安徽省池州市第一中学2020-2021学年高二上学期9月月考化学试题鲁科版(2019)高二选择性必修第一册第1章 化学反应与能量变化 过高考 3年真题强化闯关人教版(2019)高二化学选择性必修1第一章 化学反应的热效应 过高考 3年真题强化闯关(已下线)【浙江新东方】97(已下线)小题必刷23 焓变与热化学方程式——2021年高考化学一轮复习小题必刷(通用版)(已下线)小题必刷24 盖斯定律及反应热计算——2021年高考化学一轮复习小题必刷(通用版)(已下线)解密08 化学反应与能量(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密08 化学反应与能量(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练选择性必修1(SJ)专题1专题培优专练(已下线)课时29 盖斯定律及反应热计算-2022年高考化学一轮复习小题多维练(全国通用)选择性必修1 专题1 素养检测(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(浙江专用)辽宁省沈阳市实验中学2021-2022学年高一上学期10月月考化学试题(已下线)专题10.化学反应中的能量变化-十年(2012-2021)高考化学真题分项汇编(浙江专用)四川省广安友谊中学2021-2022学年上学期高二10月月考化学试题湖北省石首市2021-2022学年高二上学期期中考试化学试题(已下线)专题09 化学反应与能量变化-备战2022年高考化学学霸纠错(全国通用)(已下线)解密08 化学反应与能量(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密08 化学反应与能量(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)专题7 盖斯定律专练(已下线)考点17 化学反应的热效应-备战2023年高考化学一轮复习考点帮(全国通用)河南省信阳市2021-2022学年高二上学期期中考试化学试题第一章 综合拔高练(已下线)高中化学-高二上-9(已下线)易错点18 化学反应与能量-备战2023年高考化学考试易错题黑龙江省大庆市肇州县第二中学2022-2023学年高三上学期第二次月考化学试题湖南省长沙市第一中学2022-2023学年高三上学期月考卷(五)化学试题湖南省攸县第二中学2022-2023学年高三第六次月考化学试题(已下线)第六章 化学反应与能量 第34讲 反应热的计算天津市区重点中学2023届高三毕业班联考(一)化学试题广东省揭阳市惠来县第一中学2022-2023学年高二下学期第一次月考化学试题山西省孝义市2022-2023学年高二4月月考化学试卷(已下线)专题08 化学反应中的能量变化(已下线)2019年高考浙江卷化学试题变式题(单选题21-25)(已下线)考点17 化学反应的热效应(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)黑龙江省哈尔滨第三中学2023-2024学年高二上学期第二次验收考试化学试题
名校
7 . 阿伏加德罗常数的值为NA,下列叙述中错误的是
①标准状况下,2.24 L水中含有0.1 NA个水分子
②常温常压下,32g SO2 含有的分子数约为3.01×1023
③2 mol NaOH的摩尔质量为80g/mol
④H2的气体摩尔体积约为22.4L/mol
⑤标况下,22.4L由N2和N2O组成的混合气体中,所含有的氮原子的物质的量为2mol
⑥2mol/L的CaCl2溶液中Cl-的数目为4NA
⑦常温常压下,1mol氦气含有的原子数为NA
⑧11.2 L氯气中含有 NA个氯原子
①标准状况下,2.24 L水中含有0.1 NA个水分子
②常温常压下,32g SO2 含有的分子数约为3.01×1023
③2 mol NaOH的摩尔质量为80g/mol
④H2的气体摩尔体积约为22.4L/mol
⑤标况下,22.4L由N2和N2O组成的混合气体中,所含有的氮原子的物质的量为2mol
⑥2mol/L的CaCl2溶液中Cl-的数目为4NA
⑦常温常压下,1mol氦气含有的原子数为NA
⑧11.2 L氯气中含有 NA个氯原子
| A.①③④⑥⑧ | B.①④⑤⑥⑧ | C.①②④⑥⑧ | D.②③④⑤⑦ |
您最近一年使用:0次
2017-02-17更新
|
2984次组卷
|
16卷引用:黑龙江省佳木斯市第一中学2021-2022学年高一上学期12月月考化学试题
黑龙江省佳木斯市第一中学2021-2022学年高一上学期12月月考化学试题2016-2017学年黑龙江大庆铁人中学高一上期中化学卷陕西省西安市长安区第一中学2017-2018学年高一(实验班)上学期期中考试化学试题内蒙古巴彦淖尔市第一中学2017-2018学年高一上学期期中考试化学试题(A)河北省高阳中学2017-2018学年高一1月月考化学试题湖北省黄冈市浠水实验高中2019-2020学年高一10月月考化学试题内蒙古包头稀土高新区二中2019-2020学年高一10月月考化学试题青海省海东市第二中学2019-2020学年高一上学期期中考试化学试题福建省龙海市程溪中学2019-2020学年高一上学期期中考试化学试题福建省泉州市永春第一中学2020届高三上学期期初考试化学试题湖北省黄冈市浠水县实验高级中学2019-2020学年高一上学期9月月考化学试题福建省泰宁第一中学2018-2019学年高一上学期第二阶段考试化学试题(已下线)【全国百强校】黑龙江省哈尔滨市第六中学2018-2019学年高二6月阶段性测试化学试题(已下线)【南昌新东方】5.莲塘一中 曹永康 程秀丽广东省中山市第一中学丰山学部2019-2020学年高一上学期第三次段化学试题福建省福州市八县(市、区)协作校 2021-2022学年高一上学期11月份期中联考化学试题
13-14高二·新疆乌鲁木齐·期末
名校
8 . 现有室温下浓度均为1×10﹣3mol/L的几种溶液:①盐酸、②硫酸、③醋酸、④氯化铵、⑤氨水、⑥NaOH溶液,回答下列问题:
(1)将③、⑥混合后,若溶液呈中性,则消耗两溶液的体积为③_____ ⑥(填“>”、“<”或“=”).溶液中的离子浓度由大到小的顺序为_____ .
(2)将等体积的①、⑤混合,则溶液的pH_____ 7(填“>”、“<”或“=”),用离子方程式说明其原因_____ .
(3)向相同体积的①、②、③溶液中分别加入相同的且足量的锌粒,反应的初始速率由快到慢的顺序为_____ ,最终产生H2总量的关系为_____
(4)向相同体积的①、③溶液中分别加入相同浓度、相同体积的CH3COONa溶液,充分混合后,混合液的pH大小关系为①_____ ③(填“>”、“<”或“=”)
(5)若将等体积的⑤、⑥溶液加热至相同温度后,溶液的pH⑤_____ ⑥(填“>”、“<”或“=”)
(1)将③、⑥混合后,若溶液呈中性,则消耗两溶液的体积为③
(2)将等体积的①、⑤混合,则溶液的pH
(3)向相同体积的①、②、③溶液中分别加入相同的且足量的锌粒,反应的初始速率由快到慢的顺序为
(4)向相同体积的①、③溶液中分别加入相同浓度、相同体积的CH3COONa溶液,充分混合后,混合液的pH大小关系为①
(5)若将等体积的⑤、⑥溶液加热至相同温度后,溶液的pH⑤
您最近一年使用:0次
2016-12-09更新
|
292次组卷
|
4卷引用:黑龙江省佳木斯一中2021-2022学年高二上学期第二次月考化学试题
黑龙江省佳木斯一中2021-2022学年高二上学期第二次月考化学试题(已下线)2014届新疆乌鲁木齐市兵团二中高二(上)期末化学试卷(已下线)2013-2014吉林省白城市高二上学期期末考试化学(B卷)试卷2015-2016学年内蒙古巴彦淖尔一中高二普通班上期中化学试卷



