1 . 唑草酮是一种广谱除草剂,在农业上应用范围比较广,除草效果比较好。唑草酮的一种合成路线如下图。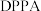 是一种叠氮化试剂。
是一种叠氮化试剂。
回答下列问题:
(1)C中官能团的名称为___________ 。
(2)由A生成C的反应类型为___________ ,该反应的目的是___________ 。
(3) 的化学方程式为
的化学方程式为___________ 。
(4)已知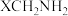 中
中 键的极性越大,则
键的极性越大,则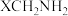 的碱性越弱。下列物质的碱性由强到弱的顺序为
的碱性越弱。下列物质的碱性由强到弱的顺序为___________ (填标号)。___________ 种。
①含有苯环,且苯环上有3个取代基
②能发生银镜反应
③含有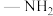
(6)化合物 的合成路线如下图(部分反应条件已略去),其中M和N的结构简式分别为
的合成路线如下图(部分反应条件已略去),其中M和N的结构简式分别为___________ 和___________ 。

 是一种叠氮化试剂。
是一种叠氮化试剂。回答下列问题:
(1)C中官能团的名称为
(2)由A生成C的反应类型为
(3)
 的化学方程式为
的化学方程式为(4)已知
 中
中 键的极性越大,则
键的极性越大,则 的碱性越弱。下列物质的碱性由强到弱的顺序为
的碱性越弱。下列物质的碱性由强到弱的顺序为a. 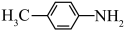 b.
b. 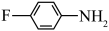 c.
c.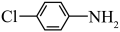
①含有苯环,且苯环上有3个取代基
②能发生银镜反应
③含有
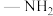
(6)化合物
 的合成路线如下图(部分反应条件已略去),其中M和N的结构简式分别为
的合成路线如下图(部分反应条件已略去),其中M和N的结构简式分别为
您最近一年使用:0次
2024-05-29更新
|
250次组卷
|
2卷引用:2024届黑龙江省齐齐哈尔市高三下学期三模化学试题
名校
2 . 在温度、容积相同的3个密闭容器中,按不同方式投入反应,保持恒温、恒容,测得反应达到平衡时的有关数据如下(已知N2(g)+3H2(g) 2NH3(g)
2NH3(g) 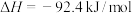 )
)
下列说法正确的是
 2NH3(g)
2NH3(g) 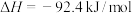 )
)| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol N2、3mol H2 | 2mol NH3 | 4mol NH3 |
| 的浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
| 体系压强 | p1 | p2 | p3 |
| 反应物转化率 | 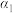 |  | 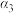 |
A. | B.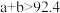 | C.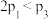 | D.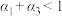 |
您最近一年使用:0次
3 . 秦俑彩绘中含有难溶的铅白(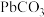 )和黄色的
)和黄色的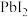 。常温下,
。常温下,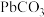 和
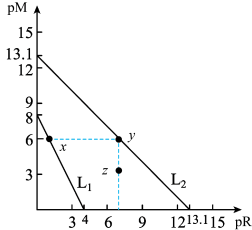
和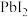 在不同的溶液中分别达到沉淀溶解平衡时pM与pR的关系如图所示,其中pM为阳离子浓度的负对数,pR为阴离子浓度的负对数。下列说法错误的是
在不同的溶液中分别达到沉淀溶解平衡时pM与pR的关系如图所示,其中pM为阳离子浓度的负对数,pR为阴离子浓度的负对数。下列说法错误的是
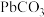 )和黄色的
)和黄色的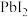 。常温下,
。常温下,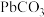 和
和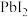 在不同的溶液中分别达到沉淀溶解平衡时pM与pR的关系如图所示,其中pM为阳离子浓度的负对数,pR为阴离子浓度的负对数。下列说法错误的是
在不同的溶液中分别达到沉淀溶解平衡时pM与pR的关系如图所示,其中pM为阳离子浓度的负对数,pR为阴离子浓度的负对数。下列说法错误的是
A.完全沉淀废液中的 , , 的效果不如 的效果不如 |
B.z点,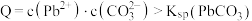 |
C.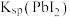 的数量级为 的数量级为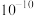 |
D.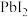 (s)转化为 (s)转化为 (s)的反应趋势很大 (s)的反应趋势很大 |
您最近一年使用:0次
2023-08-30更新
|
603次组卷
|
2卷引用:黑龙江省齐齐哈尔市2023-2024学年高三下学期一模化学试题
名校
4 . 高锰酸钾是锰的重要化合物和常用的氧化剂。以下是工业上用软锰矿制备高锰酸钾的一种工艺流程:
(1) KMnO4稀溶液是一种常用的消毒剂。其消毒原理与下列_____ 物质相似。
A.75%酒精 B.双氧水 C.苯酚 D.“84”消毒液(NaClO溶液)
(2)操作Ⅰ的名称是________ ;操作Ⅱ是根据KMnO4和K2CO3两物质在__________ (填性质)上差异,采用 __________ (填操作步骤)、趁热过滤得到KMnO4粗晶体的。
(3)上述流程中可以循环使用的物质有石灰、CO2、____ 和____ (写化学式)。
(4) 向K2MnO4溶液中通入CO2以制备KMnO4,该反应中的还原剂是_______ 。
(5) 铋酸钠(NaBiO3,不溶于水)用于定性检验酸性溶液中Mn2+的存在(铋元素的还原产物为Bi3+,Mn的氧化产物为+7价),写出反应的离子方程式:__________________ 。
(6) 写出MnO2、KOH的熔融混合物中通入空气时发生的主要反应的化学方程式:________________ 。
(7)若不考虑物质循环与制备过程中的损失,则1mol MnO2可制得_____ mol KMnO4。

(1) KMnO4稀溶液是一种常用的消毒剂。其消毒原理与下列
A.75%酒精 B.双氧水 C.苯酚 D.“84”消毒液(NaClO溶液)
(2)操作Ⅰ的名称是
(3)上述流程中可以循环使用的物质有石灰、CO2、
(4) 向K2MnO4溶液中通入CO2以制备KMnO4,该反应中的还原剂是
(5) 铋酸钠(NaBiO3,不溶于水)用于定性检验酸性溶液中Mn2+的存在(铋元素的还原产物为Bi3+,Mn的氧化产物为+7价),写出反应的离子方程式:
(6) 写出MnO2、KOH的熔融混合物中通入空气时发生的主要反应的化学方程式:
(7)若不考虑物质循环与制备过程中的损失,则1mol MnO2可制得
您最近一年使用:0次
2019-09-24更新
|
1215次组卷
|
3卷引用:黑龙江省齐齐哈尔市第八中学2020届高三10月月考化学试题
名校
5 . 在25℃时,向50.00mL未知浓度的氨水中逐滴加入0.5mol·L-1的HCl溶液。滴定过程中,溶液的pOH[pOH=-lgc(OH-)]与滴入HCl溶液体积的关系如图所示,则下列说法中正确的是
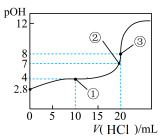
| A.图中②点所示溶液的导电能力弱于①点 |
| B.③点处水电离出的c(H+)=1×10-8mol·L-1 |
| C.图中点①所示溶液中,c(C1-)>c(NH4+)>c(OH-)>c(H+) |
| D.25℃时氨水的Kb约为5×10-5.6mol·L-1 |
您最近一年使用:0次
2019-05-24更新
|
3124次组卷
|
13卷引用:黑龙江省齐齐哈尔市2023-2024学年高二上学期1月期末化学试题
黑龙江省齐齐哈尔市2023-2024学年高二上学期1月期末化学试题【市级联考】山东省烟台市、菏泽市2019届高三下学期5月高考适应性练习(一)理科综合化学试题四川省泸县第五中学2020届高三上学期开学考试理综化学试题备考突破2020高三化学专题强化集训——盐类水解中三大守恒的应用安徽省定远县重点中学2020届高三下学期3月线上模拟考试理科综合化学试题湖南省长沙市湖南师范大学附属中学2022-2023学年高二上学期期末考试化学试题 湖南师范大学附属中学2022-2023学年高二上学期期末考试化学试题山西省实验中学2023-2024学年高二上学期期中考试化学试题江西省宜春市上高中学2023-2024学年高二上学期第二次月考化学试卷 黑龙江省双鸭山市第一中学2023-2024学年高二下学期开学化学试题四川省绵阳中学2023-2024学年高二下学期开学化学试题2024年江西省宜春市第一中学高三下学期第三次模拟考试化学试卷四川省达州外国语学校2023-2024学年高二下学期3月月考化学试题
6 . 已知体积为2 L的恒容密闭容器中发生反应:2SO2(g)+O2(g) 2SO3(g),请根据化学反应的有关原理回答下列问题:
2SO3(g),请根据化学反应的有关原理回答下列问题:
(1)一定条件下,充入2.0 mol SO2 (g) 和1.0 mol O2(g),20 s后达平衡,测得SO3的体积分数为50%,则用SO2表示该反应在这20 s内的反应速率为__________ mol/(L·s)。
(2)该反应的平衡常数K=___________ ,若降温其值增大,则该反应的ΔH_____ 0(填“>”或“<”或“=”)。
(3)如图,P是可自由平行滑动的活塞,在相同温度时,向A容器中充入4 mol SO3(g),关闭K,向B容器中充入2 mol SO3(g),两容器内分别充分发生反应。已知起始时容器A和B的体积均为a L。试回答:反应达到平衡时容器B的体积为1.25 a L,若打开K,一段时间后重新达到平衡,容器B的体积为________ L(连通管中气体体积忽略不计,且不考虑温度的影响)。

(4)如图表示该反应的速率(v)随时间(t)的变化的关系:据图分析:你认为t1时改变的外界条件可能是___________________ ;t6时保持压强不变向体系中充入少量He气,平衡____________ 移动。(填“向左”“向右”或“不”)。

 2SO3(g),请根据化学反应的有关原理回答下列问题:
2SO3(g),请根据化学反应的有关原理回答下列问题:(1)一定条件下,充入2.0 mol SO2 (g) 和1.0 mol O2(g),20 s后达平衡,测得SO3的体积分数为50%,则用SO2表示该反应在这20 s内的反应速率为
(2)该反应的平衡常数K=
(3)如图,P是可自由平行滑动的活塞,在相同温度时,向A容器中充入4 mol SO3(g),关闭K,向B容器中充入2 mol SO3(g),两容器内分别充分发生反应。已知起始时容器A和B的体积均为a L。试回答:反应达到平衡时容器B的体积为1.25 a L,若打开K,一段时间后重新达到平衡,容器B的体积为

(4)如图表示该反应的速率(v)随时间(t)的变化的关系:据图分析:你认为t1时改变的外界条件可能是

您最近一年使用:0次
名校
7 . 足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与33.6LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5 mol·L-1 NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是
| A.2.5L | B.1.2L | C.1.5L | D.3 L |
您最近一年使用:0次
2017-11-14更新
|
1806次组卷
|
4卷引用:黑龙江省齐齐哈尔市第八中学2020届高三10月月考化学试题
8 . 将等物质的量的镁和铝混合,取等质量该混合物四份,分别加到足量的下列溶液中,充分反应后,放出氢气最多的是 ( )
| A.4 mol·L-1 HNO3 | B.3 mol·L-1HCl | C.8 mol·L-1 NaOH | D.18 mol·L-1 H2SO4 |
您最近一年使用:0次
2017-09-09更新
|
1636次组卷
|
28卷引用:黑龙江省齐齐哈尔市第八中学2018届高三上学期第一阶段测试化学试题
黑龙江省齐齐哈尔市第八中学2018届高三上学期第一阶段测试化学试题(已下线)2010年江苏省泰兴市重点中学高三上学期第一次检测化学试题(已下线)吉林省长春市十一高中2010-2011学年度高三上学期期中考(已下线)2011届陕西省西安交大阳光中学高三上学期期中考试化学卷(已下线)2011届河南省郑州市五校联考高三上学期期中考试化学试卷(已下线)2011届年广东省深圳高级中学高三上学期期中考试(理综)化学部分(已下线)2011-2012学年甘肃省兰州一中高二上学期期中考试化学(文)试卷(已下线)2011-2012学年甘肃省张掖中学高二上学期期中考试化学(文)试卷(已下线)2014年高一下学期化学必修2 4-1-1 开发金属和海水资源练习卷2016届江汉油田海南海政学校高三月考化学试卷2015-2016学年山东省寿光现代中学高一下3月月考化学卷2015-2016学年天津市静海一中高一6月学业调研化学试卷2015-2016学年山西重点中学协作体高二下学期期末化学试卷2015-2016学年湖南衡阳八中高二第二学期期末考化学卷2017届河北省涞水县波峰中学高三8月月考化学试卷2017届福建省莆田二十五中高三上第二次月考化学试卷山东省师范大学附属中学2016-2017学年高一下学期期中考试(文)化学试题山东省师范大学附属中学2016-2017学年高二下学期第三次学分认定考试(文)化学试题广西钦州市钦州港经济技术开发区中学2018届高三上学期开学考试化学试题人教版化学必修一.4.4氨 硝酸 硫酸同步测试卷2019届高三化学镁、铝及其化合物一轮复习针对训练题(已下线)2019高考备考一轮复习精品资料 第三章 金属及其化合物 第2讲 镁、铝及其重要化合物【教学案】【全国百强校】安徽省合肥市第六中学2018-2019学年高一下学期开学考试化学试题河南省安阳市第三十六中学2018-2019学年高二6月月考化学试题上海市闵行区华二中学2017-2018学年高二上学期期中考试化学试题黑龙江省双鸭山市第一中学2019-2020学年高二下学期期末考试化学试题广东省中山市中山纪念中学2020届高三第二次质量检测化学试题上海市黄浦区大同中学2020-2021学年高二上学期期中考试化学试题
9 . 取一定量的铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有200 mL H2SO4溶液的烧杯中,充分反应后过滤,向滤液中加入10 mol/L的NaOH溶液, 产生沉淀的量与所加NaOH溶液的体积的关系如下图所示。则原矿石中Al2O3的质量是克
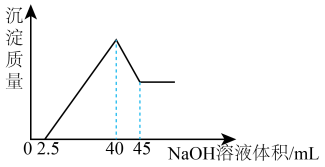

| A.5.1 | B.3.9 | C.2.55 | D.7.8 |
您最近一年使用:0次
2017-02-17更新
|
1977次组卷
|
4卷引用:黑龙江省齐齐哈尔市八校联合体2022-2023学年高三上学期期中考试化学试题
名校
10 . 分某化学兴趣小组在实验室模拟侯德榜制碱法制备纯碱。主要步骤如下:
第一步:配制饱和NaCl溶液,倒入烧杯中加热;
第一步:控制温度在30-35 ℃。边搅拌边分批加入研细的NH4HCO3固体,加料完毕后,继续保温30分钟;
第三步:静置、过滤得NaHCO3晶体.用少量蒸馏水洗涤除去杂质,然后抽干;
第四步:将第二步所得固体转入蒸发皿中,灼烧2小时,制得纯碱固体,
已知:温度高于35℃时,NH4HCO3会分解。有关盐的溶解度(g/100g水)如下表:
回答下列问题:
(1)反应温度控制在30-35℃范围内,应采取的加热方法为______ ,反应温度不能高于35℃的理由是______ .
(2)第三步静置后析出NaHCO3晶体的原因是___ ;用蒸馏水洗涤NaHCO3晶体的目的是除去杂质粒子_______ (用离子符号表示)。
(3)若向过滤所得母液中加入______ (填写试剂名称),并作进一步处理,使NaCl溶液循环使用,同时可回收NH4Cl。
(4)纯碱产品不纯,含有NaHCO3、NaCl等杂质。测定纯碱中NaHCO3含量的方法是:准确称取纯碱样品Wg,放入锥形瓶中加蒸馏水溶解,加l-2滴酚酞指示剂,用物质的量浓度为cmol/L的盐酸滴定至溶液由红色到无色(指示CO32-+H+=HCO3-反应的终点), 所用盐酸体积为V1mL,再加1-2滴甲基橙指示剂,继续用盐酸滴定至溶液由黄变橙,所用盐酸总体积为V2mL。
① 实验室配制一定体积cmol/L盐酸需用的仪器除了容量瓶、烧杯、量筒外还需____________ ;在容量瓶的使用方法中,下列操作正确的是_______ (填写标号)
a.使用容量瓶前检验它是否漏水
b.容量瓶用蒸馏水洗净后,再用待配溶液润洗
c.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中.然后加蒸馏水定容
d.用容量瓶把溶液配制完成以后.直接贴上标签,放置备用
e.定容后盖好瓶塞,用食指顶住瓶塞,用另一只手指托住瓶底,把容量瓶倒转和摇动几次
② 写出纯碱样品中NaHCO3质量分数的计算式:NaHCO3 (%)=________ 。
第一步:配制饱和NaCl溶液,倒入烧杯中加热;
第一步:控制温度在30-35 ℃。边搅拌边分批加入研细的NH4HCO3固体,加料完毕后,继续保温30分钟;
第三步:静置、过滤得NaHCO3晶体.用少量蒸馏水洗涤除去杂质,然后抽干;
第四步:将第二步所得固体转入蒸发皿中,灼烧2小时,制得纯碱固体,
已知:温度高于35℃时,NH4HCO3会分解。有关盐的溶解度(g/100g水)如下表:
| 盐 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | —— | —— | —— | —— |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.l | 12.7 | 14.5 | 16.4 | —— |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
(1)反应温度控制在30-35℃范围内,应采取的加热方法为
(2)第三步静置后析出NaHCO3晶体的原因是
(3)若向过滤所得母液中加入
(4)纯碱产品不纯,含有NaHCO3、NaCl等杂质。测定纯碱中NaHCO3含量的方法是:准确称取纯碱样品Wg,放入锥形瓶中加蒸馏水溶解,加l-2滴酚酞指示剂,用物质的量浓度为cmol/L的盐酸滴定至溶液由红色到无色(指示CO32-+H+=HCO3-反应的终点), 所用盐酸体积为V1mL,再加1-2滴甲基橙指示剂,继续用盐酸滴定至溶液由黄变橙,所用盐酸总体积为V2mL。
① 实验室配制一定体积cmol/L盐酸需用的仪器除了容量瓶、烧杯、量筒外还需
a.使用容量瓶前检验它是否漏水
b.容量瓶用蒸馏水洗净后,再用待配溶液润洗
c.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中.然后加蒸馏水定容
d.用容量瓶把溶液配制完成以后.直接贴上标签,放置备用
e.定容后盖好瓶塞,用食指顶住瓶塞,用另一只手指托住瓶底,把容量瓶倒转和摇动几次
② 写出纯碱样品中NaHCO3质量分数的计算式:NaHCO3 (%)=
您最近一年使用:0次
2016-12-09更新
|
172次组卷
|
5卷引用:黑龙江省齐齐哈尔市第八中学2018届高三上学期第一阶段测试化学试题



