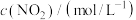1 . 金属钨是重要的战略资源,由黑钨矿(主要成分为 、
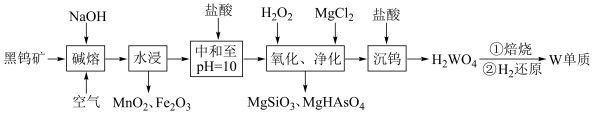
、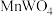 ,含有少量Si、As的化合物)制取金属钨的流程如图所示:
,含有少量Si、As的化合物)制取金属钨的流程如图所示:
已知:常温下钨酸(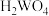 )难溶于水,酸性很弱,其钠盐易溶于水。
)难溶于水,酸性很弱,其钠盐易溶于水。
回答下列问题:
(1)已知元素周期表中74号元素钨与铬同族,钨在元素周期表中的位置是第六周期第________ 族。 中铁元素的化合价为
中铁元素的化合价为________ 。
(2)“碱熔”步骤中为提高反应速率,可以将黑钨矿预先________ ,“碱熔”过程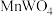 发生反应的化学方程式为
发生反应的化学方程式为________ 。
(3)上述流程中加盐酸中和至pH=10时,溶液中的杂质阴离子有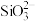 、
、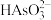 、
、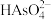 等,则“氧化、净化”过程中,先加入
等,则“氧化、净化”过程中,先加入 发生反应的离子方程式为
发生反应的离子方程式为________ 。
(4)沉钨过程中,判断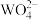 是否沉淀完全的方法是
是否沉淀完全的方法是________ 。
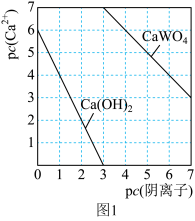
(5)钨酸钙( )和氢氧化钙都是微溶电解质。某温度下
)和氢氧化钙都是微溶电解质。某温度下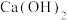 和
和 的饱和溶液中,
的饱和溶液中,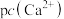 与pc(阴离子)的关系如图1所示,已知:pc(离子)=-lgc(离子)。该温度下将
与pc(阴离子)的关系如图1所示,已知:pc(离子)=-lgc(离子)。该温度下将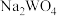 溶液加入石灰乳中得到大量钨酸钙,该反应的平衡常数K=
溶液加入石灰乳中得到大量钨酸钙,该反应的平衡常数K=________ 。
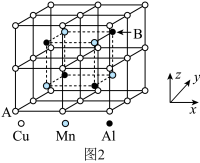
(6)合金具有比金属单质更优越的性能,Cu-Mn-Al合金为磁性形状记忆合金材料之一,其晶胞结构如图2所示。该合金的化学式为________ 。若A原子的坐标参数为(0,0,0),则B原子的坐标参数为________ 。
 、
、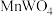 ,含有少量Si、As的化合物)制取金属钨的流程如图所示:
,含有少量Si、As的化合物)制取金属钨的流程如图所示:
已知:常温下钨酸(
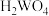 )难溶于水,酸性很弱,其钠盐易溶于水。
)难溶于水,酸性很弱,其钠盐易溶于水。回答下列问题:
(1)已知元素周期表中74号元素钨与铬同族,钨在元素周期表中的位置是第六周期第
 中铁元素的化合价为
中铁元素的化合价为(2)“碱熔”步骤中为提高反应速率,可以将黑钨矿预先
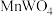 发生反应的化学方程式为
发生反应的化学方程式为(3)上述流程中加盐酸中和至pH=10时,溶液中的杂质阴离子有
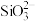 、
、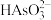 、
、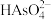 等,则“氧化、净化”过程中,先加入
等,则“氧化、净化”过程中,先加入 发生反应的离子方程式为
发生反应的离子方程式为(4)沉钨过程中,判断
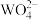 是否沉淀完全的方法是
是否沉淀完全的方法是(5)钨酸钙(
 )和氢氧化钙都是微溶电解质。某温度下
)和氢氧化钙都是微溶电解质。某温度下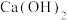 和
和 的饱和溶液中,
的饱和溶液中,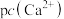 与pc(阴离子)的关系如图1所示,已知:pc(离子)=-lgc(离子)。该温度下将
与pc(阴离子)的关系如图1所示,已知:pc(离子)=-lgc(离子)。该温度下将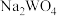 溶液加入石灰乳中得到大量钨酸钙,该反应的平衡常数K=
溶液加入石灰乳中得到大量钨酸钙,该反应的平衡常数K=
(6)合金具有比金属单质更优越的性能,Cu-Mn-Al合金为磁性形状记忆合金材料之一,其晶胞结构如图2所示。该合金的化学式为

您最近一年使用:0次
2 . CO在工农业生产及科学研究中有着重要应用。
(1)CO催化脱氮:在一定温度下,向2L的恒容密闭容器中充入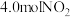 和4.0molCO,在催化制作用下发生反应:
和4.0molCO,在催化制作用下发生反应:
 ,测得相关数据如下:
,测得相关数据如下:
①其他条件不变,若不使用催化剂,则0~5min内 的转化率将
的转化率将________ 。(填“变大”、“变小”或“不变”)
②下列表述能说明该反应已达到平衡状态的是________ 。(填序号)
A.CO的消耗反应速率为 消耗反应速率的4倍
消耗反应速率的4倍
B.气体的颜色不再变化
C.化学平衡常数K不再变化
D.混合气体的密度不再变化
③有利于提高该反应中 平衡转化率的条件是
平衡转化率的条件是________ 。(填序号)
A.高温低压 B.低温高压 C.高温高压 D.低温低压
(2)CO与Ni发生羰化反应形成的络合物可作为催化烯烃反应的催化剂,Ni的羰化反应为: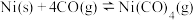
 。
。 温度下,将足量的Ni粉和3.7molCO加入到刚性密闭容器中,10min时反应达到平衡,测得体系的压强为原来的
温度下,将足量的Ni粉和3.7molCO加入到刚性密闭容器中,10min时反应达到平衡,测得体系的压强为原来的 。则:
。则:
①0~10min内平均反应速率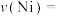
________ g/min。
②研究表明,正反应速率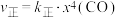 ,逆反应速率
,逆反应速率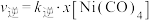 (
( 和
和 分别表示正反应和逆反应的速率常数,x为物质的量分数),计算
分别表示正反应和逆反应的速率常数,x为物质的量分数),计算 温度下的
温度下的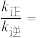
________ 。
(3)已知:
Ⅰ.
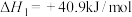
Ⅱ.

由 合成
合成 的热化学方程式为
的热化学方程式为________ 。
如果在不同压强下, 和
和 的起始物质的量比仍为1:3,测定
的起始物质的量比仍为1:3,测定 的平衡转化率和
的平衡转化率和 的平衡产率随温度升高的变化关系,如图所示:
的平衡产率随温度升高的变化关系,如图所示: 的平衡转化率
的平衡转化率 ,
,
 的平衡产率
的平衡产率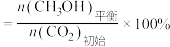 。
。
①压强
________  (填“>”或“<”),原因
(填“>”或“<”),原因________ 。
②其中图中纵坐标表示 平衡转化率的是图
平衡转化率的是图________ (填“甲”或“乙”)。
③图乙中 温度时,两条曲线几乎交于一点,分析原因
温度时,两条曲线几乎交于一点,分析原因________ 。
(1)CO催化脱氮:在一定温度下,向2L的恒容密闭容器中充入
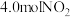 和4.0molCO,在催化制作用下发生反应:
和4.0molCO,在催化制作用下发生反应:
 ,测得相关数据如下:
,测得相关数据如下:时间/min | 0 | 5 | 10 | 15 | 20 |
| 2.0 | 1.7 | 1.56 | 1.5 | 1.5 |
| 0 | 0.15 | 0.22 | 0.25 | 0.25 |
 的转化率将
的转化率将②下列表述能说明该反应已达到平衡状态的是
A.CO的消耗反应速率为
 消耗反应速率的4倍
消耗反应速率的4倍B.气体的颜色不再变化
C.化学平衡常数K不再变化
D.混合气体的密度不再变化
③有利于提高该反应中
 平衡转化率的条件是
平衡转化率的条件是A.高温低压 B.低温高压 C.高温高压 D.低温低压
(2)CO与Ni发生羰化反应形成的络合物可作为催化烯烃反应的催化剂,Ni的羰化反应为:
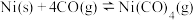
 。
。 温度下,将足量的Ni粉和3.7molCO加入到刚性密闭容器中,10min时反应达到平衡,测得体系的压强为原来的
温度下,将足量的Ni粉和3.7molCO加入到刚性密闭容器中,10min时反应达到平衡,测得体系的压强为原来的 。则:
。则:①0~10min内平均反应速率
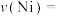
②研究表明,正反应速率
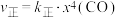 ,逆反应速率
,逆反应速率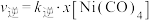 (
( 和
和 分别表示正反应和逆反应的速率常数,x为物质的量分数),计算
分别表示正反应和逆反应的速率常数,x为物质的量分数),计算 温度下的
温度下的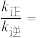
(3)已知:
Ⅰ.

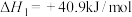
Ⅱ.


由
 合成
合成 的热化学方程式为
的热化学方程式为如果在不同压强下,
 和
和 的起始物质的量比仍为1:3,测定
的起始物质的量比仍为1:3,测定 的平衡转化率和
的平衡转化率和 的平衡产率随温度升高的变化关系,如图所示:
的平衡产率随温度升高的变化关系,如图所示: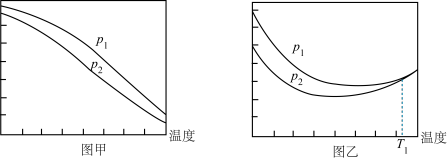
 的平衡转化率
的平衡转化率 ,
, 的平衡产率
的平衡产率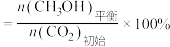 。
。①压强

 (填“>”或“<”),原因
(填“>”或“<”),原因②其中图中纵坐标表示
 平衡转化率的是图
平衡转化率的是图③图乙中
 温度时,两条曲线几乎交于一点,分析原因
温度时,两条曲线几乎交于一点,分析原因
您最近一年使用:0次
名校
解题方法
3 . 计算
(1)将200mL3mol/L的Al2(SO4)3溶液稀释至500mL,求稀释后硫酸根的浓度为多少______ ?
(2)将K2SO4和Al2(SO4)3和KAl(SO4)2三种混合溶液加H2SO4酸化。测得c(SO )=1.05 mol/L, c(Al3+)=0.55 mol/L,c(H+)=0.10mol/L(假设H2SO4完全电离为H+和SO
)=1.05 mol/L, c(Al3+)=0.55 mol/L,c(H+)=0.10mol/L(假设H2SO4完全电离为H+和SO ),则c(K+)为多少
),则c(K+)为多少 ______ ?
(3)Fe、Al混合物共0.2mol,用盐酸将其完全溶解,放出标准状况下5.6L气体,然后再滴入4mol/L的NaOH溶液,请计算:
①求该混合物中Fe、Al的物质的量______ ?
②若该Fe、Al的混合物与盐酸恰好完全反应,在滴加NaOH溶液过程中,欲使Fe2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积为多少______ mL?
(4)将一定质量的Mg和Al混合物投入500mL稀硫酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示计算:
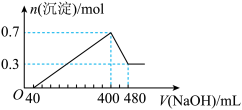
①酸的物质的量浓度为多少______ ?
②若将上述混合物中等物质的量的Mg和Al分别与稀硫酸充分反应,产生的气体通入相同条件下恒容的甲乙两密闭容器中,求甲乙两容器内的压强比为多少______ ?
(1)将200mL3mol/L的Al2(SO4)3溶液稀释至500mL,求稀释后硫酸根的浓度为多少
(2)将K2SO4和Al2(SO4)3和KAl(SO4)2三种混合溶液加H2SO4酸化。测得c(SO
 )=1.05 mol/L, c(Al3+)=0.55 mol/L,c(H+)=0.10mol/L(假设H2SO4完全电离为H+和SO
)=1.05 mol/L, c(Al3+)=0.55 mol/L,c(H+)=0.10mol/L(假设H2SO4完全电离为H+和SO ),则c(K+)为多少
),则c(K+)为多少 (3)Fe、Al混合物共0.2mol,用盐酸将其完全溶解,放出标准状况下5.6L气体,然后再滴入4mol/L的NaOH溶液,请计算:
①求该混合物中Fe、Al的物质的量
②若该Fe、Al的混合物与盐酸恰好完全反应,在滴加NaOH溶液过程中,欲使Fe2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积为多少
(4)将一定质量的Mg和Al混合物投入500mL稀硫酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示计算:

①酸的物质的量浓度为多少
②若将上述混合物中等物质的量的Mg和Al分别与稀硫酸充分反应,产生的气体通入相同条件下恒容的甲乙两密闭容器中,求甲乙两容器内的压强比为多少
您最近一年使用:0次
名校
解题方法
4 . 已知:将Cl2通入适量NaOH溶液中,反应会放热,当温度升高后会发生如下反应:3Cl2+6NaOH=5NaCl+NaClO3+3H2O。则Cl2通入NaOH溶液的产物中可能有NaCl、NaClO、NaClO3中的两种或三种,且 的值与温度高低有关。当参与反应的n(NaOH)= a mol时,下列说法错误的是
的值与温度高低有关。当参与反应的n(NaOH)= a mol时,下列说法错误的是
 的值与温度高低有关。当参与反应的n(NaOH)= a mol时,下列说法错误的是
的值与温度高低有关。当参与反应的n(NaOH)= a mol时,下列说法错误的是| A.与碱的反应中,Cl2既是氧化剂又是还原剂 |
| B.参加反应的Cl2物质的量为0.5a mol |
C.若某温度下,反应后 =6,则溶液中 =6,则溶液中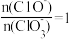 |
D.改变温度,反应中转移电子的物质的量可能为 mol mol |
您最近一年使用:0次
2022-10-24更新
|
2103次组卷
|
12卷引用:新疆塔城地区第一高级中学2022-2023学年高一下学期开学考试化学试题
新疆塔城地区第一高级中学2022-2023学年高一下学期开学考试化学试题江苏省无锡市锡山高级中学2021-2022学年高一上学期期中考试化学试题山东省实验中学2022-2023学年高一上学期11月期中考试化学试题甘肃省酒泉市玉门油田第一中学2022-2023学年高一上学期期中考试化学(A卷)试题北京市第八中学2022-2023学年高一上学期12月月考化学试题陕西省榆林中学2022-2023学年高一上学期期末考试化学试题浙江省宁波市北仑中学2022-2023学年高一下学期期初返校考试(选考)化学试题江苏省苏州中学2022-2023学年高一下学期开学考试化学试题陕西省安康市2022-2023学年高一下学期开学摸底考试化学试题辽宁省沈阳市五校协作体2022-2023学年高一上学期期末考试化学试题 山东省淄博市部分学校联考2022-2023学年高一下学期4月期中考试化学试题(已下线)专题03 氧化还原反应-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(人教版2019必修第一册)
名校
解题方法
5 . 乙烯是制造塑料、合成橡胶和合成纤维等化学产品的基本原料。C2H6裂解制C2H4是化学工业的一个重要研究课题,目前裂解方法有电催化、光催化裂解、直接裂解、氧气或二氧化碳氧化乙烷裂解等。乙烷直接裂解、乙烷二氧化碳氧化裂解和乙烷氧气氧化裂解的反应如下:
(Ⅰ)C2H6(g) C2H4(g)+H2(g) △H1=+125kJ·mol-1
C2H4(g)+H2(g) △H1=+125kJ·mol-1
(Ⅱ)CO2(g)+C2H6(g) C2H4(g)+CO(g)+H2O(g) △H2=+177kJ·mol-1
C2H4(g)+CO(g)+H2O(g) △H2=+177kJ·mol-1
(Ⅲ)2C2H6(g)+O2(g) 2C2H4(g)+2H2O(g) △H3=-211.6kJ·mol-1
2C2H4(g)+2H2O(g) △H3=-211.6kJ·mol-1
回答下列问题:
(1)已知键能:E(C—H)=416kJ·mol-1,E(H—H)=436kJ·mol-1,由此计算生成1mol碳碳π键放出的能量为_______ kJ。
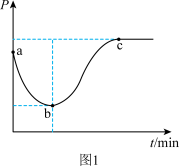
(2)在一绝热的恒容密闭容器中,通入一定量的C2H6发生反应(Ⅰ),反应过程中容器内压强(P)与时间(t)变化如图1所示,随着反应进行,a~b段压强减小的原因是_______ 。
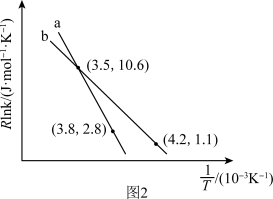
(3)反应(Ⅱ)的Arrhenius经验公式实验数据如图2中曲线a所示,已知Arrhenius经验公式Rlnk=-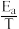 +C(Ea为活化能,k为速率常数,R和C为常数)。反应的活化能Ea=
+C(Ea为活化能,k为速率常数,R和C为常数)。反应的活化能Ea=_______ kJ·mol-1。当改变外界条件时,实验数据如图中曲线b所示,则实验可能改变的外界条件是_______ 。
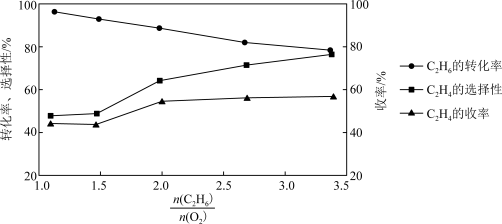
(4)乙烷氧气氧化裂解制乙烯,除发生反应(Ⅲ)之外,还发生副反应(Ⅳ):2C2H6(g)+7O2(g) 4CO2(g)+6H2O(g)。在800℃时用乙烷氧气氧化裂解制乙烯,乙烷的转化率、乙烯的选择性和收率随投料比
4CO2(g)+6H2O(g)。在800℃时用乙烷氧气氧化裂解制乙烯,乙烷的转化率、乙烯的选择性和收率随投料比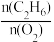 的变化关系如图所示:
的变化关系如图所示:
已知:C2H4的选择性=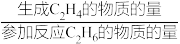 ×100%
×100%
C2H4的收率=C2H6的转化率×C2H4的选择性
①控制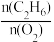 =2而不采用选择性更高的
=2而不采用选择性更高的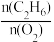 =3.5,除可防止积碳外,另一原因是
=3.5,除可防止积碳外,另一原因是_______ ;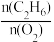 <2时,
<2时,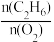 越小,乙烷的转化率越大,乙烯的选择性和收率越小的原因是
越小,乙烷的转化率越大,乙烯的选择性和收率越小的原因是_______ 。
②一定温度和压强为5.8pMPa条件下,将C2H6和O2按物质的量之比为2∶3通入密闭弹性容器中发生反应,平衡时,C2H4选择性为60%,C2H4的收率为48%。该温度下,反应2C2H6(g)+O2(g) 2C2H4(g)+2H2O(g)的Kp=
2C2H4(g)+2H2O(g)的Kp=_______ (用含字母p的代数式表示,带单位。已知Kp是用反应体系中气体的分压来表示的平衡常数,分压=总压×物质的量分数)。
(Ⅰ)C2H6(g)
 C2H4(g)+H2(g) △H1=+125kJ·mol-1
C2H4(g)+H2(g) △H1=+125kJ·mol-1(Ⅱ)CO2(g)+C2H6(g)
 C2H4(g)+CO(g)+H2O(g) △H2=+177kJ·mol-1
C2H4(g)+CO(g)+H2O(g) △H2=+177kJ·mol-1(Ⅲ)2C2H6(g)+O2(g)
 2C2H4(g)+2H2O(g) △H3=-211.6kJ·mol-1
2C2H4(g)+2H2O(g) △H3=-211.6kJ·mol-1回答下列问题:
(1)已知键能:E(C—H)=416kJ·mol-1,E(H—H)=436kJ·mol-1,由此计算生成1mol碳碳π键放出的能量为
(2)在一绝热的恒容密闭容器中,通入一定量的C2H6发生反应(Ⅰ),反应过程中容器内压强(P)与时间(t)变化如图1所示,随着反应进行,a~b段压强减小的原因是

(3)反应(Ⅱ)的Arrhenius经验公式实验数据如图2中曲线a所示,已知Arrhenius经验公式Rlnk=-
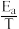 +C(Ea为活化能,k为速率常数,R和C为常数)。反应的活化能Ea=
+C(Ea为活化能,k为速率常数,R和C为常数)。反应的活化能Ea=
(4)乙烷氧气氧化裂解制乙烯,除发生反应(Ⅲ)之外,还发生副反应(Ⅳ):2C2H6(g)+7O2(g)
 4CO2(g)+6H2O(g)。在800℃时用乙烷氧气氧化裂解制乙烯,乙烷的转化率、乙烯的选择性和收率随投料比
4CO2(g)+6H2O(g)。在800℃时用乙烷氧气氧化裂解制乙烯,乙烷的转化率、乙烯的选择性和收率随投料比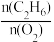 的变化关系如图所示:
的变化关系如图所示:
已知:C2H4的选择性=
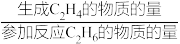 ×100%
×100%C2H4的收率=C2H6的转化率×C2H4的选择性
①控制
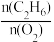 =2而不采用选择性更高的
=2而不采用选择性更高的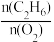 =3.5,除可防止积碳外,另一原因是
=3.5,除可防止积碳外,另一原因是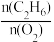 <2时,
<2时,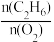 越小,乙烷的转化率越大,乙烯的选择性和收率越小的原因是
越小,乙烷的转化率越大,乙烯的选择性和收率越小的原因是②一定温度和压强为5.8pMPa条件下,将C2H6和O2按物质的量之比为2∶3通入密闭弹性容器中发生反应,平衡时,C2H4选择性为60%,C2H4的收率为48%。该温度下,反应2C2H6(g)+O2(g)
 2C2H4(g)+2H2O(g)的Kp=
2C2H4(g)+2H2O(g)的Kp=
您最近一年使用:0次
2022-04-14更新
|
1390次组卷
|
3卷引用:新疆塔城地区第二中学2022-2023学年高二上学期11月月考化学试题
名校
6 . 一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入反应物,发生反应2SO2(g)+ O2(g) 2SO3(g)△H = -196.0 kJ.mol-1,测得反应的相关数据如下,下列说法正确的是( )
2SO3(g)△H = -196.0 kJ.mol-1,测得反应的相关数据如下,下列说法正确的是( )
 2SO3(g)△H = -196.0 kJ.mol-1,测得反应的相关数据如下,下列说法正确的是( )
2SO3(g)△H = -196.0 kJ.mol-1,测得反应的相关数据如下,下列说法正确的是( )容器1 | 容器2 | 容器3 | |
| 应温度T/K | 700 | 700 | 800 |
| 反应物投入量 | 2 mol SO2、1mol O2 | 4mol SO3 | 2 mol SO3 |
| 平衡v正(SO2)/mol•L-1•S-1 | v1 | v2 | v3 |
| 平衡c(SO3)/mol•L-1 | c1 | c2 | c3 |
| 平衡体系总压强p/Pa | p1 | p2 | p3 |
| 反应能量变化 | 放出a KJ | 吸收b KJ | 吸收c KJ |
| 物质的平衡转化率α | α1(SO2) | α2(SO3) | α3(SO2) |
| 平衡常数K | K1 | K2 | K3 |
| A. v1< v2,c2<2c1 | B. K1> K3,p2>2p3 |
| C.v1< v3,α1(SO2 ) <α2(SO2 ) | D. c2>2c3,α2(SO3 )+α3(SO2 )<1 |
您最近一年使用:0次
2019-11-14更新
|
1907次组卷
|
12卷引用:新疆塔城地区第二中学2022-2023学年高二上学期11月月考化学试题
新疆塔城地区第二中学2022-2023学年高二上学期11月月考化学试题【全国百强校】黑龙江省大庆实验中学2018-2019学年高二上学期10月月考化学试题【全国百强校】山西省山西大学附属中学2018-2019学年高二上学期10月模块诊断化学试题【全国百强校】山东省泰安市第一中学2018-2019学年高二上学期期中考试化学试题【校级联考】福建省晋江市(安溪一中、养正中学、惠安一中、泉州实验中学四校)2018-2019学年高二上学期期中考试化学试题福建省福清市华侨中学2018-2019学年高二下学期期中考试化学试题江苏省宿迁市沭阳县修远中学2018-2019学年高二下学期第二次月考化学试题黑龙江省大庆实验中学2019-2020学年高二上学期第一次月考化学试题河南省南阳市南阳一中2019-2020学年高二上期第三次月考化学试题步步为赢 高二化学寒假作业:综合检测(一)2019年秋高三化学复习强化练习—— 等效平衡山东省泰安第二中学2021-2022学年高二上学期期中考试化学试题