名校
解题方法
1 . 已知下列元素基态原子的最外层电子排布式,其中不一定能表示该元素为主族元素的是
A.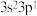 | B. | C. | D. |
您最近一年使用:0次
2022-11-27更新
|
381次组卷
|
4卷引用:山东省青岛一中2023-2024学年高一下学期4月月考化学试卷
21-22高一·全国·假期作业
解题方法
2 . 请你解释下列现象。
(1)医用药品常在低温、干燥环境下密封保存_______ 。
(2)向一堆等火“鼓风”,可以使火势变强_______ 。
(3)微量的二氧化锰粉末可以使过氧化氢快速分解,而二氧化锰的质量在反应前后并没有发生改变_______ 。
(1)医用药品常在低温、干燥环境下密封保存
(2)向一堆等火“鼓风”,可以使火势变强
(3)微量的二氧化锰粉末可以使过氧化氢快速分解,而二氧化锰的质量在反应前后并没有发生改变
您最近一年使用:0次
解题方法
3 . 动手实践。
某同学探究同周期元素性质递变规律时,自己设计了一套实验方案,进行实验并记录了有关实验现象。
请帮助该同学整理并完成实验报告。
(1)实验目的:____________ 。
(2)实验用品:
金属钠,镁条,铝条,稀盐酸,新制氯水,新制 溶液,
溶液, 溶液,NaOH溶液,酚酞溶液等;
溶液,NaOH溶液,酚酞溶液等;___________ ,____________ ,____________ ,酒精灯,试管夹,镊子,小刀,玻璃片,砂纸等。
(3)实验内容:(填写与实验步骤标号对应的实验现象的序号并写出相应反应的化学方程式)
(4)实验结论:_____________ 。
(5)请用原子结构的知识简单解释上述结论_________ 。
(6)为探索同周期元素性质的递变规律,你还能提出其他的可行性方案吗_________ ?
某同学探究同周期元素性质递变规律时,自己设计了一套实验方案,进行实验并记录了有关实验现象。
实验步骤 | 实验现象 |
| ①将镁条用砂纸打磨后,放入沸水中,再向溶液中滴加少量酚酞溶液 | A.浮在水面上,熔成小球,做不定向运动,随后消失,溶液变成红色 |
②向新制得的 溶液中滴加新制的氯水 溶液中滴加新制的氯水 | B.有气体产生,溶液变成浅红色 |
| ③将一小块金属钠放入滴有酚酞溶液的冷水中 | C.剧烈反应,迅速产生大量无色气体 |
| ④将镁条放入稀盐酸中 | D.反应较快,产生无色气体 |
| ⑤将铝条放入稀盐酸中 | E.生成白色胶状沉淀,继而沉淀消失 |
⑥向 溶液中滴加NaOH溶液至过量 溶液中滴加NaOH溶液至过量 | F.生成淡黄色沉淀 |
(1)实验目的:
(2)实验用品:
金属钠,镁条,铝条,稀盐酸,新制氯水,新制
 溶液,
溶液, 溶液,NaOH溶液,酚酞溶液等;
溶液,NaOH溶液,酚酞溶液等;(3)实验内容:(填写与实验步骤标号对应的实验现象的序号并写出相应反应的化学方程式)
实验步骤 | 实验现象 | 化学方程式 |
① | ||
② | ||
③ | ||
④ | ||
⑤ | ||
⑥ |
(5)请用原子结构的知识简单解释上述结论
(6)为探索同周期元素性质的递变规律,你还能提出其他的可行性方案吗
您最近一年使用:0次
解题方法
4 . 部分元素的性质与原子(或分子)结构如下表:
(1)请画出T元素的原子结构示意图:___________ 。
(2)Y元素与Z元素相比,金属性较强的是_________ (用元素符号表示)。下列表述中,能证明这一事实的是__________ (填序号)。
A.Y元素的单质的熔点比Z元素的单质的低
B.Y元素的最高正化合价比Z元素的低
C.Y元素的单质与水反应比Z元素的单质与水反应剧烈
D.Y元素的最高价氧化物对应的水化物的碱性比Z元素的强
元素 | 编号元素性质与原子(或分子)结构 |
T | 最外层电子数是次外层电子数的3倍 |
X | 常温下单质由双原子分子构成,1个分子中有14个电子 |
Y | M层比K层少1个电子 |
Z | 是第3周期元素的简单离子中半径最小的 |
(2)Y元素与Z元素相比,金属性较强的是
A.Y元素的单质的熔点比Z元素的单质的低
B.Y元素的最高正化合价比Z元素的低
C.Y元素的单质与水反应比Z元素的单质与水反应剧烈
D.Y元素的最高价氧化物对应的水化物的碱性比Z元素的强
您最近一年使用:0次
5 . 某一元素具有如下性质,请你推测该元素在元素周期表中的位置。
(1)其最高价氧化物既可以溶于浓盐酸,也可以溶于NaOH溶液。
(2)其最高价氧化物对应的水化物既可以与酸反应,也可以与碱反应。
(3)1mol该元素最高价氧化物对应的水化物在与盐酸反应时,最多能消耗4molHCl。_____
(1)其最高价氧化物既可以溶于浓盐酸,也可以溶于NaOH溶液。
(2)其最高价氧化物对应的水化物既可以与酸反应,也可以与碱反应。
(3)1mol该元素最高价氧化物对应的水化物在与盐酸反应时,最多能消耗4molHCl。
您最近一年使用:0次
解题方法
6 . 已知A、B、C、D、E是短周期中的五种非金属元素,它们的原子序数依次增大。A元素的原子形成的离子核外电子数为0,B元素的原子的最外层电子数是内层电子数的2倍,C、D元素在元素周期表中处于相邻的位置,E元素与D元素处于同一主族,E元素的单质为黄色晶体。
(1)请写出元素符号:A__________ ,B__________ ,C__________ ,D__________ ,E__________ 。
(2)请画出E元素的阴离子的结构示意图:____________ 。
(3)A元素的单质和C元素的单质能在一定条件下反应生成化合物X,该反应的化学方程式为__________ 。向X的水溶液中滴入酚酞溶液,会观察到________ 。
(1)请写出元素符号:A
(2)请画出E元素的阴离子的结构示意图:
(3)A元素的单质和C元素的单质能在一定条件下反应生成化合物X,该反应的化学方程式为
您最近一年使用:0次
2022-11-26更新
|
210次组卷
|
2卷引用:2019版鲁科化学必修第二册第1章本章自我评价课后习题
7 . 一位同学设计了一套用浓盐酸和高锰酸钾固体制取少量氯气并能比较氯气与碘单质氧化性强弱的微型装置,如图所示。
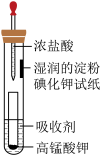
(1)下列溶液中,能吸收氯气的是______。
(2)能说明氯气的氧化性强于碘单质的实验现象是__________ 。
(3)请用原子结构的知识解释氯气的氧化性强于碘单质的原因:__________ 。

(1)下列溶液中,能吸收氯气的是______。
| A.饱和食盐水 | B.饱和Na2SO3溶液 |
| C.饱和NaOH溶液 | D.浓硫酸 |
(3)请用原子结构的知识解释氯气的氧化性强于碘单质的原因:
您最近一年使用:0次
2022-11-26更新
|
523次组卷
|
2卷引用:2019版鲁科化学必修第二册第1章本章自我评价课后习题
8 . 请根据元素周期律、元素周期表的知识解决下列问题。
(1)写出以下元素的元素符号。其单质氧化性最强的元素:______ ,短周期中其单质还原性最强的元素:________ 。
(2)从原子结构的角度说明Cl的得电子能力比S强的原因:___________ 。
(3)已知33As、35Br位于同一周期,请完成下列排序。
①As3-、Br-的还原性:_______ >_______ 。
②H3AsO4、H2SO4、H3PO4的酸性:_______ >_______ >________ 。
(1)写出以下元素的元素符号。其单质氧化性最强的元素:
(2)从原子结构的角度说明Cl的得电子能力比S强的原因:
(3)已知33As、35Br位于同一周期,请完成下列排序。
①As3-、Br-的还原性:
②H3AsO4、H2SO4、H3PO4的酸性:
您最近一年使用:0次
解题方法
9 . 元素周期律和元素周期表对深入认识物质的性质具有重要的作用,有利于将零散的元素及其化合物的知识整合起来形成知识网络。通过本章的学习,你是否对学习过的元素及其化合物的知识进行了整合?请尝试用图示的方式进行总结,并与同学们交流分享,示例如下:
李明打开元素周期表,看到元素符号“N”,便按照以下思路回顾和整理了关于氮元素的相关知识。
(1)氮元素的原子结构示意图_____ 、元素符号_____ 。
(2)氮元素所在周期的元素性质递变规律_____ 。
(3)氮元素所在主族的元素性质递变规律_____ 。
(4)含有氮元素的常见物质的性质及它们之间的转化关系_____ 。
李明打开元素周期表,看到元素符号“N”,便按照以下思路回顾和整理了关于氮元素的相关知识。
(1)氮元素的原子结构示意图
(2)氮元素所在周期的元素性质递变规律
(3)氮元素所在主族的元素性质递变规律
(4)含有氮元素的常见物质的性质及它们之间的转化关系
您最近一年使用:0次
10 . 请回答下列问题。
(1)下列叙述中,正确的是_______
(2)请利用原子结构知识对下列结论进行说明和论证。
结论1:同周期的主族元素,从左到右,元素原子失电子能力越来越弱。______ 。
结论2:碱金属元素,从上到下,元素原子失电子能力越来越强。______ 。
(1)下列叙述中,正确的是_______
| A.同周期元素中,ⅦA族元素的原子半径最大 |
| B.ⅥA族元素的原子,其原子半径越大,越容易得到电子 |
| C.常温时,0族元素的单质都是气体 |
| D.在元素周期表中,从ⅢB族到ⅡB族10个纵列的元素都是金属元素 |
结论1:同周期的主族元素,从左到右,元素原子失电子能力越来越弱。
结论2:碱金属元素,从上到下,元素原子失电子能力越来越强。
您最近一年使用:0次



