1 . 有关少量食用油在低温下出现冻结现象后能否食用及解释合理的是
| A.不能,因为已经变质 |
| B.不能,因为含有杂质 |
| C.不能,因为含有水分 |
| D.能,因为那只是油脂主要成份在低温下结晶析出,是正常物理形态变化,并未变质 |
您最近一年使用:0次
2016-12-09更新
|
935次组卷
|
3卷引用:2012年人教版高中化学选修1 1.2重要的体内能源-油脂练习卷
(已下线)2012年人教版高中化学选修1 1.2重要的体内能源-油脂练习卷【市级联考】吉林省吉林市2018-2019学年高二上学期第一次月考化学(文)试题2020届高三化学二轮冲刺新题专练——有机化学选择专练
名校
解题方法
2 . 将AlCl3溶液和Al(NO3)3溶液分别加热蒸干,并灼烧,所得产物的主要成份是:
| A.均为Al(OH)3 | B.前者得Al2O3,后者得Al(NO3)3 |
| C.均为Al2O3 | D.前者得AlCl3,后者得Al(NO3)3 |
您最近一年使用:0次
3 . 某化学小组欲测定一份长期放置的补铁药品(有效成分是琥珀酸亚铁,化学式为FeC4H4O4)是否已变质,实验如下:
Ⅰ.取补铁药样品10.00g,碾碎,溶于100.0mL稀盐酸中,过滤,滤液呈浅黄绿色;
Ⅱ.取少量滤液,滴加KSCN溶液,溶液变为浅红色,再滴入3滴H2O2溶液,溶液红色加深;
Ⅲ.准确量取I中滤液20.00mL,加入足量H2O2溶液,再加入足量NaOH溶液,过滤、洗涤、常温晾干,获得Fe(OH)3固体0.642g;
Ⅳ.再准确量取I中滤液20.00mL于大试管中,加入1.00g铜粉,用胶塞塞紧试管口,充分振荡后过滤,最后得到干燥的铜粉0.936g。
(1)I中琥珀酸亚铁与稀盐酸反应生成FeCl2和琥珀酸(分子式为C4H6O4),说明酸性:C4H6O4_______ HCl(填“>”或“<”)。
(2)用离子方程式解释II中实验现象产生的原因:_______ 、Fe3++3SCN-=Fe(SCN)3。
(3)IV中发生反应的离子方程式为_______ 。
(4)该补铁药中琥珀酸亚铁变质程度为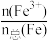 ×100%=
×100%=_______ (保留3位有效数字)。
(5)IV中溶液与铜粉反应时必须使用胶塞塞紧试管口,原因是_______ 。
Ⅰ.取补铁药样品10.00g,碾碎,溶于100.0mL稀盐酸中,过滤,滤液呈浅黄绿色;
Ⅱ.取少量滤液,滴加KSCN溶液,溶液变为浅红色,再滴入3滴H2O2溶液,溶液红色加深;
Ⅲ.准确量取I中滤液20.00mL,加入足量H2O2溶液,再加入足量NaOH溶液,过滤、洗涤、常温晾干,获得Fe(OH)3固体0.642g;
Ⅳ.再准确量取I中滤液20.00mL于大试管中,加入1.00g铜粉,用胶塞塞紧试管口,充分振荡后过滤,最后得到干燥的铜粉0.936g。
(1)I中琥珀酸亚铁与稀盐酸反应生成FeCl2和琥珀酸(分子式为C4H6O4),说明酸性:C4H6O4
(2)用离子方程式解释II中实验现象产生的原因:
(3)IV中发生反应的离子方程式为
(4)该补铁药中琥珀酸亚铁变质程度为
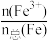 ×100%=
×100%=(5)IV中溶液与铜粉反应时必须使用胶塞塞紧试管口,原因是
您最近一年使用:0次
2023-08-26更新
|
169次组卷
|
5卷引用:作业(十九) 铁及其化合物之间的转化关系
4 . 过氧化钙(CaO2)广泛应用于水产养殖、污水处理,是优良的供氧剂。
实验探究一:过氧化钙与水反应除生成氧气外,还生成什么物质?
(1)进行实验:取适量过氧化钙放入试管中加适量水,向试管中滴加酚酞溶液,液体变成红色,说明生成了Ca(OH)2,写出该反应的化学方程式:______________ 。
(2)此供氧剂长期暴露在空气中,会变质生成CaCO3,为检验此供氧剂是否变质,可向其中加入稀盐酸,若观察到有气泡生成,则判断此供氧剂已变质。有同学不认同上述方案的理由是_______________________ 。
实验探究二:测定久置过氧化钙纯度。
方案一:通过测定产生氧气的体积,最终计算出供氧剂中过氧化钙的含量。
(3)取一定质量的供氧剂溶于水,按照图1装置进行装配。读出体积时要注意:①该反应为放热反应,待气体恢复至室温再读数;②____________________________ ;③视线和凹液面最低处保持水平再读数。
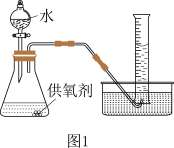
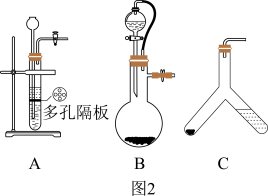
(4)用此装置测得的含量会偏大,原因是________________ ,为了避免此误差可将发生装置换成图2中的装置B或C。
方案二:把样品中的过氧化钙转化为碳酸钙,通过测定碳酸钙沉淀的质量,根据钙元素守恒,求得过氧化钙的质量,具体流程如图3。
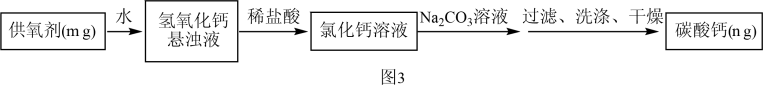
(5)滴加的Na2CO3溶液要过量的原因是_________________________ 。
实验探究一:过氧化钙与水反应除生成氧气外,还生成什么物质?
(1)进行实验:取适量过氧化钙放入试管中加适量水,向试管中滴加酚酞溶液,液体变成红色,说明生成了Ca(OH)2,写出该反应的化学方程式:
(2)此供氧剂长期暴露在空气中,会变质生成CaCO3,为检验此供氧剂是否变质,可向其中加入稀盐酸,若观察到有气泡生成,则判断此供氧剂已变质。有同学不认同上述方案的理由是
实验探究二:测定久置过氧化钙纯度。
方案一:通过测定产生氧气的体积,最终计算出供氧剂中过氧化钙的含量。
(3)取一定质量的供氧剂溶于水,按照图1装置进行装配。读出体积时要注意:①该反应为放热反应,待气体恢复至室温再读数;②

(4)用此装置测得的含量会偏大,原因是

方案二:把样品中的过氧化钙转化为碳酸钙,通过测定碳酸钙沉淀的质量,根据钙元素守恒,求得过氧化钙的质量,具体流程如图3。

(5)滴加的Na2CO3溶液要过量的原因是
您最近一年使用:0次
5 . 实验室有一瓶密封不严的漂白粉样品,其中肯定含有 ,请设计实验探究该样品中可能存在的其他物质[已知
,请设计实验探究该样品中可能存在的其他物质[已知 可使品红溶液褪色]。
可使品红溶液褪色]。
(1)提出合理假设。
假设①:该漂白粉未变质,含有___________ ;
假设②:该漂白粉全部变质,含有___________ ;
假设③:该漂白粉部分变质,既含有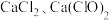 ,又含有
,又含有 。
。
(2)设计实验方案,进行实验。
 ,请设计实验探究该样品中可能存在的其他物质[已知
,请设计实验探究该样品中可能存在的其他物质[已知 可使品红溶液褪色]。
可使品红溶液褪色]。(1)提出合理假设。
假设①:该漂白粉未变质,含有
假设②:该漂白粉全部变质,含有
假设③:该漂白粉部分变质,既含有
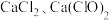 ,又含有
,又含有 。
。(2)设计实验方案,进行实验。
| 实验步骤 | 预期现象和结论 |
| 实验①:取少量上述漂白粉样品于试管中,加入适量稀盐酸,观察是否有气泡产生 | a.若无气泡产生,则假设 b. |
| 实验②:向实验①反应后的试管中滴人1~2滴品红溶液,振荡 | c.若品红溶液褪色,结合实验①中的b判断,则假设 d.若品红溶液不褪色,结合b判断,则假设 |
您最近一年使用:0次
名校
解题方法
6 . 下列实验操作能达到实验目的的是
| 选项 | 操作 | 目的 |
| A | 取一张pH试纸放在表面皿上,用洁净的玻璃棒蘸取NaClO溶液滴于试纸的中部,与标准比色卡对比 | 测定NaClO溶液的pH |
| B | 向含有酚酞的 溶液中滴入 溶液中滴入 溶液,观察溶液颜色的变化 溶液,观察溶液颜色的变化 | 证明 溶液中存在水解平衡 溶液中存在水解平衡 |
| C | 取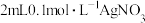 溶液,先后滴加3滴 溶液,先后滴加3滴 溶液和5滴 溶液和5滴 溶液,观察沉淀情况 溶液,观察沉淀情况 | 比较 、 、 的大小 的大小 |
| D | 将 样品溶于稀盐酸后,滴加KSCN溶液,观察溶液是否变红 样品溶于稀盐酸后,滴加KSCN溶液,观察溶液是否变红 | 检验 样品是否变质 样品是否变质 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-08-01更新
|
800次组卷
|
7卷引用:选择性必修1(SJ)专题3专题综合检测
选择性必修1(SJ)专题3专题综合检测(已下线)3.4.1 难溶电解质的沉淀溶解平衡(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)安徽省六安市第一中学2021-2022学年高二下学期开学考试化学试题江西省赣州市赣县第三中学2021-2022学年高二上学期12月月考化学试卷河南省中原名校2021-2022学年高二上学期期末联考化学试题(已下线)第三章 水溶液中的离子反应与平衡(B卷·能力提升练)-【单元测试】2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修1)河南省南阳市第八中学校2022-2023学年高二上学期线上期末考试化学试题
7 . 为探究某食品包装袋内一小包脱氧剂中的还原铁粉是否变质,分别取少量样品溶于盐酸,再进行下列实验,其中结论正确的是
| A.若滴加KSCN溶液,溶液变红,说明铁粉变质 |
| B.若滴加KSCN溶液,溶液未变红,说明铁粉未变质 |
| C.若依次滴加氯水,KSCN溶液,溶液变红,说明铁粉全部变质 |
| D.若滴加KSCN溶液,溶液未变红;再滴加氯水,溶液变红,说明铁粉全部变质 |
您最近一年使用:0次
2022-02-27更新
|
1448次组卷
|
24卷引用:第一节 铁及其化合物 第2课时 铁盐、亚铁盐
第一节 铁及其化合物 第2课时 铁盐、亚铁盐天津市红桥区2020-2021学年高三上学期期中考试化学试题内蒙古包头市2021-2022学年高一上学期期末考试化学试题辽宁省沈阳市2021-2022学年高一上学期期末质量监测化学试题2广东省化州市第一中学2020-2021学年高一上学期期末考试化学试题北京市北京师范大学第二附属中学2022-2023学年高一上学期12月月考化学试题湖南省株洲世纪星高级中学2022-2023学年高一上学期期末考试化学试题广东省广州中学2022-2023学年高一上学期期末考试化学试题天津市南开中学2022-2023学年高一上学期期末考试化学试题吉林市田家炳高级中学2022-2023学年高一上学期期末考试化学试题内蒙古赤峰市红山区2022-2023学年高一上学期期末质量检测化学试题内蒙古包头市2022-2023学年高一上学期期末考试化学试题内蒙古呼伦贝尔市满洲里市第一中学2022-2023学年高一下学期第一次月考化学试题广东省东莞市南城开心实验学校2022-2023学年高一上学期12月半月考化学试题四川省绵阳南山中学2022-2023学年高一上学期期末模拟化学试题湖南省长沙市珺琟高级中学2023-2024学年高一上学期第二次月考化学试题 四川省宜宾市第四中学校2023-2024学年高一上学期1月期末化学试题云南省昆明市五华区2023-2024学年高一上学期1月期末化学试题天津市静海区第一中学2023-2024学年高一上学期12月月考化学试题浙江省丽水市三校联考2023-2024学年高一上学期12月月考化学试题四川省江油市太白中学2023-2024学年高一上学期第三次月考化学试题湖南省常德石门一中2023-2024年上学期高一年级化学期末考试卷(适用湖南地区))湖南省长沙市长郡中学2023-2024学年高一下学期选科适应性检测化学试卷河南省开封市联考2023-2024学年高一上学期1月期末化学试题
名校
8 . H2O2是医药、卫生行业上广泛使用的消毒剂。某课外小组采用滴定法测定某医用消毒剂中H2O2的浓度。实验步骤如下:
①标准液的配制和标定:称取一定量KMnO4固体溶于水,避光放置6~10天,过滤并取滤液于滴定管中待用,称取mgNa2C2O4固体于锥形瓶中,加水溶解,再加H2SO4酸化,滴定至终点,消耗KMnO4溶液的体积V1mL。滴定过程中发生的一个反应为:5H2C2O4+2MnO +6H+=2Mn2++10CO2↑+8H2O。
+6H+=2Mn2++10CO2↑+8H2O。
②H2O2浓度的测定:取待测样品25mL稀释至500mL,再移取10.00mL于锥形瓶中,加H2SO4酸化,用上述KMnO4标准液滴定至终点,消耗溶液的体积V2mL。
回答下列问题:
(1)②中移取10.00mL待测液所用主要仪器名称为___________ 。
(2)配制KMnO4标准液时需要久置并过滤掉变质生成的MnO2,该过滤操作需用___________ 。
a.普通漏斗和滤纸
b.不需滤纸的微孔玻璃漏斗
(3)标定KMnO4标准液时需要控制温度为75~85℃,温度过低反应较慢,温度过高可能会因___________ 而导致KMnO4标准液的标定浓度偏高,在恒定温度下进行滴定操作时,开始时反应速率较慢,随后加快,导致速率加快的原因是___________ 。
(4)KMnO4标准液滴定H2O2的离子方程式为___________ ;当滴定到___________ 可以认为已达到滴定终点。
(5)该医生消毒剂中H2O2的物质的量浓度为___________ mol·L-1。
(6)②中若用盐酸代替H2SO4测定结果将___________ (填“偏高”“偏低”或“无影响”)
①标准液的配制和标定:称取一定量KMnO4固体溶于水,避光放置6~10天,过滤并取滤液于滴定管中待用,称取mgNa2C2O4固体于锥形瓶中,加水溶解,再加H2SO4酸化,滴定至终点,消耗KMnO4溶液的体积V1mL。滴定过程中发生的一个反应为:5H2C2O4+2MnO
 +6H+=2Mn2++10CO2↑+8H2O。
+6H+=2Mn2++10CO2↑+8H2O。②H2O2浓度的测定:取待测样品25mL稀释至500mL,再移取10.00mL于锥形瓶中,加H2SO4酸化,用上述KMnO4标准液滴定至终点,消耗溶液的体积V2mL。
回答下列问题:
(1)②中移取10.00mL待测液所用主要仪器名称为
(2)配制KMnO4标准液时需要久置并过滤掉变质生成的MnO2,该过滤操作需用
a.普通漏斗和滤纸
b.不需滤纸的微孔玻璃漏斗
(3)标定KMnO4标准液时需要控制温度为75~85℃,温度过低反应较慢,温度过高可能会因
(4)KMnO4标准液滴定H2O2的离子方程式为
(5)该医生消毒剂中H2O2的物质的量浓度为
(6)②中若用盐酸代替H2SO4测定结果将
您最近一年使用:0次
名校
9 . 为探究某食品包装袋内一小包脱氧剂中的还原铁粉是否变质,分别取少量样品溶于盐酸,再进行下列实验,其中结论正确的是
| A.若滴加KSCN溶液,溶液变红,说明铁粉变质 |
| B.若滴加KSCN溶液,溶液未变红,说明铁粉未变质 |
| C.若依次滴加氯水、KSCN溶液,溶液变红,说明铁粉全部变质 |
| D.若滴加KSCN溶液,溶液未变红;再滴加氯水,溶液变红,说明铁粉部分变质 |
您最近一年使用:0次
2021-04-07更新
|
1029次组卷
|
16卷引用:人教2019版必修第一册第三章 铁 金属材料复习与提高
人教2019版必修第一册第三章 铁 金属材料复习与提高9.2.1反应的合理选择(课中)-2019苏教版必修2课前课中课后天津市和平区2017-2018学年高一上学期期末考试化学试题安徽省芜湖市第一中学2020-2021学年高一上学期第二次月考化学试题辽宁省沈阳市2020-2021学年高一上学期期末质量监测化学试题山西省怀仁市2020-2021学年高一上学期期末考试化学试题云南省曲靖市第二中学2020-2021学年高一上学期期末考试化学试题黑龙江省鹤岗市绥滨县第一中学2020-2021学年高一上学期期末考试化学(理)试题浙江省余姚中学2020-2021 学年高一上学期期中考试化学试题河北省石家庄精英中学2020-2021学年高二下学期期末考试化学试题(已下线)专题六 铁及其化合物(A卷)-2021-2022学年高一化学优选好题单元专题双测卷(人教版2019必修第一册)天津市静海区第一中学2021-2022学年高三上学期(9月)学生学业能力调研化学试题河南省洛阳市2021-2022学年高一上学期期末考试化学试题浙江省宁波市效实中学2022-2023学年高一上学期期中考试化学试题安徽省芜湖市2022-2023学年高一上学期期末教学质量统测化学试题河北师范大学附属中学2023-2024学年高一上学期12月月考化学试题
20-21高一上·浙江·期中
名校
解题方法
10 . 富脂食品密封保存往往需要在包装袋内装一小包脱氧剂(有效成分是还原铁粉),某小组为探究脱氧剂中铁粉是否变质,取少量样品溶于稀盐酸,再进行下列实验,下列有关实验现象和结论的说法正确的是
| A.若加盐酸时有气体产生,则证明脱氧剂未变质 |
| B.若滴加KSCN溶液,无明显变化,再滴加氯水显血红色,则证明脱氧剂未变质 |
| C.若滴加KSCN溶液,溶液显血红色,则证明脱氧剂已变质 |
| D.若加入铜粉充分反应后,溶液呈蓝色,则证明脱氧剂已完全变质 |
您最近一年使用:0次
2021-04-29更新
|
419次组卷
|
5卷引用:3.1.2 铁盐和亚铁盐-2021-2022学年高一化学课后培优练(人教版2019必修第一册)
(已下线)3.1.2 铁盐和亚铁盐-2021-2022学年高一化学课后培优练(人教版2019必修第一册)(已下线)【浙江新东方】【2021.4.27】【宁波】【高一上】【高中化学】【00151】.(已下线)易错专题23 Fe2+和Fe3+的检验与转化-【突破易错·冲刺满分】2021-2022学年高一上学期化学期中期末易错专题(人教版2019)河南省信阳市2022-2023学年高一上学期1月期末考试化学试题河南省濮阳市第一高级中学2022-2023学年高一上学期期中考试化学试题



