名校
解题方法
1 . 某小组设计实验制备苯甲酸:
【原理】
 苯甲醛(新蒸),
苯甲醛(新蒸),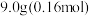 氢氧化钾,乙醚,
氢氧化钾,乙醚, 碳酸钠溶液,浓盐酸。
碳酸钠溶液,浓盐酸。
【资料】
乙醚的密度为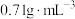 ,乙醚沸点为34.5℃。苯甲醛沸点为179℃。
,乙醚沸点为34.5℃。苯甲醛沸点为179℃。
【步骤】
①在锥形瓶中将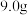 氢氧化钾溶于
氢氧化钾溶于 水配成溶液,冷却至室温后,加入
水配成溶液,冷却至室温后,加入 新蒸馏过的苯甲醛。用橡胶塞塞紧瓶口,用力振摇,使反应物充分混合,最后成为白色糊状物,放置
新蒸馏过的苯甲醛。用橡胶塞塞紧瓶口,用力振摇,使反应物充分混合,最后成为白色糊状物,放置 以上。
以上。
②向反应混合物中逐滴加入足量的水(约 ),不断振摇使其中的苯甲酸盐全部溶解。将溶液倒入分液漏斗,每次用
),不断振摇使其中的苯甲酸盐全部溶解。将溶液倒入分液漏斗,每次用 乙醚萃取三次。合并乙醚萃取液,依次用饱和亚硫酸氢钠溶液、10%碳酸钠溶液及水洗涤,最后加入无水硫酸镁或无水碳酸钾,过滤。
乙醚萃取三次。合并乙醚萃取液,依次用饱和亚硫酸氢钠溶液、10%碳酸钠溶液及水洗涤,最后加入无水硫酸镁或无水碳酸钾,过滤。
③过滤后蒸馏,收集204~206℃的馏分。
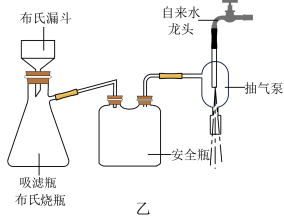
④乙醚萃取后的水溶液,用浓盐酸酸化。充分冷却使苯甲酸析出完全,抽滤,如图乙所示。粗产品用水重结晶,得苯甲酸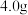 。
。
(1)苯甲醇中最多有___________ 个原子共平面。
(2)乙醚萃取时分离有机相部分操作如下,正确的先后顺序为___________ (填标号);分离乙醚相的具体操作是___________ 。
a.振荡,放气 b.加入萃取剂 c.静置、分层 d.分液
(3)乙醚溶液依次用饱和 溶液、
溶液、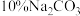 溶液洗涤,其目的依次是
溶液洗涤,其目的依次是___________ 、___________ 。
(4)乙醚萃取后的水溶液,用浓盐酸酸化到中性是否最恰当?___________ (填“最恰当”或“不恰当”),理由是___________ 。
(5)相对普通过滤,利用图乙装置进行抽滤操作的优点主要有___________ 、___________ (答两点)。
(6)本实验的苯甲酸产率约为___________(填标号)。
【原理】
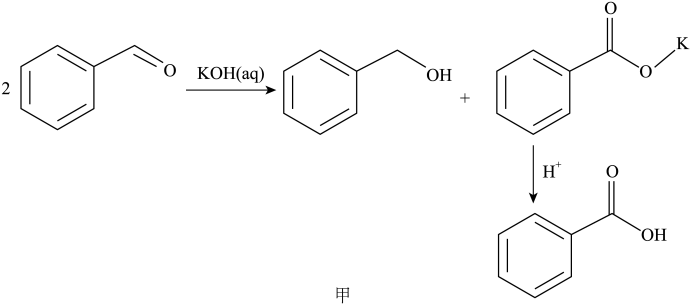
 苯甲醛(新蒸),
苯甲醛(新蒸),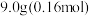 氢氧化钾,乙醚,
氢氧化钾,乙醚, 碳酸钠溶液,浓盐酸。
碳酸钠溶液,浓盐酸。【资料】
乙醚的密度为
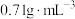 ,乙醚沸点为34.5℃。苯甲醛沸点为179℃。
,乙醚沸点为34.5℃。苯甲醛沸点为179℃。【步骤】
①在锥形瓶中将
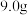 氢氧化钾溶于
氢氧化钾溶于 水配成溶液,冷却至室温后,加入
水配成溶液,冷却至室温后,加入 新蒸馏过的苯甲醛。用橡胶塞塞紧瓶口,用力振摇,使反应物充分混合,最后成为白色糊状物,放置
新蒸馏过的苯甲醛。用橡胶塞塞紧瓶口,用力振摇,使反应物充分混合,最后成为白色糊状物,放置 以上。
以上。②向反应混合物中逐滴加入足量的水(约
 ),不断振摇使其中的苯甲酸盐全部溶解。将溶液倒入分液漏斗,每次用
),不断振摇使其中的苯甲酸盐全部溶解。将溶液倒入分液漏斗,每次用 乙醚萃取三次。合并乙醚萃取液,依次用饱和亚硫酸氢钠溶液、10%碳酸钠溶液及水洗涤,最后加入无水硫酸镁或无水碳酸钾,过滤。
乙醚萃取三次。合并乙醚萃取液,依次用饱和亚硫酸氢钠溶液、10%碳酸钠溶液及水洗涤,最后加入无水硫酸镁或无水碳酸钾,过滤。③过滤后蒸馏,收集204~206℃的馏分。
④乙醚萃取后的水溶液,用浓盐酸酸化。充分冷却使苯甲酸析出完全,抽滤,如图乙所示。粗产品用水重结晶,得苯甲酸
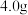 。
。
(1)苯甲醇中最多有
(2)乙醚萃取时分离有机相部分操作如下,正确的先后顺序为
a.振荡,放气 b.加入萃取剂 c.静置、分层 d.分液
(3)乙醚溶液依次用饱和
 溶液、
溶液、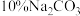 溶液洗涤,其目的依次是
溶液洗涤,其目的依次是(4)乙醚萃取后的水溶液,用浓盐酸酸化到中性是否最恰当?
(5)相对普通过滤,利用图乙装置进行抽滤操作的优点主要有
(6)本实验的苯甲酸产率约为___________(填标号)。
A. | B. | C.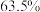 | D. |
您最近一年使用:0次
名校
2 . L是一种治疗自主神经功能障碍药物的活性成分,以A为原料合成L的流程如图所示。
(1)下列说法正确的是___________。
(2)E的结构简式为___________ 。
(3)H→I第一步反应的化学方程式为___________ 。
(4)设计F→G,H→I步骤的目的是___________ 。
(5)G→H中 可以用吡啶(
可以用吡啶(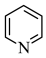 )替代,吡啶的作用是
)替代,吡啶的作用是___________ 。
(6)在E的芳香族同分异构体中,同时具备下列条件的结构有___________ 种。
①既能发生水解反应,又能发生银镜反应;
②1mol有机物最多能与3molNaOH反应;
③1mol有机物与足量的Na反应能生成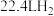 (标准状况)。
(标准状况)。
(7)设计以苯乙醛为原料制备吸湿性高分子材料(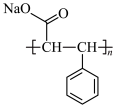 )的合成路线
)的合成路线___________ (无机试剂任选)。

(1)下列说法正确的是___________。
| A.A的名称是3-甲基苯酚 | B.B、C中均无手性碳原子 |
| C.H中官能团有酯基、醚键 | D.J→L为取代反应 |
(2)E的结构简式为
(3)H→I第一步反应的化学方程式为
(4)设计F→G,H→I步骤的目的是
(5)G→H中
 可以用吡啶(
可以用吡啶( )替代,吡啶的作用是
)替代,吡啶的作用是(6)在E的芳香族同分异构体中,同时具备下列条件的结构有
①既能发生水解反应,又能发生银镜反应;
②1mol有机物最多能与3molNaOH反应;
③1mol有机物与足量的Na反应能生成
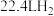 (标准状况)。
(标准状况)。(7)设计以苯乙醛为原料制备吸湿性高分子材料(
 )的合成路线
)的合成路线
您最近一年使用:0次
2024-06-10更新
|
381次组卷
|
4卷引用:辽宁省部分高中期中联考2023-2024学年高三下学期5月期中考试化学试题
名校
解题方法
3 . 下列根据实验方案设计及现象得出结论错误的是
| 选项 | 实验设计及现象 | 结论 |
| A | 向碘的 溶液中加入等体积浓 溶液中加入等体积浓 溶液,振荡。溶液分层,下层紫红色变浅粉红色,上层呈棕黄色 溶液,振荡。溶液分层,下层紫红色变浅粉红色,上层呈棕黄色 | 碘在浓 溶液中溶解能力大于在 溶液中溶解能力大于在 中溶解能力 中溶解能力 |
| B | 有机物A加入 乙醇溶液中,充分加热;冷却后,取混合液加足量硝酸酸化,滴加硝酸银溶液,产生白色沉淀 乙醇溶液中,充分加热;冷却后,取混合液加足量硝酸酸化,滴加硝酸银溶液,产生白色沉淀 | 有机物 可能是氯代烃 可能是氯代烃 |
| C | 向 溶液中,先加 溶液中,先加 溶液调节 溶液调节 ,有红褐色沉淀生成,再加入足量的KSCN溶液,沉淀不溶解 ,有红褐色沉淀生成,再加入足量的KSCN溶液,沉淀不溶解 | 该实验条件下, 结合 结合 的能力比 的能力比 强 强 |
| D | 常温下,用 计分别测定浓度均为 计分别测定浓度均为 的 的 溶液和 溶液和 溶液的 溶液的 ,测得 ,测得 均为7.0 均为7.0 | 两溶液中水的电离程度相同 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
4 .  不仅可以和
不仅可以和 反应生成
反应生成 ,还可以在电解条件下生成
,还可以在电解条件下生成 、
、 、
、 、尿素
、尿素 等多种物质。下列说法正确的是
等多种物质。下列说法正确的是
 不仅可以和
不仅可以和 反应生成
反应生成 ,还可以在电解条件下生成
,还可以在电解条件下生成 、
、 、
、 、尿素
、尿素 等多种物质。下列说法正确的是
等多种物质。下列说法正确的是A. 、 、 和 和 属于同素异形体 属于同素异形体 |
B. 分子中的化学键均为极性共价键 分子中的化学键均为极性共价键 |
C. 转化为有机物一定发生了还原反应 转化为有机物一定发生了还原反应 |
D. 、 、 、 、 中碳原子的杂化轨道类型相同 中碳原子的杂化轨道类型相同 |
您最近一年使用:0次
5 . 研究低碳铬钢分别在不同温度下、不同硫酸浓度下的腐蚀情况,如下图所示,有关说法正确的是
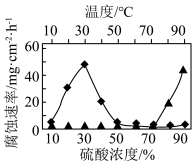
| A.约30℃时,低碳铬钢腐蚀严重 | B.30%硫酸,大量发生吸氧腐蚀 |
C.硫酸浓度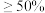 ,低碳铬钢钝化 ,低碳铬钢钝化 | D.超过70℃后,实验中有 生成 生成 |
您最近一年使用:0次
6 . 侯氏制碱法原理为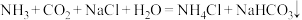 。下列说法正确的是
。下列说法正确的是
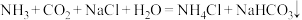 。下列说法正确的是
。下列说法正确的是A.基态碳原子价电子排布式: | B. 为极性分子 为极性分子 |
C. 的电子式: 的电子式: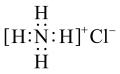 | D. 为共价晶体 为共价晶体 |
您最近一年使用:0次
2024-06-05更新
|
107次组卷
|
2卷引用:江苏省南通市2023-2024学年高三下学期期中考试化学试题
7 . 探索在温和条件下合成氨具有重要意义。
(1)合成氨中每生成2molNH3,放出92.2kJ热量。 N—H键断裂吸收的能量约等于
N—H键断裂吸收的能量约等于___________ kJ。
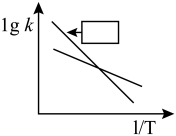
②合成氨反应速率常数k(通常情况下,反应速率常数越大,反应越快)随温度的变化曲线如题图1所示,请在图中指定位置标出 或
或
___________ 。
I.熔融盐电解
一种以熔融 (添加0.5%
(添加0.5%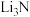 )为电解质,以多孔镍为电极材料,在常压下电化学合成氨的原理如图所示。
)为电解质,以多孔镍为电极材料,在常压下电化学合成氨的原理如图所示。___________ 。
②若用H2S代替H2电化学合成氨,写出可能出现的副产物的化学式:___________ 。
II.水系电解
在常规水系电解液中,以N2和H2O为反应物,常温常压下在催化剂的作用下实现氨的合成: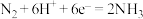 ,但H2O放电生成H2导致合成氨选择性较低。
,但H2O放电生成H2导致合成氨选择性较低。
③研究表明,控制电极-电解液界面处的质子源的浓度,将有效抑制副反应。以 作催化剂、甲醇为溶剂、水为质子源配制甲醇-水混合电解液,相对常规水系电解液,氨的选择性更高。其可能原因是
作催化剂、甲醇为溶剂、水为质子源配制甲醇-水混合电解液,相对常规水系电解液,氨的选择性更高。其可能原因是___________ 。
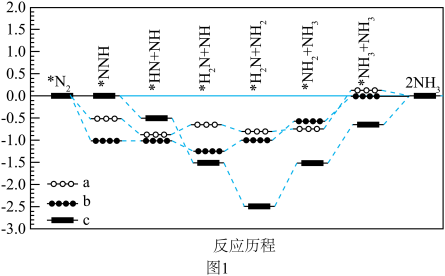
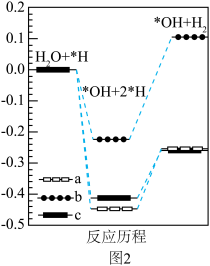
④水溶液中三种催化剂(a、b、c)上N2电还原为NH3(图1)和H2O电还原为H2(图2)反应历程中的能量变化,则三种催化剂对N2电还原为NH3的催化活性由强到弱的顺序为___________ (用字母a、b、c排序)。
(1)合成氨中每生成2molNH3,放出92.2kJ热量。

 N—H键断裂吸收的能量约等于
N—H键断裂吸收的能量约等于②合成氨反应速率常数k(通常情况下,反应速率常数越大,反应越快)随温度的变化曲线如题图1所示,请在图中指定位置标出
 或
或
I.熔融盐电解
一种以熔融
 (添加0.5%
(添加0.5%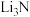 )为电解质,以多孔镍为电极材料,在常压下电化学合成氨的原理如图所示。
)为电解质,以多孔镍为电极材料,在常压下电化学合成氨的原理如图所示。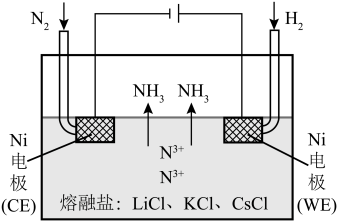
②若用H2S代替H2电化学合成氨,写出可能出现的副产物的化学式:
II.水系电解
在常规水系电解液中,以N2和H2O为反应物,常温常压下在催化剂的作用下实现氨的合成:
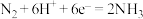 ,但H2O放电生成H2导致合成氨选择性较低。
,但H2O放电生成H2导致合成氨选择性较低。③研究表明,控制电极-电解液界面处的质子源的浓度,将有效抑制副反应。以
 作催化剂、甲醇为溶剂、水为质子源配制甲醇-水混合电解液,相对常规水系电解液,氨的选择性更高。其可能原因是
作催化剂、甲醇为溶剂、水为质子源配制甲醇-水混合电解液,相对常规水系电解液,氨的选择性更高。其可能原因是④水溶液中三种催化剂(a、b、c)上N2电还原为NH3(图1)和H2O电还原为H2(图2)反应历程中的能量变化,则三种催化剂对N2电还原为NH3的催化活性由强到弱的顺序为
您最近一年使用:0次
2024-06-05更新
|
99次组卷
|
2卷引用:江苏省南通市2023-2024学年高三下学期期中考试化学试题
8 . 抗氧化剂香豆酰缬氨酸乙酯(Z)可由下列反应制得不正确 的是
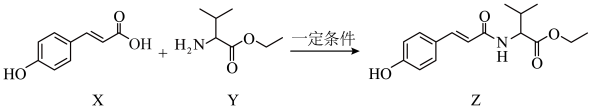
| A.该反应是取代反应 | B. 最多可以消耗 最多可以消耗 |
C.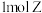 最多可以消耗 最多可以消耗 | D.Z分子存在2个手性碳原子 |
您最近一年使用:0次
2024-06-05更新
|
169次组卷
|
2卷引用:江苏省南通市2023-2024学年高三下学期期中考试化学试题
名校
解题方法
9 .  是一种高效多功能的绿色消毒剂和水处理剂。但是由于存在自催化现象[即分解产物
是一种高效多功能的绿色消毒剂和水处理剂。但是由于存在自催化现象[即分解产物 可催化高铁酸盐的分解],限制了它的大规模应用,研究使其稳定的方法尤为关键。
可催化高铁酸盐的分解],限制了它的大规模应用,研究使其稳定的方法尤为关键。
已知:①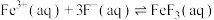
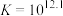
②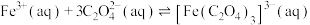

I.制备高铁酸盐
(1)在碱性条件下以多孔的磁铁矿作阳极电解制备高铁酸盐的电极反应式是___________ 。
Ⅱ.高铁酸盐稳定性的研究
(2)碱性环境下,久置的 溶液中除了产生红褐色
溶液中除了产生红褐色 外,同时还会产生绿色的
外,同时还会产生绿色的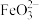 ,此过程的反应为
,此过程的反应为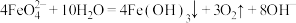 、
、___________ 。
为研究使稳定的方法,分别做以下4个实验:
资料:吸光度大小与溶液中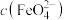 成正比。
成正比。___________ ,但吸光度结果图显示甲同学预测并不正确,原因可能是d试管加入的 与
与 发生配位反应的速率
发生配位反应的速率___________ (填“快”或“慢”),且进行程度大,导致催化剂 量减少,
量减少, 的分解速率
的分解速率___________ (填“快”或“慢”)。
(4)乙同学推测“ ”曲线为试管c的实验结果,依据是
”曲线为试管c的实验结果,依据是___________ 。
(5)综合以上分析,为增强高铁酸盐的稳定性,可向其中加入___________ (填化学式)。
Ⅲ.高铁酸盐产品纯度的测定
称取mg高铁酸钾粗品,配成250mL溶液,准确量取25.00mL放入锥形瓶,加入足量 和NaOH溶液,振荡,再加入稀硫酸酸化后得到
和NaOH溶液,振荡,再加入稀硫酸酸化后得到 和
和 ,滴入几滴二苯胺磺酸钠作指示剂,用
,滴入几滴二苯胺磺酸钠作指示剂,用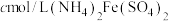 标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗
标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗 标准溶液VmL。
标准溶液VmL。
(6)粗品中 的质量分数为
的质量分数为___________ 。[已知: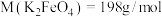 ]
]
 是一种高效多功能的绿色消毒剂和水处理剂。但是由于存在自催化现象[即分解产物
是一种高效多功能的绿色消毒剂和水处理剂。但是由于存在自催化现象[即分解产物 可催化高铁酸盐的分解],限制了它的大规模应用,研究使其稳定的方法尤为关键。
可催化高铁酸盐的分解],限制了它的大规模应用,研究使其稳定的方法尤为关键。已知:①
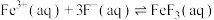
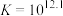
②
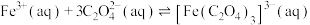

I.制备高铁酸盐
(1)在碱性条件下以多孔的磁铁矿作阳极电解制备高铁酸盐的电极反应式是
Ⅱ.高铁酸盐稳定性的研究
(2)碱性环境下,久置的
 溶液中除了产生红褐色
溶液中除了产生红褐色 外,同时还会产生绿色的
外,同时还会产生绿色的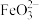 ,此过程的反应为
,此过程的反应为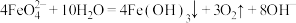 、
、为研究使稳定的方法,分别做以下4个实验:
| 序号 |  | 现象 | |
| a | 2滴0.01mol/LKI溶液 | 紫色迅速褪去 |
| b | 2滴蒸馏水 | 分别用紫外可见分光光度计测三支试管内溶液的吸光度,结果如下图所示。 | |
| c | 2滴0.01mol/LNaF溶液 | ||
| d | 2滴 溶液 溶液 |
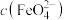 成正比。
成正比。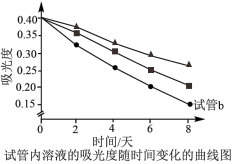
 与
与 发生配位反应的速率
发生配位反应的速率 量减少,
量减少, 的分解速率
的分解速率(4)乙同学推测“
 ”曲线为试管c的实验结果,依据是
”曲线为试管c的实验结果,依据是(5)综合以上分析,为增强高铁酸盐的稳定性,可向其中加入
Ⅲ.高铁酸盐产品纯度的测定
称取mg高铁酸钾粗品,配成250mL溶液,准确量取25.00mL放入锥形瓶,加入足量
 和NaOH溶液,振荡,再加入稀硫酸酸化后得到
和NaOH溶液,振荡,再加入稀硫酸酸化后得到 和
和 ,滴入几滴二苯胺磺酸钠作指示剂,用
,滴入几滴二苯胺磺酸钠作指示剂,用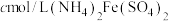 标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗
标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗 标准溶液VmL。
标准溶液VmL。(6)粗品中
 的质量分数为
的质量分数为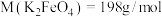 ]
]
您最近一年使用:0次
2024-06-05更新
|
273次组卷
|
4卷引用:辽宁省部分高中期中联考2023-2024学年高三下学期5月期中考试化学试题
10 . 下列离子方程式正确的是
| 选项 | 尾气处理 | 离子方程式 |
| A | 用 溶液吸收 溶液吸收 |  |
| B | 用 溶液吸收 溶液吸收 |  |
| C | 用 溶液吸收 溶液吸收 |  |
| D | 用 悬浊液吸收 悬浊液吸收 |  |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次




